野生多花兰组培苗的驯化研究
2022-10-13唐映红李佳娜
文 雯 唐映红, 伍 茗 李佳娜 龙 圆
(1.湖南文理学院/生命与环境科学学院,湖南 常德 415000;2.湖南常德市人工智能与生物医药研究中心,湖南 常德 415000;3.湖南常德市农业生物大分子研究中心,湖南 常德 415000)
多花兰(Cymbidium floribundum)又称蜜蜂兰,是兰科兰属的一种附生植物,是《濒危野生动植物种国际贸易公约》附录二物种中的一员,是国家Ⅱ级保护野生植物。多花兰叶革质肥厚,具有光泽,花芽易分化,花朵多达40朵以上,色泽鲜艳,花期长,具有较高的观赏价值。多花兰具有药用价值:其根可作为药用,滋阴清肺,化痰止咳。多花兰株型、花朵数及花色等方面均有丰富的变异,能耐高温和低温,《国际兰花新品种名录(New Orchid Hy-brids)》和国内发现的兰属原生种的杂交利用情况显示多花兰杂种数量均排在前5名,其在新品种培育中具有重要应用价值。
目前,我国栽培的国兰品种绝大多数都是由野生种类引种驯化而来。多花兰的繁殖多以分株繁殖为主,繁殖速度较慢,且兰科种子很小,内含一些发育不完全的球形胚,无胚乳,自然状态下很难萌发。因此,由于大量的野地采挖,造成多花兰资源的巨大破坏和浪费。自种子无菌萌发技术如建兰(Cymbidium ensifolium)、蕙兰(Cymbidium faberi)等获得成功后,已建立起蝴蝶兰(Phalaenopsis aphrodite)等的快繁体系,部分品种已达到产业化生产阶段,大大带动整个兰花的产业化。
本研究前期建立了野生多花兰种子无菌萌发形成原球茎、原球茎增殖和出芽、芽生根的组织培养快繁体系,不仅保存了其种质资源,而且获得了大量的野生多花兰组培苗。因此,本研究以该野生多花兰组培苗为材料,研究不同营养液和不同基质对组培苗驯化成活和生长的影响,旨在研究出简易便于推广的多花兰组培苗驯化方案,为多花兰种苗工厂化生产提供基础,对多花兰野生资源的保护和回归、建立多花兰无土农业或发展多花兰都市农业均具有重要意义。
1.材料与方法
1.1 植物材料
试验材料为野生多花兰组培苗。
1.2 不同营养液对多花兰组培苗的驯化研究
当多花兰组培苗长至5-6 cm时,打开组培瓶瓶盖,洗净植株根部固体培养基,转接到13组不同营养液中进行驯化(简称驯化苗1)。营养液分别为稀释不同倍数的1/2MS(Murashige and Skoog)、1/4MS、1/8MS和花宝一号(Hyponex, HP),自来水为对照,将营养液EC值控制在2.0-3.5 mmhos·cm-1间,pH值在5.4-6.0,不含琼脂和蔗糖。采用静止式水培,即将组培苗插在泡沫盘的孔内固定住植株,再将泡沫盘放入装有营养液的水培箱中,使其漂浮在水培箱中,根浸在营养液中,每个处理组48株,重复2次。在75%荫蔽处培养,温度为20-26℃,平均每7 d更换1次营养液,若蒸腾作用过大则适当加蒸馏水。培养60 d后统计驯化成活率,成活率(%)=(成活植株数/总植株数)×100,每个处理组随机抽取5株测量其根长和最长叶长表示株高。
1.3 不同基质对多花兰组培苗的驯化研究
当多花兰组培苗长至5-6 cm时,打开培养瓶瓶盖,组培温室内培养3 d;再加水室温室内培养3 d;然后洗净植株根部固体培养基,用500倍多菌灵消毒植株根部15 s备用(简称驯化苗2)。将驯化苗1和2移栽到6组不同基质中培养,每组移栽48株,重复2次,移栽之后浇透水,在75%荫蔽处培养,温度为20-26℃。培养60 d后统计成活率,成活率(%)=移栽成活株数/移栽总株数×100。
1.4 统计分析
试验数据采用平均值±标准误表示,采用SPSS 26.0软件进行方差分析,采用新复极差法进行多重比较。
2.结果与分析
2.1 不同营养液对驯化苗成活的影响
方差分析结果显示(表1),不同营养液对驯化苗成活的影响表现出极显著差异。通过多重比较可以看出(表2),处理组2和处理组4驯化苗的成活率分别为98.96%和95.29%,显著高于其他处理组;其次是处理组10的驯化苗成活率为85.46%,显著高于其他处理组;处理组1的驯化苗成活率最低,为21.17%,且显著低于对照组驯化苗的成活率39.71%。处理组2(图1)和处理组4(图2)驯化前随机选取的5株组培苗培养60 d后全部成活,并且株高伸长,叶片深绿色,生长状况良好。

图1 1/2 MS(稀释500倍)驯化前后苗生长情况(处理组2)

图2 1/4 MS(稀释50倍)驯化前后苗生长情况(处理组4)

表1 不同营养液对驯化苗成活的方差分析
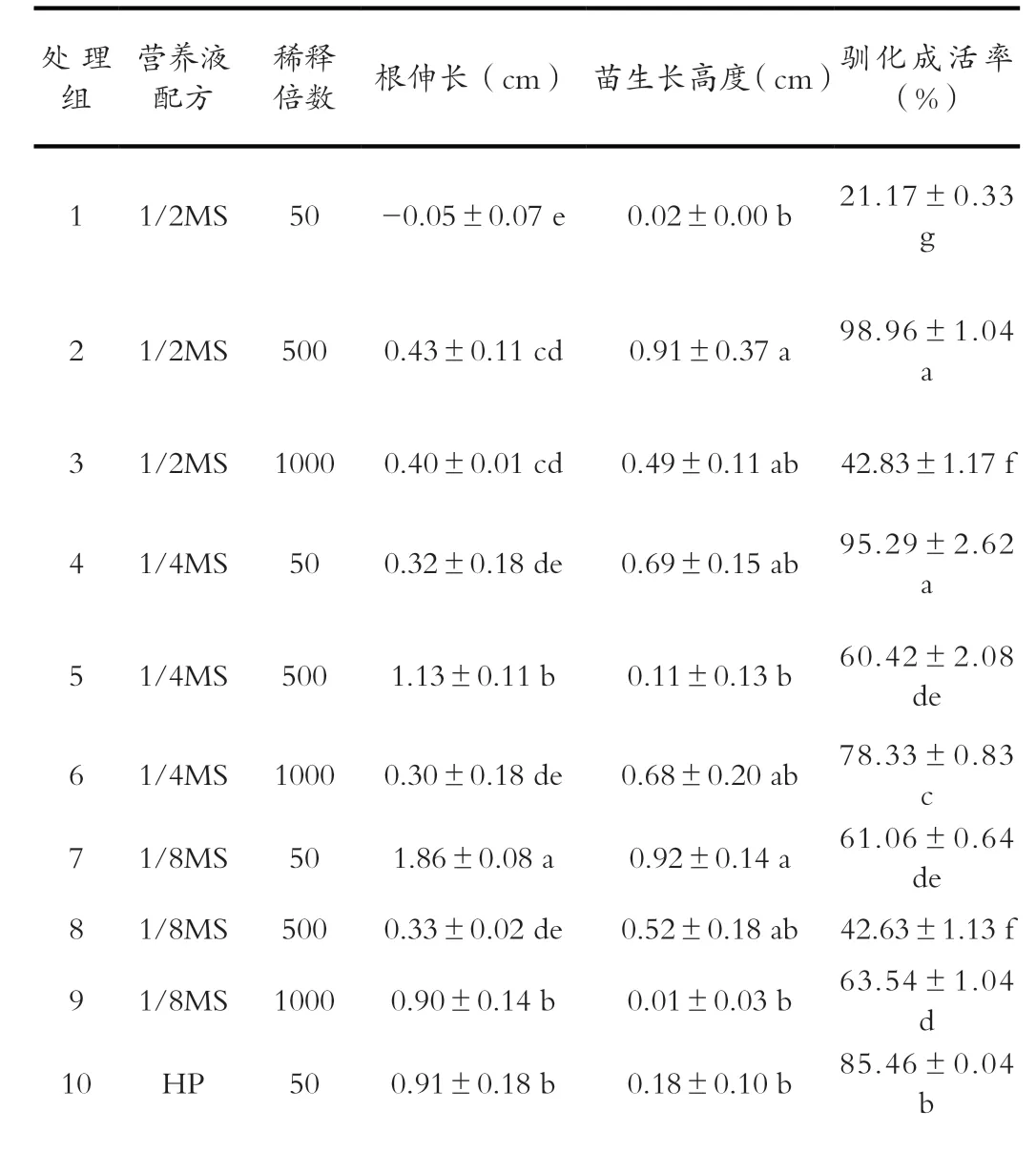
表2 不同营养液对驯化苗成活与生长的影响(培养60 d)

11 HP 5000.23±0.11 de 0.39±0.27 ab 79.38±1.88 c 12 HP 10000.75±0.17 bc 0.18±0.40 b 57.92±0.42 e 13 water CK -0.07±0.09 e 0.04±0.12 b 39.71±0.71 f
同列不同小写字母表示差异显著(P<0.05),下同
2.2 不同营养液对驯化苗根生长的影响
方差分析结果显示(表3),不同营养液对驯化苗根生长的影响表现出极显著差异。通过多重比较可以看出(表2),组培苗移栽入处理7营养液中培养60 d根平均伸长1.86 cm,显著高于其他处理;处理5、处理9、处理10营养液中培养60 d后根平均伸长均约为1 cm;稀释50倍的1/2MS营养液和自来水中苗的根没有生长,根腐烂反而使根长减短。
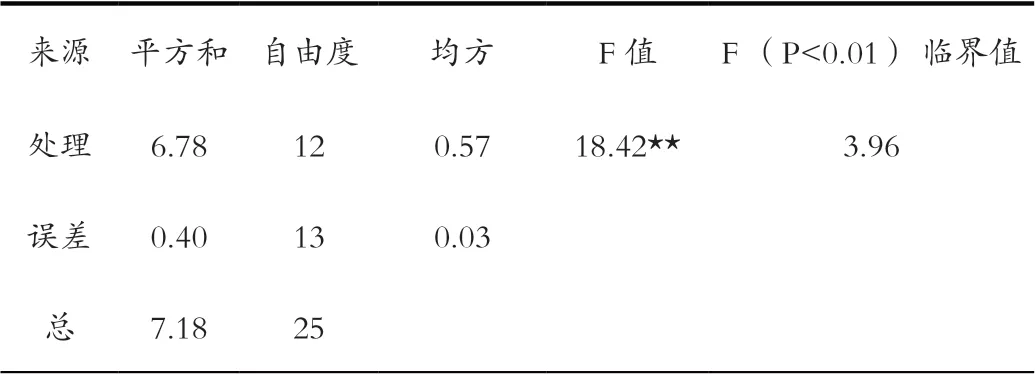
表3 不同营养液对驯化苗根生长的方差分析
驯化后所有处理组(除处理组1和13外)中苗的根均有伸长,但许多小根发生腐烂使根的数量均减少(图3A,以处理组7为例作图),驯化前浅绿色的根(图3B)经驯化后均变成深绿色或棕色根(图3A)。

图3 1/8 MS(稀释50倍)驯化前后苗根生长情况(处理7)
2.3 不同营养液对驯化苗生长的影响
方差分析结果显示(表4),不同营养液对驯化苗生长的影响表现出显著差异。通过多重比较可以看出(表2),驯化苗株高伸长较多的是处理组2(图1)和处理组7(图3),均伸长约0.9 cm;驯化苗株高几乎没有变化的是处理组1、9和13;所有处理组均有少量外侧叶片黄化脱落,也有新叶片形成,中心叶片均有不同程度的伸长,所有叶片颜色由驯化前的浅绿色变成深绿色,叶片变得较驯化前硬(图1)。
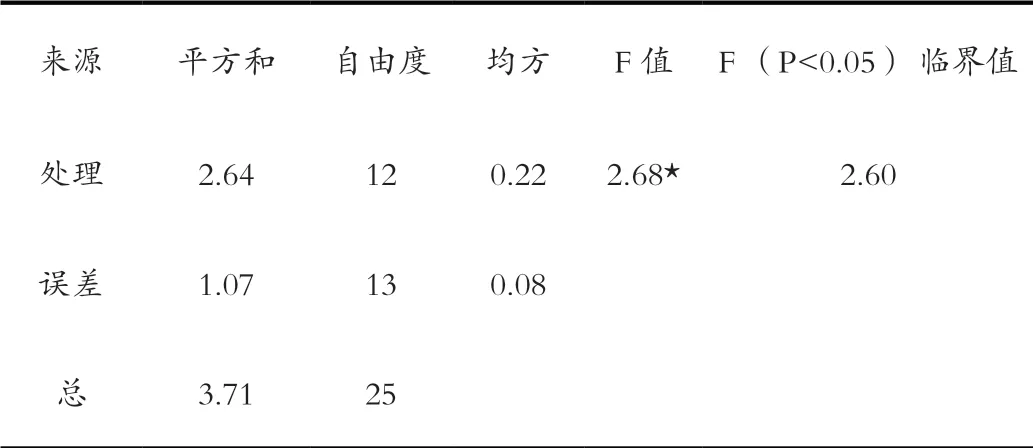
表4 不同营养液对驯化苗生长的方差分析
2.4 不同基质对驯化苗成活的影响
将在稀释500倍的1/2MS营养液中培养60 d的驯化苗1(图4A),以及驯化苗2(图4B)转移到6组不同基质中培养。方差分析结果显示(表5),不同基质对驯化苗成活的影响表现出极显著差异,驯化苗1和2在不同基质中的成活也表现出显著差异。多重比较结果显示(表6),驯化苗1和2移栽入基质6(林下腐殖土:风化石=3∶1, v/v)中培养60 d的成活率分别约为88%和99%,显著高于其他基质(基质2除外);整体来看,成活率较高的是含有腐殖土的基质,显著高于不含腐殖土的基质;不同基质中驯化苗1的成活率显著高于驯化苗2。综上所述,获得的最优多花兰组培苗驯化基质为林下腐殖土:风化石=3∶1(v/v),在该基质中培养60 d叶片明显伸长,叶色翠绿,植株生长约1 cm(图4C)。
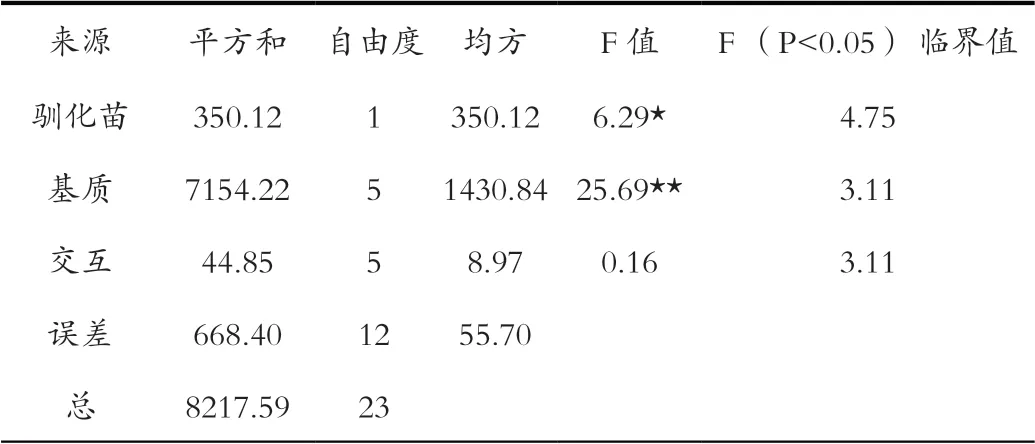
表5 不同基质对驯化苗成活的方差分析
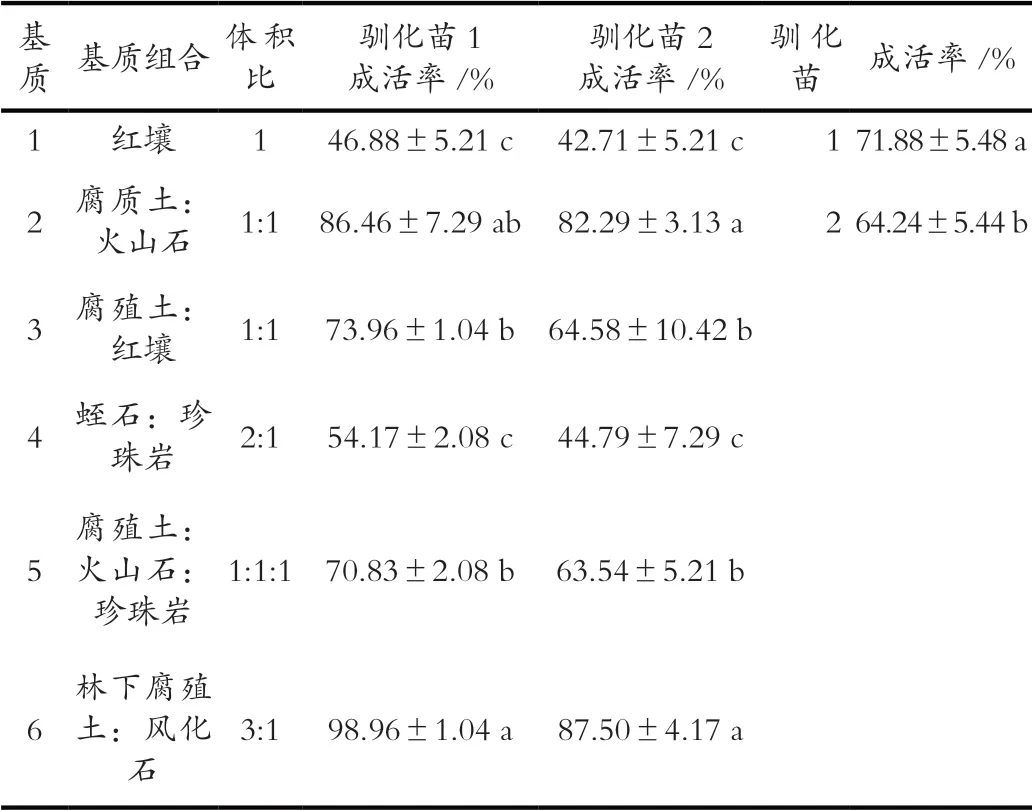
表6 不同基质对驯化苗成活的影响(培养60 d)

图4 基质6对多花兰组培苗的驯化研究
3.讨论
目前几乎没有采用营养液培养多花兰相关的报道,其他兰科植物多采用霍格兰营养液配方、日本园试配方和杨少辉试验配方或改变元素含量等相应改良的配方进行水培,伍成厚等采用改良杨少辉试验配方培养100 d后的五唇兰植株成活率为95.8%。本研究最优营养液中(稀释500倍的1/2MS营养液)培养60 d后的驯化苗成活率可达99%,苗增高0.91 cm,优于周启贵等采用的营养液培养春兰的株高增量。本研究采用的稀释50倍的1/8MS营养液可使驯化苗根伸长1.86 cm、苗增高0.92 cm,优于其他兰科研究所采用的营养液。本研究结果显示两种不同浓度的大量元素对驯化苗的成活和根的生长存在差异,但生长差异不显著。若要获得成活率高的驯化苗则采用稀释500倍的1/2MS营养液,若要获得根生长较多的驯化苗则采用稀释50倍的1/8MS营养液。因此,本研究获得的最适营养液是延用组织培养所用培养基,对提高组培苗驯化成活具有一定的作用,后期选择经稀释500倍的1/2MS营养液驯化60 d的苗,移栽入基质中继续驯化培养,提高最终的田间移栽成活率。
本研究获得的最优多花兰组培苗的驯化基质为林下腐殖土:风化石=3∶1(v/v),此基质模拟野生多花兰的生长环境,效果优于其他无土基质。驯化苗2在该基质中培养60 d成活率达88%,但成活率都较低于已报到的其他兰科植物,如碎火砖块:腐质土=1∶1(v/v)的基质培养50 d后的成活率达90%,草炭:珍珠岩:火山石=3∶3∶4(v/v/v)基质中培养60 d后成活率达到96%;本研究经前期营养液驯化60 d后的驯化苗1,在该基质中培养60 d成活率高达99%,优于已报到的多花兰或其他兰科移栽成活率。本研究使用腐殖土基质的成活率高于其他基质的,可能是因为腐殖土成分与野外的林下腐殖土成分接近。
4.结论
本研究不仅获得了多花兰组培苗成活率高达99%的营养液驯化方案,而且将经该营养液培养60 d后的驯化苗转移至基质中培养60 d,成活率也高达99%。既可采用营养液单独驯化,也可采用营养液结合基质驯化,整个驯化过程可在2-4个月内完成。该驯化方案简易便于推广,有利于多花兰野生资源的保护和回归,对建立多花兰种苗工厂化、多花兰无土农业或发展多花兰都市农业均具有重要意义。
