HPLC-MS/MS法测定人血浆中瑞舒伐他汀的浓度及生物等效性研究Δ
2022-10-12谢朋飞陈元璐崔宏娣张永东侯思雨周长欣王本伟
谢朋飞,陈元璐,崔宏娣,龙 辉,张永东#,侯思雨,周 燕,周长欣,王本伟
(1.郴州市第一人民医院Ⅰ期临床研究室,湖南 郴州 423000;2.山西兰花药业股份有限公司研发部,山西 高平 048402;3.安徽万邦医药科技股份有限公司临床部,合肥 230601;4.山东安捷生物检测技术有限公司生物分析部,济南 250101)
瑞舒伐他汀钙片是临床使用较为广泛的他汀类药物,其调节血脂疗效确切、耐受性良好,且具有改善心功能、抑制炎症反应及稳定或逆转动脉粥样硬化斑块结构等作用,能够降低心血管不良事件的风险性[1-3]。本研究旨在建立人血浆中瑞舒伐他汀浓度的高效液相色谱-串联质谱(HPLC-MS/MS)测定方法,研究瑞舒伐他汀钙片2种制剂在我国健康受试者中的药动学特征及安全性,并评价其生物等效性,为药物注册和合理用药提供依据。
1 材料
1.1 仪器
岛津Nexera X2液相色谱仪(日本Shimadzu公司);AB Triple Quad 5500质谱仪(美国AB公司);XSE 105DU十万分之一电子天平[梅特勒-托利多仪器(上海)有限公司];Analyst 1.6.3数据处理软件。
1.2 药品与试剂
受试药物(T药):瑞舒伐他汀钙片(山西兰花药业股份有限公司,批号为20180803,规格为10 mg/片);参比药物(R药):瑞舒伐他汀钙片(美国IPR Pharmaceuticals,Inc.公司,分包装批准文号为国药准字J20170008,批号为134595,规格为10 mg/片)。瑞舒伐他汀标准品(中国食品药品检定研究院,纯度为98.4%,批号为101028-201803);内标(加拿大TLC Pharmaceutical Standards Ltd.公司,Rosuvastatin-d6,化学纯度为98.9%,批号为1324-016A1)。
1.3 受试者资料来源
本研究总体设计为单中心、随机、开放、两周期、双交叉、单次给药试验,清洗期为7 d。经郴州市第一人民医院药物临床试验伦理委员会审核批准(批件号:第2019009号)。受试者均签署知情同意书。纳入标准:年龄≥18周岁的健康男女受试者,无内分泌、消化系统、免疫系统、呼吸系统及神经系统等疾病史或现有上述系统疾病,无食物、药物等过敏史,无药物滥用及毒品使用史,无烟酒等不良嗜好,试验前28 d内未使用过任何影响肝脏对药物代谢的药物或食物,试验前3个月内无献血或大量失血及未参加过其他临床研究;生命体征、体格检查及相关实验室检查、心电图检查、妊娠检查(仅女性)、药物滥用筛查和酒精呼气检查等结果均正常或异常无临床意义。
将60例健康受试者随机分为空腹组和餐后组,各30例。空腹组受试者中,男性22例,女性8例;平均年龄(27.60±7.17)岁;平均身高(165.02±7.16) cm;平均体重(58.97±6.01) kg;平均体重指数(BMI)(21.68±1.96) kg/m2。餐后组受试者中,男性24例,女性6例;平均年龄(29.20±8.44)岁;平均身高(164.47±6.69) cm;平均体重(60.16±8.18) kg;平均BMI(22.16±1.83) kg/m2。
2 方法与结果
2.1 研究设计与样本采集
空腹组、餐后组受试者均按筛选号顺序以1 ∶ 1的比例随机分配至2个给药序列组(R-T组/T-R组)之一。给药方法:空腹或进食高脂餐后30 min以240 mL温水送服瑞舒伐他汀钙片受试药物或参比药物1片(10 mg),给药前禁食至少 10 h,给药前及给药后1 h内禁水,给药后4 h进食标准午餐、10 h后进食标准晚餐,每周期用餐一致。
空腹组受试者分别于给药前0 h(给药前60 min内)及给药后0.25、0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0、5.5、6.0、7.0、8.0、10.0、12.0、24.0、48.0和72.0 h采集药代血样;餐后组受试者分别于给药前0 h(进食高脂餐前30 min内)及给药后0.5、1.0、2.0、2.5、3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、8.0、10.0、12.0、24.0、48.0和72.0 h采集药代血样。每次取静脉血约4 mL至K2EDTA采血管中(血样采集全程避光操作,采集后置于冰水浴中暂存),于1 h内完成离心(离心条件:离心温度2~8 ℃,离心力2 000 g,离心转速2 792 r/min,离心时间10 min),离心结束后分离出上层血浆,并于 2 h内置于超低温冰箱(-60 ℃及以下)中储存待测。
2.2 血浆样本处理与测定条件
2.2.1 色谱条件:分析柱为Waters X BridgeTMC18柱(5 μm,2.1 mm×50 mm);以0.1%甲酸为流动相A、含0.1%甲酸的甲醇溶液为流动相B,梯度洗脱(洗脱程序为0~0.3 min,45%A;1.5~2.0 min,5%A;2.1~3.0 min,45%A);流速为0.6 mL/min;柱温为40.0 ℃,自动进样器温度为8 ℃;进样量为20 μL。
2.2.2 质谱条件:电喷雾离子化源(ESI源),选择正离子条件检测,多反应监测扫描模式;瑞舒伐他汀用于定量分析离子对为m/z482.4→258.3,瑞舒伐他汀-d6(内标)用于定量分析离子对为m/z488.4→264.2。离子源参数设置如下,喷雾电压为5.5 kV,气帘气为35 psi,雾化气为60 psi,辅助加热气为60 psi,离子源温度550 ℃,入口电压为10 V。
2.2.3 血浆样品处理:精密吸取待测血浆样品200 μL,加入稳定剂[1%乙酸溶液(V/V)]200 μL,涡旋混匀,吸取200 μL酸化后的样本,加入内标工作溶液(20 ng/mL 瑞舒伐他汀-d6)20 μL和乙酸乙酯1 mL,涡旋混匀,16 500 g离心5 min后取800 μL上清液加入96孔板,氮气吹干,用甲醇-水(V∶V=50 ∶ 50)溶液200 μL复溶,1 000 r/min摇匀15 min,3 210 g离心10 min,取上清液进样分析。
2.3 统计学方法
瑞舒伐他汀血药浓度数据采用PhoenixTMWinNonLin®(8.1版本)处理,使用非房室模型拟合法进行药动学参数的估算分析。主要药动学参数达峰浓度(Cmax)、零时间到最终采血点的血药浓度-时间曲线下面积(AUC0-t)和零时间到无限大时间的血药浓度-时间曲线下面积(AUC0-∞)经过自然对数转换后进行方差分析、双单侧t检验和90%置信区间(CI)分析,以判定瑞舒伐他汀受试药物与参比药物在空腹和餐后状态下的生物等效性;药动学参数达峰时间(tmax)经非参数检验(Wilcoxon符号秩和检验),以评价受试药物与参比药物的差异。
2.4 方法学考察与评价
2.4.1 专属性考察:取不同来源空白血浆6份,分别进行空白样品测定和在最低定量下限浓度水平的添加内标实验。空白基质样品中,内源性物质峰面积不超过瑞舒伐他汀最低定量下限峰面积的20%,不超过内标峰面积的5%,结果表明,血浆中内源性物质不干扰待测物及内标的测定,本方法专属性良好,见图1。

A.空白血浆样品;B.最低定量下限血浆样品(瑞舒伐他汀0.1 ng/mL)和内标;C.标准曲线工作液样品(瑞舒伐他汀2.0 ng/mL)和内标;Ⅰ.瑞舒伐他汀(m/z=482.4/258.3);Ⅱ.瑞舒伐他汀-d6(m/z=488.4/264.2)A.blank plasma;B.lower limit of quantification plasma (rosuvastatin:0.1 ng/mL) and internal standard;C.standard curve working solution (rosuvastatin:2.0 ng/mL) and internal standard;Ⅰ.rosuvastatin(m/z=482.4/258.3);Ⅱ.rosuvastatin-d6(m/z=488.4/264.2)图1 人血浆中瑞舒伐他汀和内标瑞舒伐他汀-d6的色谱图Fig 1 Chromatogram of determination of rosuvastatin and rosuvastatin-d6 in human plasma
2.4.2 标准曲线与定量下限:取空白基质配制9个浓度水平标准曲线样品(瑞舒伐他汀血浆浓度水平为0.1、0.2、0.5、1.0、2.0、5.0、10.0、20.0和25.0 ng/mL),按“2.2.3”项下处理标准曲线样品后进样分析,建立瑞舒伐他汀的标准曲线。以待测物瑞舒伐他汀色谱响应值(As)与内标色谱响应值(Ai)的比值Y(即Y=As/Ai)为纵坐标,以系列浓度水平标准曲线样品中瑞舒伐他汀浓度X为横坐标,用加权(1/χ2)最小二乘法进行线性回归运算,其回归方程为Y=2.34X×10-1+1.26×10-3(R2=0.998 7),瑞舒伐他汀线性范围为0.1~25.0 ng/mL,最低定量下限为0.1 ng/mL。
2.4.3 精密度与回收率:取空白基质配制4个质量浓度的质控样品(瑞舒伐他汀浓度分别为 0.1、0.3、3.0和18.0 ng/mL)考察批内及批间精密度与准确度。各质控样品按“2.2.3”项下处理后进样分析,每个质量浓度处理6份,连续测定3 d,根据分析批内的标准曲线,计算质控样品的测得浓度,根据质控样品结果计算本法日内及日间精密度的RSD。以质量浓度为 0.3、3.0和18.0 ng/mL的质控样品,通过比较正常处理(未提取基质)质控样品中待测物或内标响应值与提取后加入待测物、内标的双空白样品的响应值来评价本法回收率。瑞舒伐他汀在人血浆中的精密度和回收率见表1。

表1 瑞舒伐他汀在人血浆中的精密度和回收率(n=6)Tab 1 Precision and recovery of rosuvastatin in human plasma (n=6)
2.4.4 基质效应:使用6个不同来源的空白基质、模拟的溶血血浆及高脂血浆基质制备低(LQC,0.3 ng/mL)、高(HQC,18.0 ng/mL)2个质量浓度的瑞舒伐他汀质控样品,按“2.2.3”项下处理后进样分析;另同时配制含有一定量待测物和内标的纯溶液(最终浓度分别与低、高浓度质控样品的进样浓度一致)进样分析;每个浓度水平平行处理6份样品,测定各样品待测物及内标色谱响应值,分别计算空白基质、模拟的溶血血浆及高脂血浆基质样品中待测物和内标归一化基质因子。结果显示,空白基质中2个质量浓度经内标归一化基质因子均值为100.62%~102.14%,变异系数≤1.65%;溶血基质中,LQC基质效应的CV值为2.3%,HQC基质效应的CV值为1.6%;高脂基质中,LQC基质效应的CV值为4.8%,HQC基质效应的CV值为1.9%;均≤15.0%。上述结果表明,溶血基质、高脂血基质均不影响血浆中瑞舒伐他汀的测定,基质效应符合生物样品分析要求。
2.4.5 稳定性:配制含瑞舒伐他汀的低、高2个质量浓度全血和血浆质控样本,每个浓度水平平行处理6份样品,按“2.2.3”项下处理后进样分析,考察各样品在不同储存环境下的稳定性。结果表明,2个质量浓度全血质控样品于冰水浴条件下放置1 h稳定;血浆质控样本于室温(25 ℃)下放置 47 h、-25 ℃/-80 ℃条件下冰冻保存76 d及-80 ℃至室温冻融循环4次稳定性均良好;制备后样本于室温条件下放置46.5 h、2~8 ℃条件下放置43.5 h、自动进样器(8 ℃)放置45 h稳定性均良好。
2.5 平均血药浓度-时间曲线

A.空腹组(n=30);B.餐后组(n=30)A.fasting group (n=30);B.postprandial group (n=30)图2 血浆中瑞舒伐他汀的平均血药浓度-时间曲线图Fig 2 Mean plasma concentration-time curve of rosuvastatin in plasma
采用Phoenix WinNonLin 8.1软件对瑞舒伐他汀钙片血药浓度数据进行分析,并绘制血药浓度-时间曲线。空腹及餐后给药条件下分别有30例受试者口服参比药物(商品名:CRESTOR®)和受试药物瑞舒伐他汀钙片,其血浆中瑞舒伐他汀的平均血药浓度-时间曲线见图2,2种制剂体内药-时曲线变化趋势基本一致,两者体内过程相似。
2.6 药动学参数
空腹给药条件下,单剂量口服受试药物瑞舒伐他汀钙片10 mg后有30例受试者的血药浓度数据纳入药动学参数集(PKPS),口服参比药物后有29例受试者(其中1例受试者第2周期入住期主动退出试验,未服用R药)纳入PKPS;餐后给药条件下分别有30例受试者单剂量口服受试药物或参比药物,无脱落情况,其血药浓度数据均纳入PKPS。空腹和餐后给药条件下,瑞舒伐他汀钙片受试药物吸收速度、程度与参比药物基本一致,见表2。
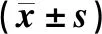
表2 瑞舒伐他汀钙片受试药物和参比药物的主要药动学参数Tab 2 Main pharmacokmetic parameters of rosuvastatin in healthy Chinese subjects
2.7 生物等效性评价
空腹给药条件下单剂量口服受试药物后有30例受试者纳入生物等效性分析集(BES),口服参比药物后共有29例受试者纳入BES;餐后给药条件下分别有30例受试者单剂量口服受试药物和参比药物,均纳入BES。受试者口服受试药物和参比药物后瑞舒伐他汀主要药动学参数Cmax、AUC0~72 h和AUC0-∞经自然对数进行数据转换后其几何均数比值(T/R)的90%CI统计结果均在可接受的80.00%~125.00%等效范围内,且在给药序列、给药周期及制剂间的差异均无统计学意义(P>0.05);受试药物和参比药物瑞舒伐他汀的tmax经非参数检验(Wilcoxon 符号秩检验)后均无显著性差异(P>0.05) ,见表3。

表3 空腹和餐后条件下瑞舒伐他汀钙片受试药物和参比药物的生物等效性结果Tab 3 Bioequivalence results of Rosuvastatin calcium tablets and reference drugs under fasting and postprandial conditions
2.8 安全性评价
本试验空腹组和餐后组分别有30例受试者纳入安全性分析集。空腹组共观察到5例受试者(占16.67%)发生8例次不良事件,其中受试药物组有4例受试者发生5例次、参比药物组有2例受试者发生3例次不良事件;餐后组共有9例受试者(占30.00%)发生10例次不良事件,其中受试药物组有6例受试者发生7例次、参比药物组有3例受试者发生3例次不良事件报告。不良事件主要为三酰甘油、尿酸、尿白细胞、γ-谷氨酰转肽酶和丙氨酸转氨酶水平升高,口腔黏膜炎和上呼吸道感染等,严重程度均为Ⅰ级(NCI CTCAE 5.0)。本研究中未发生严重不良事件,无受试者因不良事件脱落;所有不良事件除因失访转归情况未知外,其余均恢复正常或异常无临床意义。本研究受试药物与参比药物不良事件发生情况总体相似,受试者在本试验给药剂量下安全性和耐受性良好。
3 讨论
国内外文献报道的血浆中瑞舒伐他汀测定方法较多,如蛋白沉淀法、固相萃取技术和液-液萃取法等[4-10]。本研究基于文献报道,考察了操作简单、成本低廉的蛋白沉淀法,结果显示,瑞舒伐他汀在血浆中游离浓度较低,常规蛋白沉淀方法基质效应较大,而固相萃取法操作繁琐、成本相对较高。本研究以1%乙酸为稳定剂,采用乙酸乙酯萃取法处理血浆样本,基质效应、精密度及回收率等均符合验证接受标准;以稳定同位素标记瑞舒伐他汀-d6为内标,其理化性质、色谱保留行为和离子化行为与待测物一致,可避免基质效应、回收率等对检测结果的影响。本方法稳定可靠,专属性、准确度、精密度及回收率等均符合《生物样品定量分析方法验证指导原则》和《化学药物临床药代动力学研究技术指导原则》等相关指导原则中生物样品分析方法的验证标准。
瑞舒伐他汀具有较高的肝摄取率和遗传多态性,其药动学行为在不同人群及种族中差异较大,不同研究的结果也有所差别[4,11]。本研究中,我国健康受试者口服瑞舒伐他汀钙片10 mg后的主要药动学参数Cmax、AUC0~72 h和AUC0-∞与曹莹等[10]的研究结果一致,而较部分文献报道明显偏低,可能与瑞舒伐他汀药动学行为个体内变异较大、采血点/采血时间设计不同以及纳入的受试者例数和人口学资料差异等因素相关,提示临床应用应注意个体化给药[5,8-9]。本研究中,空腹组受试者主要药动学参数Cmax、AUC0~72 h和AUC0-∞均明显高于餐后组(餐后组Cmax相较于空腹组降低>45%),可能原因系餐后食物及胃排空延缓影响药物吸收,提示临床实际应用时应注意饮食对药物有效性和安全性的影响[10,12]。本研究结果显示,空腹及餐后单次给药条件下,受试药物的吸收速度、吸收程度与参比药物(瑞舒伐他汀钙片,商品名:CESTOR®)基本一致,两制剂具有生物等效性。
