高膳食纤维饲粮中脂肪水平对大口黑鲈生长、肝脏和肠道健康的影响
2022-10-12蔡春芳胡鸿林曹霞敏叶元土丁惠明
史 叶 蔡春芳* 亢 佳 胡鸿林 曹霞敏 吴 萍 叶元土 丁惠明
(1. 苏州大学基础医学与生物科学学院,苏州215123;2. 苏州大学江苏省水产动物营养重点实验室,苏州215123;3. 苏州市阳澄湖国家现代农业示范区发展有限公司,苏州215138)
除了粗纤维,植物性饲料中还含有大量其他的不可被单胃动物消化的碳水化合物。世界卫生组织和中国营养学会将这一类物质定义为膳食纤维(dietary fiber,DF)[1],包括非淀粉多糖(纤维素、半纤维素、果胶、树胶、β-葡聚糖等),抗性淀粉,抗性低聚糖等[2]。水产配合饲料中常用的植物性蛋白质源豆粕、棉籽粕、菜籽粕中粗纤维含量分别为3.61%、10.12%[3]、10.95%[4],但其DF含量分别高达36.7%[5]、34.0%、35.4%[6],豆渣中DF含量更是高达62.9%[7],可见这些蛋白质源中DF含量仅次于甚至高于蛋白质含量。医学研究表明,适量的DF具有降胆固醇[8]、降血脂[9]、改善肠道菌群[10]、提高机体免疫力的作用[11]。然而,近年的研究表明,DF高载会引起小鼠[12]和鱼类[13-14]炎性反应和组织损伤。由于鱼粉资源的短缺[15],水产饲料中植物性蛋白质源的用量越来越高[16],使养殖动物DF负载长期处于较高状态。DF高载可能是养殖鱼类疾病多发的重要原因[13-14,17]。
摄食的第一需要是满足能量的需要[18],在高DF饲料中提高脂肪水平,饲料可消化能提高,这会降低养殖鱼类采食量[19],从而降低了DF摄入量,这样或可缓解由DF高载引起的炎症反应和肝纤维化。因为DF的生理效应与其和胆汁酸的结合力、黏性及可发酵性等性质有关[20]。瓜尔胶黏性强,是常被用作研究DF营养生理的材料[21-22]。已有报道表明,瓜尔胶会抑制鱼类生长速度,引起肠道损伤[23-24]。因此,本研究以大口黑鲈(Micropterussalmoides)为研究对象,在高DF瓜尔胶基础饲粮中提高脂肪水平,研究其对炎症反应和组织损伤的影响,旨在为水产饲料配方优化提供依据。
1 材料与方法
1.1 试验材料
瓜尔胶(食品级,含量>99%)、干酪素均购自于浙江某生物科技有限公司,其他饲料原料均由广东某饲料有限公司提供。
1.2 试验饲粮
豆粕中DF含量为36.7%[5],如果饲料中豆粕用量为30%,可带入10.8%的DF,加上其他植物性原料带入的DF,实用饲料中总DF含量可达15%。因此,本试验配制DF含量均为15%,大豆油的添加量分别为3%(LL,实测脂肪水平为12.81%)和8%(HL,实测脂肪水平为17.94%)的2种饲粮。所有原料粉碎后按配方精确称取,充分混合均匀,分批加入质量分数约为20%的蒸馏水,混匀,制成直径为1.8 mm、长度为5 mm左右的颗粒,将颗粒饲料密封保存于-20 ℃冰箱。饲粮组成及营养水平见表1。

表1 饲粮组成及营养水平(风干基础)
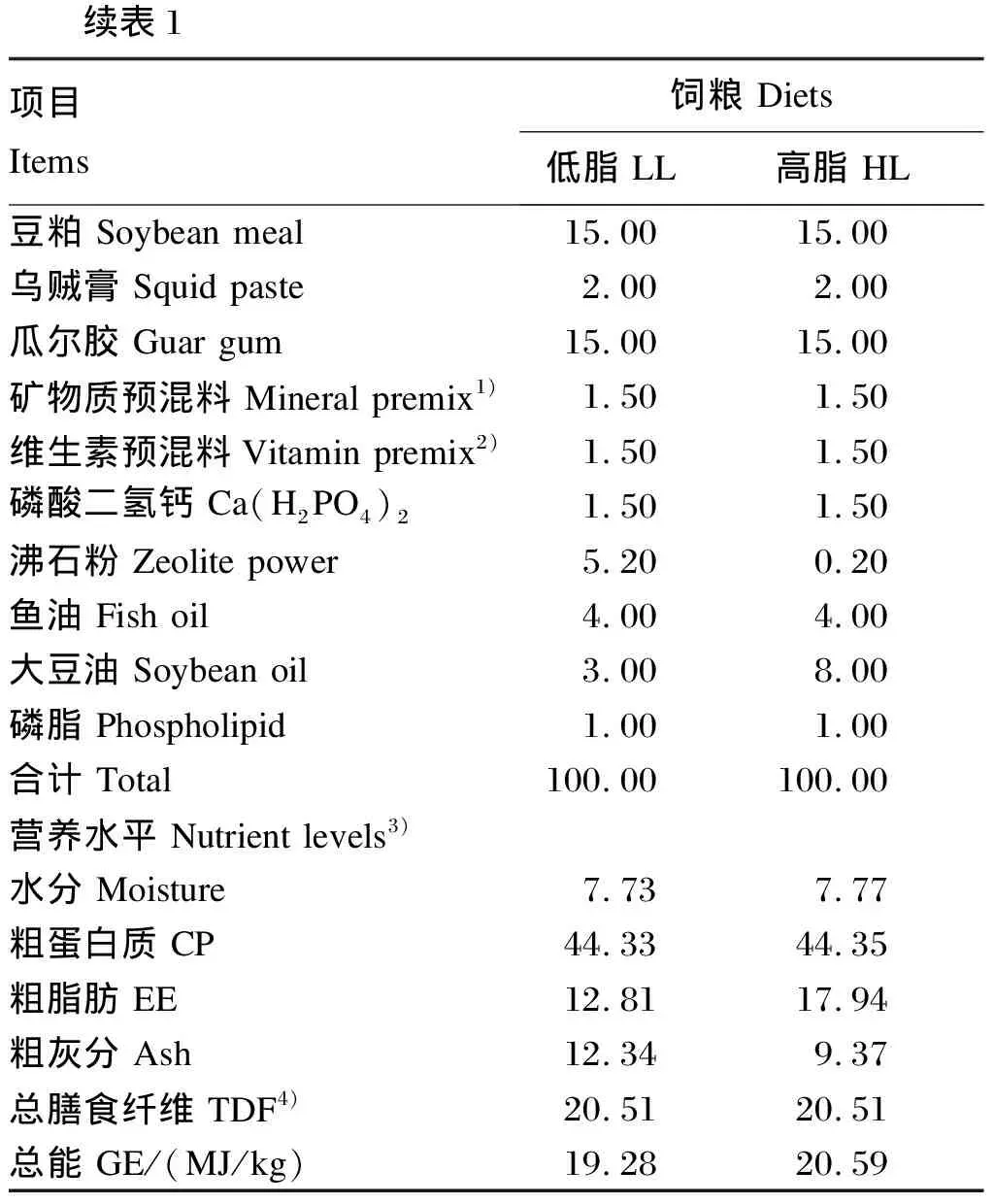
1 Items Diets LL HL Soybean meal15.0015.00 Squid paste2.002.00 Guar gum15.0015.00 Mineral premix1)1.501.50Vitamin premix2)1.501.50 Ca(H2PO4)21.501.50 Zeolite power5.200.20 Fish oil4.004.00 Soybean oil3.008.00 Phospholipid1.001.00 Total100.00100.00 Nutrient levels3) Moisture7.737.77 CP44.3344.35 EE12.8117.94 Ash 12.349.37 TDF4)20.5120.51 GE/(MJ/kg)19.2820.59
1.3 试验设计及饲养管理
大口黑鲈幼鱼购买自金澄福渔业科技有限公司,养殖试验在苏州市阳澄湖国家现代农业发展有限公司研究生工作站进行。试验鱼运回后在室内养殖池暂养,每天表观饱食投喂大口黑鲈商品饲粮(浙江粤海饲料有限公司,粗蛋白质含量≥40%,粗脂肪含量≥3%,粗纤维含量≤8%)2次(09:00,16:00),驯养2个月后,于禁食状态下选取120尾规格一致且体质健壮的幼鱼,称重后随机分入6个容积为400 L的聚乙烯桶,桶中盛水300 L,每桶放鱼20尾。用LL饲粮继续驯化2周以适应试验条件。养殖试验开始前,再称重(此时平均体重为10.6 g/尾)并调整各缸鱼重至变异系数<3%。将调整后的120尾鱼分为2组,分别饲喂LL饲料和HL饲料,每组3个重复,每个重复20尾。每天表观饱食投喂2次(09:00,16:00)。饲养期间每天08:00采用虹吸法排污并换水约1/3,水温在26~30 ℃,pH为7.7±0.1,溶解氧浓度确保高于6.5 mg/L,氨氮浓度维持在0.01 mg/L以下。饲喂56 d后进行采样。
1.4 样品采集与处理
样品采集前禁食24 h。采样时将一桶鱼迅速捞起,MS-222麻醉,称总重,再将每条鱼分别称尾重、测体长。从每组中选取9尾鱼(每桶随机取3尾)液氮速冻,保存于-20 ℃中,用于全鱼常规营养成分分析。每桶取3尾鱼于无菌条件下分离肝脏和后肠,样本放入1.5 mL灭酶灭菌离心管中,液氮速冻后放置于-80 ℃中保存,用于基因表达分析。其余的鱼尾静脉采血,将抽取的血液放置在1.5 mL离心管中,4 ℃静置4 h后,3 000×g离心10 min,将离心后所得上清液转入1.5 mL离心管中,保存在-80 ℃超低温冰箱中,用于血清生化指标的测定;将鱼解剖,取出内脏团并称重,分离出肝脏、胆囊、肠道,称肝脏重量,用于计算脏体比(VSI)、肝体比(HSI);将2尾鱼的肝脏和后肠组织置于4%甲醛溶液中固定,4 ℃保存,用于肝脏病理学切片制备;其余的肝脏放在5 mL离心管中,液氮速冻,用于组织成分分析。
1.5 分析与计算方法
增重率(weight gain rate,WGR,%)=
100×(Wf-Wi)/Wi; 特定生长率(specific growth rate, SGR, %/d)=
100×(lnWf-lnWi)/t; 摄食率(feeding rate,FR,%)=100×F/
[t×(Wf+Wi)/2]; 饲料系数(feed conversion ratio, FCR)=
F/(Wf-Wi); HIS(%)=100×Wh/Wb; VSI(%)=100×Wv/Wb; 肥满度(condition factor, CF, g/cm3)=100×
Wb/L3。
式中:Wi为平均每尾鱼初重(g);Wf为平均每尾鱼末重(g);F为饲料摄入量干重(g);t为养殖试验期(d);Wh为样品鱼肝脏重(g);Wv为样品鱼内脏重(g);Wb为样品鱼体重(g);L为样品鱼体长(cm)。
1.5.2 饲料和鱼体成分
水分含量采用105 ℃烘箱干燥法(GB/T 6435—2014)测定(GZX-9030MBE,上海博讯实业有限公司医疗设备厂);粗蛋白质含量(GB/T 6432—2018)使用全自动凯氏定氮仪测定(SKD-1000,上海沛欧分析仪器有限公司);粗脂肪含量采用索氏抽提法(GB/T 6433—2006)测定;粗灰分含量采用马福炉灼烧法(GB/T 6438—2007)测定(80-10TP,上海慧泰仪器制造有限公司);肝脏脂肪含量采用氯仿甲醇法[25]测定;肝脏总蛋白含量采用试剂盒测定(南京建成生物工程研究所);肝脏胶原蛋白含量采用试剂盒双抗体夹心法测定(绿叶生物科技有限公司);饲料总能采用氧氮式热量计(SDACM5000,长沙三德科技有限公司)测定。
1.5.3 血清生化指标
使用全自动血液生化分析仪(雅培C8000)测定血清总胆汁酸(TBA)、总蛋白(TP)、白蛋白(ALB)、球蛋白(GLB)、胆固醇(CHO)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)含量及谷丙转氨酶(ALT)、谷草转氨酶(AST)、碱性磷酸酶(ALP)活性。所用试剂盒均购自上海执诚生物科技有限公司。
1.5.4 肝脏和后肠相关基因mRNA相对表达量
利用Trizol提取肝脏和后肠中RNA,提取后的RNA利用2%变性琼脂糖凝胶电泳检测其完整性,用核酸仪测定RNA的浓度。按照5XAll-In-One RT Master Mix (with AccuRT Genomic DNA Removal Kit)(abm)试剂盒方法,合成cDNA后放置于-20 ℃冰箱中保存。实时荧光定量 PCR操作根据EvaGreen 2X qPCR Master Mix (abm)试剂盒说明书进行。每个反应体系共20 μL:6 μL分子级灭菌蒸馏水,2 μL稀释混合后引物,2 μL稀释后的cDNA模板以及10 μL的Eva Green 2X qPCR Master Mix。所用程序为:预变性95 ℃ 30 s,95 ℃变性5 s,60 ℃运行30 s进行退火和延伸,共进行40个循环。试验结果用2-ΔΔCt的方法分析定量相关基因mRNA相对表达量。实时荧光定量PCR引物序列见表2。
目前,光山县的红色文化资源主要以纪念馆、博物馆烈士陵园旧址纪念地、名人故居、名人墓等形式展示,有较强吸引力的参与性和体验性项目很少。利用SCS理念,结合数字化展示技术,利用声、光、电的形式,通过影视内容,来营造震撼的视听效果,采用VR技术,实现眼睛的穿越,让游客深处会议中,战争中,切身感受革命战争故事。光山县王大湾会议会址纪念馆和邓颖超祖居,采用播放相关影视剧和采访实录等形式,将刘邓大军千里跃进大别山的艰难和邓颖超大姐的光辉形象展示给游人,使游人在实地参观的过程中,更加真切地体会和感受其红色文化内涵和魅力。

表2 实时荧光定量PCR引物序列
1.5.5 肝脏和后肠组织切片
将肝脏和后肠组织按常规程序制作石蜡切片,对肝脏切片进行马松(Masson)染色,对后肠组织切片进行苏木精-伊红(HE)染色,采用光学显微镜(Olympus BX51)进行观察并采用其成像系统拍摄。
1.6 数据统计与分析
试验数据采用SPSS 22.0软件进行统计分析,所有试验结果均以平均值±标准差(mean±SD)表示,各组间的差异采用独立样本t检验对比分析。P<0.05为差异显著。作图软件为Graphpad Prism 7.0。
2 结 果
2.1 高DF饲粮中脂肪水平对大口黑鲈幼鱼生长性能的影响
由表3可知,与LL组相比,HL组大口黑鲈的WGR、SGR和CF显著增加(P<0.05),但FR、FCR、VSI和HSI在2组间差异不显著(P>0.05)。
2.2 高DF饲粮中脂肪水平对大口黑鲈幼鱼体成分和肝脏脂肪含量的影响
由表4可知,2组间鱼体粗蛋白质、粗脂肪和粗灰分含量无显著差异(P>0.05)。HL组和LL组间肝脏脂肪含量也无显著差异(P>0.05)。

表3 高DF饲粮中脂肪水平对大口黑鲈幼鱼生长性能的影响
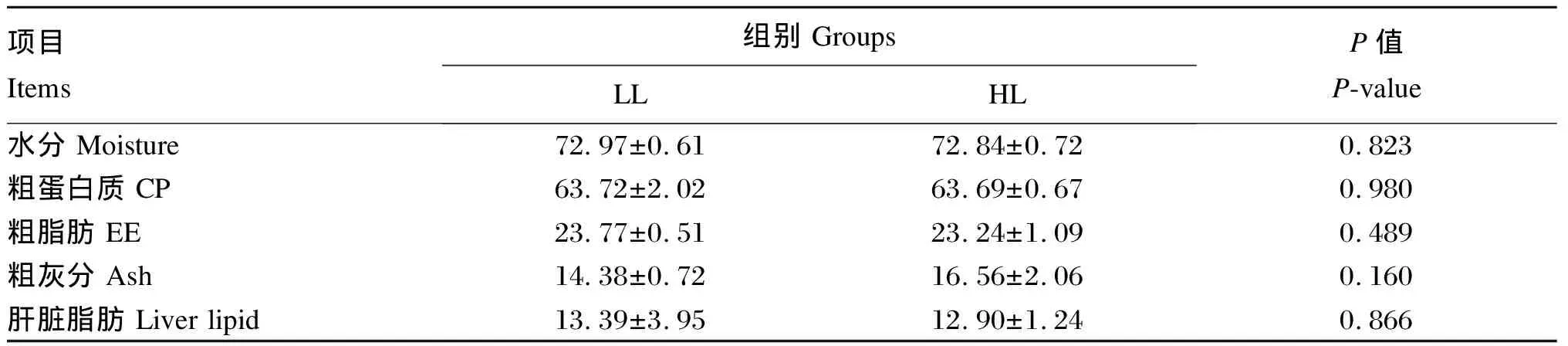
表4 高DF饲粮中脂肪水平对大口黑鲈幼鱼体成分和肝脏脂肪含量的影响(干物质基础)
2.3 高DF饲粮中脂肪水平对大口黑鲈幼鱼血清生化指标的影响
由表5可知,HL组血清ALT活性显著低于LL组(P<0.05),而血清AST、ALP活性及TP、ALB、GLOB、CHO、TG、LDL和HDL含量2组间无显著差异(P>0.05)。
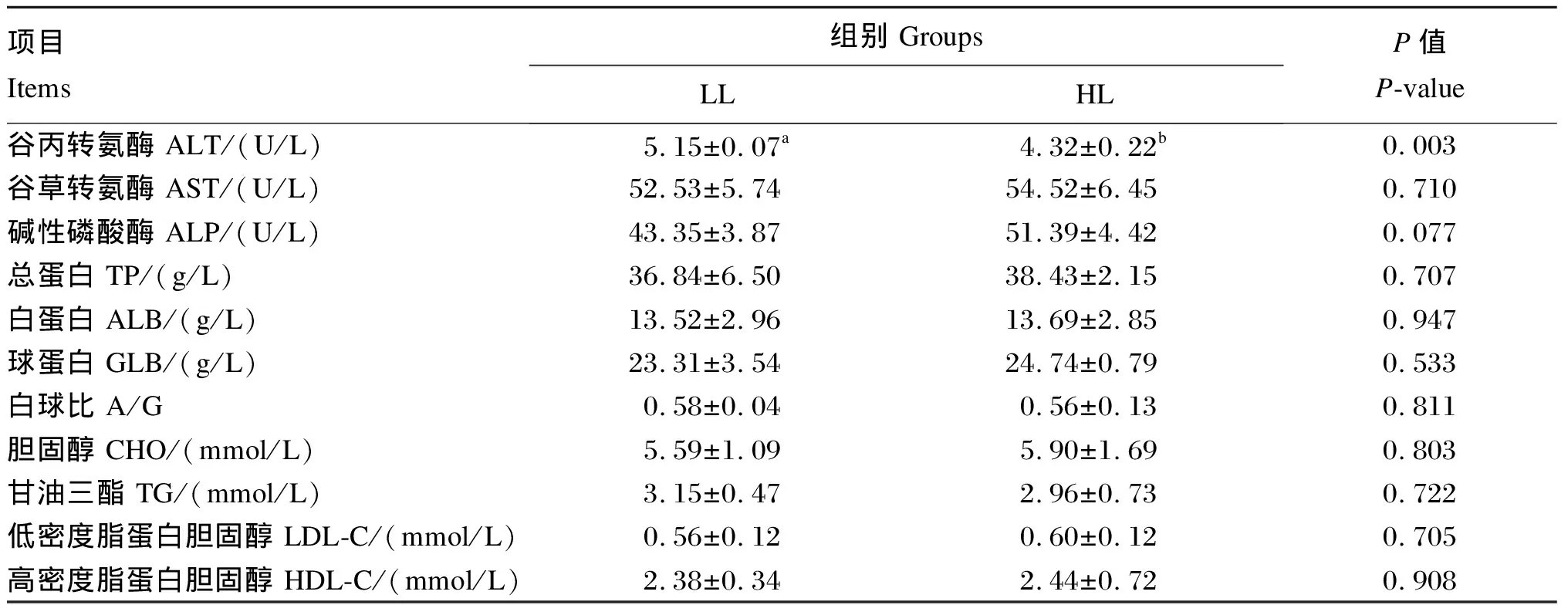
表5 高DF饲粮中脂肪水平对大口黑鲈幼鱼血清生化指标的影响
2.4 高DF饲粮中脂肪水平对大口黑鲈幼鱼肝脏和后肠炎性基因表达的影响
由图1可知,HL组肝脏核因子-κβ(NF-κβ)和后肠NF-κβ、肿瘤坏死因子α (TNFα)、白细胞介素-10(IL-10)、转化生长因子β(TGFβ) mRNA相对表达量显著低于LL组(P<0.05),而肝脏TGFβmRNA相对表达量显著高于LL组(P<0.05)
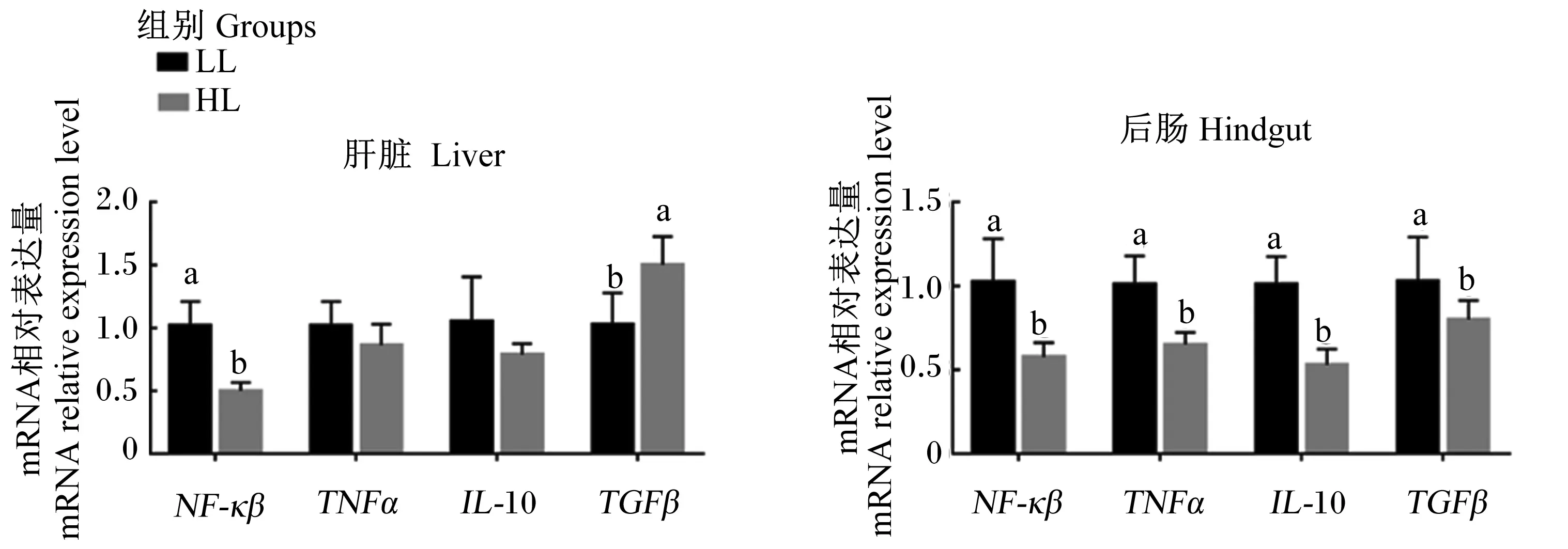
NF-κβ:核因子-κβ nuclear factor kappa-β;TNFα:肿瘤坏死因子α tumor necrosis factor α;IL-10:白细胞介素-10 interleukin-10; TGFβ:转化生长因子β transforming growth factor β。
2.5 高DF饲粮中脂肪水平对大口黑鲈幼鱼肝脏脂质代谢和胆汁酸受体基因表达的影响
由图2可知,HL组肝脏过氧化物酶增殖体激活受体α(PPARα)、肉毒碱棕榈酰转移酶1(CPT1)和脂蛋白A1(APOA1) mRNA相对表达量显著高于LL组(P<0.05),肝脏脂肪酸合成酶(FAS)和脂蛋白B(APOB) mRNA相对表达量在HF组和LL组间差异不显著(P>0.05)。肝脏法尼醇X受体(FXR)和G蛋白偶联胆汁酸受体5(TGR5) mRNA相对表达量与LL组无显著差异(P>0.05),但存在下降趋势。

PPARα: 过氧化物酶增殖体激活受体α peroxisome proliferators-activated receptor α; FAS:脂肪酸合成酶 fatty acid synthase;CPT1:肉毒碱棕榈酰转移酶1 carnitine palmitoyltransferase 1;APOA1: 脂蛋白A1 apolipoprotein A1; APOB: 脂蛋白B apolipoprotein B; FXR: 法尼醇X受体 farnesoid X receptor; TGR5: G蛋白偶联胆汁酸受体 G protein-coupled bile acid receptor。
2.6 高DF饲粮中脂肪水平对大口黑鲈幼鱼肝肠组织学的影响
由图3可知,后肠组织切片显示2组鱼的肠道绒毛均较完整,未见明显组织损伤。马松染色的肝脏组织切片中可观察到HL组肝细胞间蓝色信号明显比LL组弱。由图4可知,HL组肝脏胶原纤维含量显著低于LL组(P<0.05)。
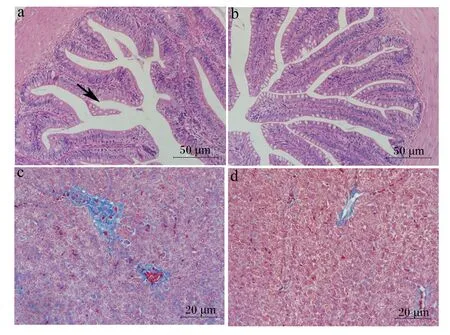
a和b为LL组和HL组后肠HE染色切片(200×);c和d为LL组和HL组肝脏MASSON染色切片(400×)。

图4 高DF饲粮中脂肪水平对大口黑鲈
3 讨 论
本研究结果表明,饲养8周后,大口黑鲈的尾增重15~17 g。彭祥和[32]的研究表明,以不同脂肪水平饲喂规格11.9 g的大口黑鲈,养殖56 d后鱼体增重在18~25 g。这表明无论饲料脂肪水平高低,DF高载均对鱼体生长具有抑制作用。已有研究表明,当饲粮中脂肪水平在12%~18%时,河鲈(Percafluviatilis)的生长性能随着饲粮中脂质含量的提高而改善[33],饲粮脂肪水平在35%以下时,高首鲟(Acipensertransmontanus)的生长表现与饲粮脂肪水平呈正相关关系[34]。本研究表明,HL组大口黑鲈的SGR显著高于LL组,与上述报道结果相一致,表明鱼类对脂肪具有较好的利用能力。Chen等[35]报道大口黑鲈适宜的饲粮脂肪水平为11.5%~14%。Huang等[36]推荐大口黑鲈的脂肪水平为12%。本研究LL组和HL组饲粮的脂肪水平分别为12.81%和17.94%,而HL组SGR显著高于LL组,提示大口黑鲈幼鱼饲粮适宜的脂肪水平可能高于现有文献报道,也可能饲粮中适宜的脂肪水平还受DF含量的影响。

DF具有结合胆汁酸[26]、降低胆汁酸的生物学效价[42-43]和阻碍胆汁酸重吸收率的作用[44],从而使胆汁酸受体FXR/TGR5的活性受到影响,而FXR/TGR5参与炎症反应的调节[45]。Ni等[26]报告高DF饲粮导致大口黑鲈肝脏FXR表达下降,致炎因子基因表达上调。本研究中未检测到2组鱼间FXR和TGR5 mRNA相对表达量的显著变化,但HL组肝脏组织中致炎因子基因NF-κβmRNA相对表达量高于HL组,对炎症反应有一定的抑制作用[46]的TGFβ的mRNA相对表达量低于HL组。由于2组鱼的FR差异不显著,甚至HL组FR略高于LL组,因此,HL组较弱的炎性反应不是DF摄入量减少的缘故,可能是高水平脂肪缓解了炎性反应。当饲粮中DF含量相同时,较高的脂肪水平可能会降低DF的粘性[47],从而削弱DF对胆汁酸的结合作用,这可能是HL组炎性反应较弱的原因所在。炎性反应会引起肝脏组织损伤和纤维化[48]。本研究中肝脏组织切片MASSON染色后显示,HL组肝脏纤维化较LL轻,反映肝脏氧化损伤的血清ALT活性也是HL组显著低于LL组,表明HL组肝脏组织损伤较轻,与炎性反应相关基因表达结果相一致。
PPARα是脂质代谢的关键调控因子,诱导脂肪酸氧化的关键调节酶CPT1的表达[49],进而改善线粒体和过氧化物酶体的脂肪酸氧化[50]。载脂蛋白APOA1是HDL-C的主要成分。HDL-C能将胆固醇从外周细胞运送到肝脏代谢,从而降低脂质积累[51]。本研究中HL组PPARα、CPT1和APOA1的mRNA相对表达量显著高于LL组,这与Huang等[52]、Guilmeau等[53]的研究结果相一致,表明饲粮脂肪水平较高时,脂肪酸的转运及氧化分解加快。本研究中HL组不仅HSI与LL组无显著差异,肝脏脂肪含量也并没有升高,甚至还略低于LL组,可能是因为摄入的高水平的脂肪被充分氧化供能了。
肠道是鱼类吸收和利用营养物质的重要场所,肠道结构的完整性影响鱼类的生长发育[54]。研究表明,富含DF的豆粕型饲粮会引起非感染性肠炎[55],主要表现为肠道绒毛褶皱高度下降、固有层和黏膜下层的宽度增加、白细胞浸润[56]。高DF饲粮也会引起肠道组织损伤[13,24],然而本研究中2组鱼均未出现明显的组织病理改变(图3),这可能与养殖后期试验鱼摄食率下降有关。有研究表明,肠组织自我修复能力较强[57-58],停饲后较短时间内即可恢复正常[59]。尽管如此,HL组后肠组织中炎性反应相关基因NF-κβ、TNFα、IL-10和TGFβmRNA相对表达量均显著低于LL组,提示HL组罹患肠炎的风险较低。
4 结 论
在DF含量较高的饲粮中,提高脂肪水平并未引起肝脏脂肪含量增加,却可改善大口黑鲈幼鱼生长性能,缓解氧化应激和炎性反应,降低肝脏和肠道组织损伤的风险。
