miRNA-130b-3p促进血管钙化的机制研究
2022-10-11苏佳敏陈元利
苏佳敏, 赵 虔, 陈元利
(合肥工业大学 食品与生物工程学院,安徽 合肥 230601)
0 引 言
血管钙化是由于钙盐在血管层的沉积引起的[1],根据发病原因的不同,可以将其分为中膜钙化和内膜钙化。中膜钙化主要由慢性肾病及糖尿病引起,同时随着年龄的增加,患病的几率也会增加,其主要的病理表现是血管僵直,顺应性降低,导致高血压[2]。而内膜钙化更多的是由动脉粥样硬化引起的,其往往存在于晚期动脉粥样硬化斑块处,斑块处钙化结节将进一步增加斑块破裂的可能性[3],斑块的破裂会使斑块中的内溶物被释放到血管中,导致血栓和中风,增加患者的发病率和死亡率[4]。
文献[5]认为钙化是一个不可避免的、被动的退化过程,近20年的研究表明血管钙化是一个类似骨形成的主动过程,参与骨形成的一些关键转录因子也在钙化中发挥作用,如Runt相关转录因子2(RUNX2)、SRY-转录因子9 (SOX9)、Osterix (OSX)等[6]。参与血管钙化的主要细胞类型为主动脉平滑肌细胞(vascular smooth muscle cells,VSMCs)[7],平滑肌细胞向成骨细胞转换被认为是血管钙化的起始阶段,其分泌的碱性磷酸酶被装载至胞外囊泡后促进游离磷酸盐的释放为组织细胞矿化提供基础[8]。随着对血管钙化的逐步研究,一些危险因子也逐渐被发现,包括高钙-磷酸盐产物、氧化压力、骨形态发生蛋白及维生素D等,都可促进VSMCs的成骨分化和血管钙化[9]。
miRNA是一类长度约22 bp的单链非编码RNA,目前已鉴定出超2 500个成熟体miRNA[10],它们活跃于各个生命活动过程,广泛表达于各个组织,通过靶向目的基因3`UTR区域,从而降解mRNA或阻止其转录[11]。miRNA对生物的生长发育至关重要,有研究表明当在小鼠体内敲除成熟miRNA的前体剪切酶Dicer[12]和Drosha[13]后,会引发胚胎致死性。
本课题组前期工作结果表明miRNA在血管钙化中也发挥着一定的作用,miRNA-203b-3p通过靶向重组人骨形态发生蛋白2(bone morphogenetic protein-2,BMP2)抑制下游的SMAD信号通路和RUNX2的表达,从而抑制钙化[14];文献[15]确定miRNA-126-3p在钙化中的作用是通过DKK1/LRP6信号通路来实现的;文献[16]研究发现miRNA在钙化中发挥关键作用。目前,关于miRNA-130b-3p的报道主要集中于脂代谢和癌症[17-19],对于miRNA-130b-3p在心血管疾病中的研究很少,本文主要研究miRNA-130b-3p在血管钙化中发挥的作用。
1 实验方法及材料
1.1 试剂及材料
DMEM培养基(Corning Subsidiary,货号27017008);DMEM/F12培养基(Biological Industries,货号01-172-1ACS);5 nmol的micrON hsa-miR-130b-3p mimic(广州锐博生物科技有限公司,货号miR10000691-1-5);5 nmol的micrOFF hsa-miR-130b-3p antagomir,in vivo(广州锐博生物科技有限公司,货号miR30000691-4-5);Lipo2000转染试剂(Invitrogen,货号1881536);茜素红(中国医药集团,货号20170209);细胞凋亡检测试剂盒(三箭生物,货号A02001-09A-H);逆转录试剂盒(南京维诺赞生物科技有限公司,货号R123-01);AceQ qPCR SYBR Green Master Mix(诺唯赞,货号Q111-02);人主动脉平滑肌细胞(human aortic smooth muscle cells,HASMCs)购于ACTT;野生型雄鼠购于江苏集萃药康生物科技有限公司,生产许可证号SCXX(苏)2019-0008。
1.2 小鼠模型
8周大野生型雄鼠被分为2组(n=6),实验组小鼠每天注射5.5×105IU/kg 维生素D3(VD3),对照组注射橄榄油,连续注射3 d,并于注射完成2周后,安乐处死小鼠,收集小鼠全主动脉和肾脏,用于分析钙化进程。
主动脉环的制备。安乐处死野生型雄鼠,取其全主动脉,在显微镜下去除其他组织,使用显微剪将主动脉剪为5 mm大小片段,置于DMEM/F12培养基中稳定过夜,随后进行转染及钙化处理。
1.3 细胞培养
HASMCs培养于含有10%胎牛血清(FBS)和1%双抗(抗链霉素和青霉素)的DMEM/F12培养基中。钙化培养基的配制是将Na2HPO4和NaH2PO4按照1∶1的比例溶于含有2% FBS、1% 双抗的DMEM培养基中,最终PO43-的浓度为3.0 mmol/L,待孔板中细胞密度为80%时添加钙化培养基,并且每2天更换1次新培养基。
1.4 茜素红染色及银染
取1.0 g茜素红溶于100 mL PBS并调节pH值至4.0,细胞茜素红染色前需先使用4%多聚甲醛固定细胞,然后向培养皿中添加茜素红染液30 min,抽走染液,使用酸性PBS清洗以洗去浮色,置于显微镜下拍照,拍照完成后,向孔中加入10%乙酸溶液,吸上清于405 nm处测吸光度值,用于相对定量分析钙盐沉积变化情况。
小鼠动脉环的茜素红染色。将动脉环冰冻切片从-20 ℃冰箱中取出,室温放置30 min,随后浸泡于PBS 20 min,染色,显微镜下拍照。全主动脉茜素红染色需将0.003%的茜素红溶于1%的KOH溶液制备染液,将全主动脉置于染液中过夜,随后使用2% KOH溶液冲洗2次,显微镜下拍照。
动脉环和全主动脉的银染是将切片主动脉浸泡于2%硝酸银溶液,置于紫外光下45 min,ddH2O水洗5 min,5%硫代硫酸钠溶液清洗2 min,显微镜下拍照。
1.5 免疫荧光
细胞爬片完成后,使用0.5% Triton X-100处理45 min破膜,2% BSA室温封闭2 h,封闭完成后洗去BSA,使用对应抗体4 ℃孕育过夜,次日吸走抗体并使用PBS清洗3次,每次10 min,然后使用1∶1 000配置的FITC或Rhodamine偶联的荧光二抗,于室温孵育1 h。使用PBS清洗3次,每次10 min,之后使用1% DAPI染核10 min,使用防荧光淬灭剂封片并避光风干,待风干之后使用荧光显微镜拍照分析。
1.6 RNA提取及实时荧光定量PCR
主动脉RNA的提取,向装有主动脉的试管中加入400 μL RNA总提取试剂,组织研磨机研磨5 min,加入80 μL三氯甲烷,12 000 r/min离心10 min,吸取上清液,加入等体积异丙醇于-30 ℃过夜沉降。
次日于12 000 r/min离心10 min,吸除液体,加入400 μL 75% 乙醇溶液洗涤,12 000 r/min离心10 min,吸除液体,再加入400 μL 95%乙醇溶液洗涤,12 000 r/min离心10 min,尽量将液体全部吸除,置于超净台风干20 min,加入50 μL ddH2O,测浓度,取1 μg RNA进行反转录得到cDNA,然后通过SYBR(荧光染料)检测mRNA的相对表达量。
SYBR在游离状态下不散发荧光,但当结合至DNA双链沟中时可发出绿色荧光,通过检测荧光强度可确定mRNA表达量的变化。引物见表1所列。

表1 引物序列
1.7 Western Blot检测
细胞处理完成后加入150 μL裂解液,反复吹打,移入1.5 mL EP管,置于冰上,每隔5 min振荡,重复2次后,于4 ℃ 12 000 r/min离心10 min,吸取上清液,随后通过BCA测蛋白浓度,定量检测60 μg蛋白中目的蛋白的表达,先于100 ℃热变性5 min,随后上样,跑胶、转膜,脱脂牛奶室温封闭1 h,上一抗过夜孵育,PBS清洗3次,每次8 min,二抗室温孵育1 h,PBS清洗3次,每次8 min,最后使用ECL显色液在曝光机中曝光。
1.8 流式细胞荧光分选技术(FACS)
六孔板细胞完成处理后,收集培养基和孔板中的细胞(使用不含EDTA的胰酶消化),随后的染色操作按照试剂盒说明书进行,染色完成后,上机操作。
1.9 数据分析
所有实验至少重复3次,所有数据均为(平均值 ± 标准差)。流式细胞荧光分选技术(fluorescence activated cell sorting,FACS)数据从CytExpret(Beckman Coulter, Inc. 版本 2.1.0.92)导出,GraphPad Prism软件(版本7.0)用来进行t分析,若P<0.05则认为具有显著性,*P<0.05,**P<0.01,***P<0.001,****P<0.000 1。
2 结果与分析
2.1 中膜钙化主动脉miRNA-130b-3p的表达
本研究通过皮下注射VD3来造成小鼠急性中膜钙化,结果如图1所示,从图1可以看出,茜素红染色和银染造模成功,通过实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)检测miRNA-130b-3p的变化如图2所示。

图1 中膜钙化小鼠主动脉银染和茜素红染色
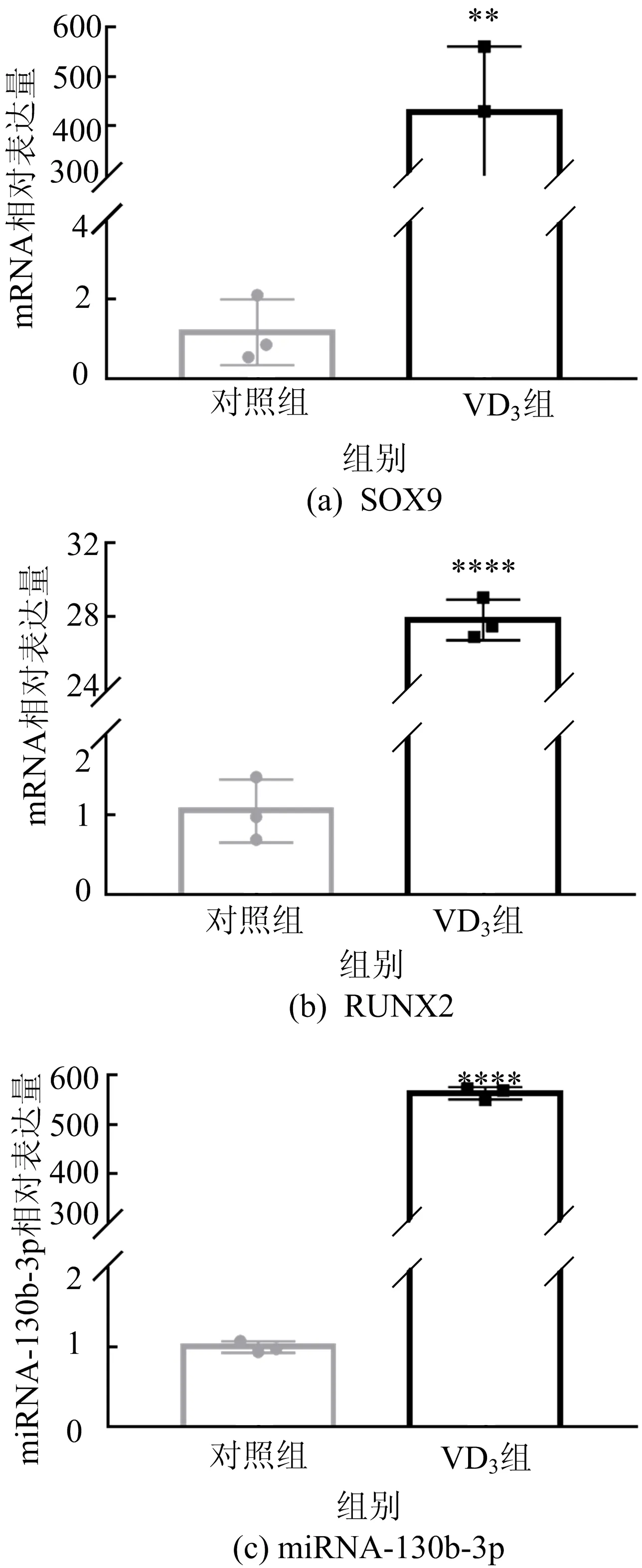
图2 SOX9、RUNX2和miRNA-130b-3p的基因相对表达量
由图2可知,与对照组相比,VD3组主动脉中miRNA-130b-3p的表达显著上升,而且成骨转录因子RUNX2和软骨转录因子SOX9的表达也显著上升。这些实验结果说明,血管钙化时miRNA-130b-3p的表达显著上升,预示着其将参与血管钙化进程。
2.2 钙化程度与miRNA-130b-3p表达的正相关性
为了进一步探索miRNA-130b-3p在血管钙化中发挥的作用,本研究通过体外培养HASMCs并通过高磷酸盐来诱导钙化,如图3所示,高磷酸盐能显著诱导RUNX2的表达和钙盐沉积并能上调miRNA-130b-3p的表达。对HASMCs进行不同钙化时间的处理,如图4所示。随着钙化时间的增加,钙盐沉积也增加,miRNA-130b-3p的表达也上升,通过对两者进行相关性分析发现,钙盐沉积与miRNA-130b-3p的表达呈正相关,如图5所示。

图3 茜素红染色、RUNX2表达及miRNA-130b-3p相对表达量
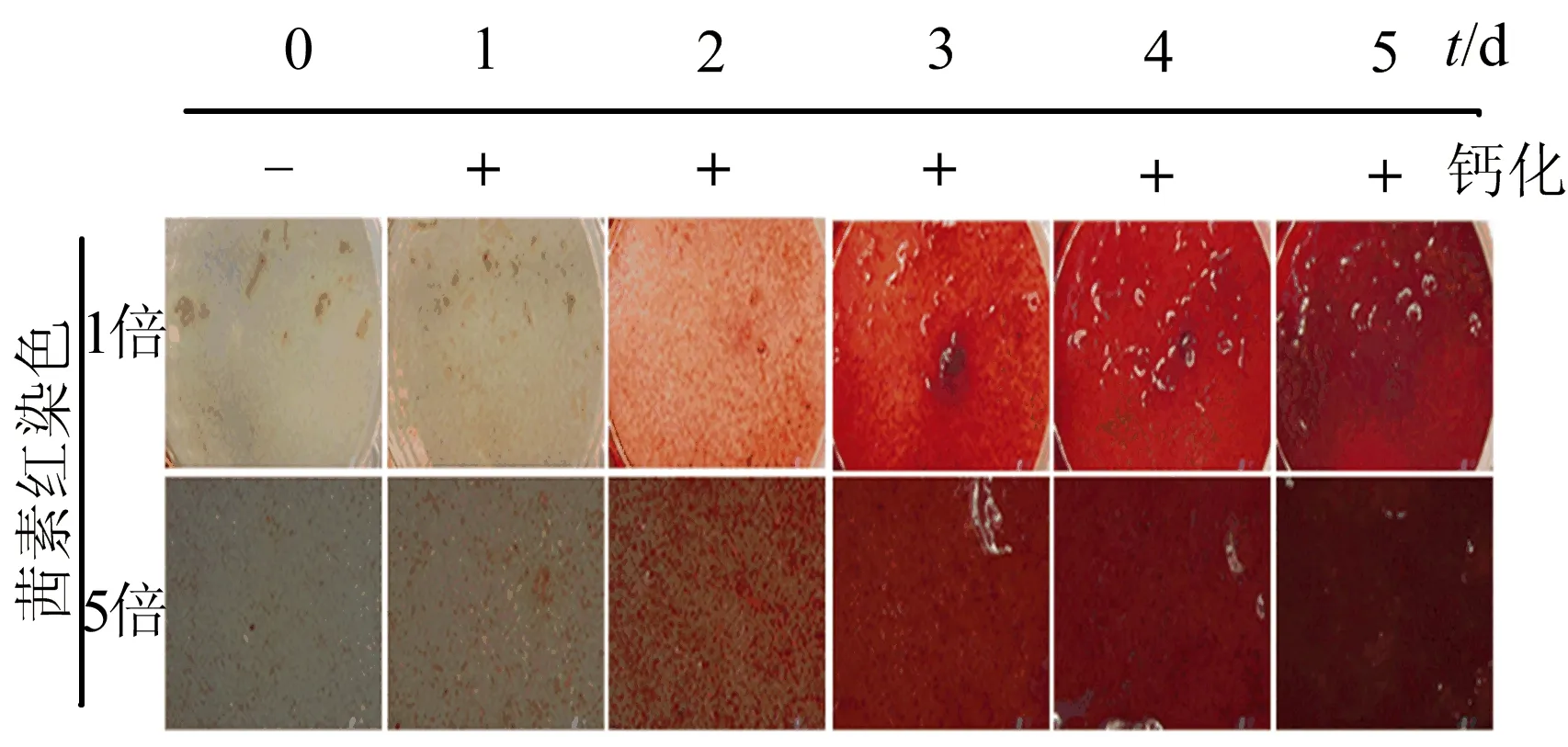
图4 时间梯度诱导HASMCs钙化情况
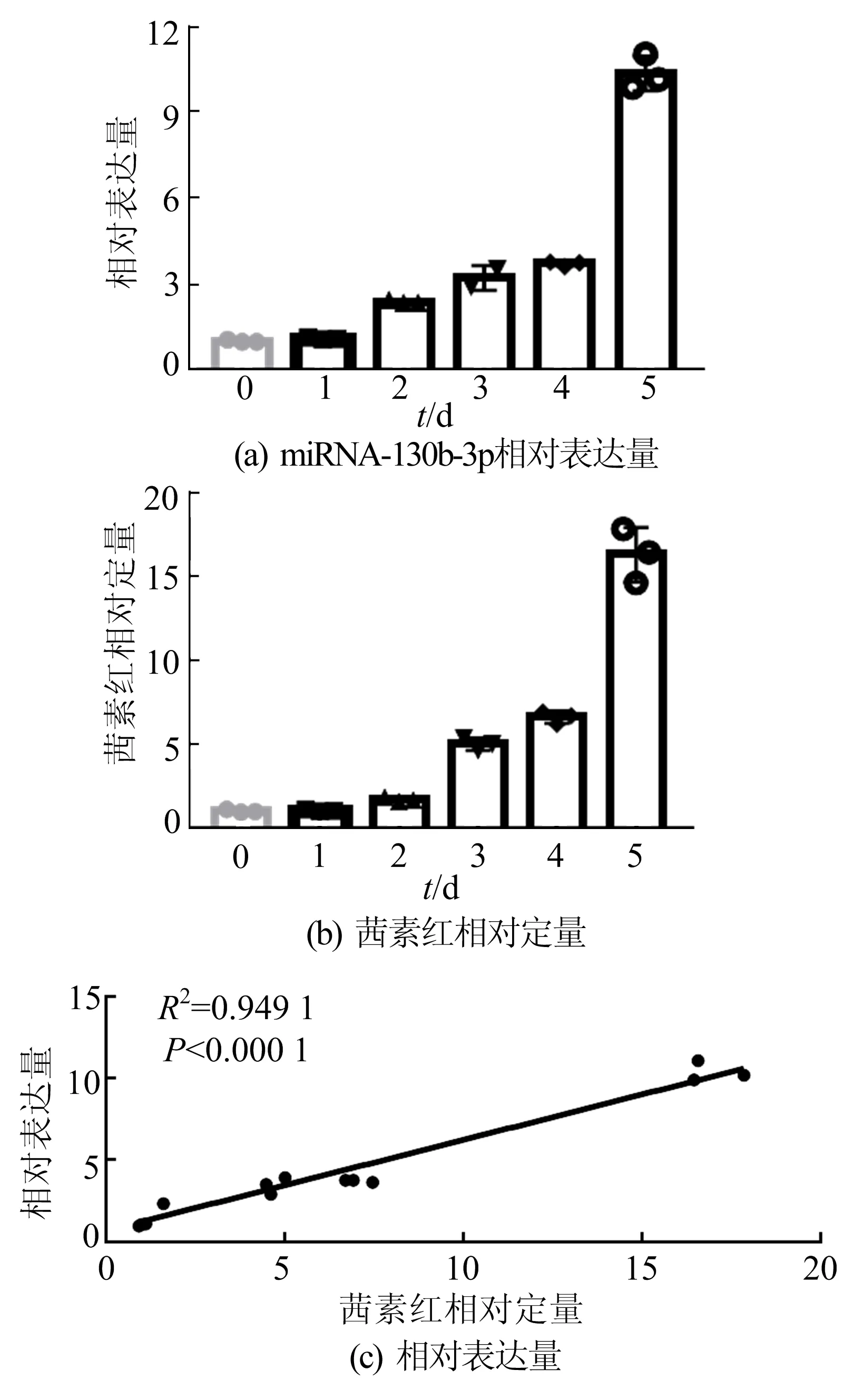
图5 miRNA-130b-3p与钙化相关性分析
2.3 miRNA-130b-3p对平滑肌钙化的影响
HASMCs转染mimic和antagomir后钙化诱导miRNA-130b-3p的相对表达变化如图6所示。图6中:a代表不转染、不钙化;b代表不转染、钙化;c代表转染mimic、不钙化;d代表转染mimic、钙化;e代表转染antagomir、不钙化;f代表转染antagomir、钙化。下同。
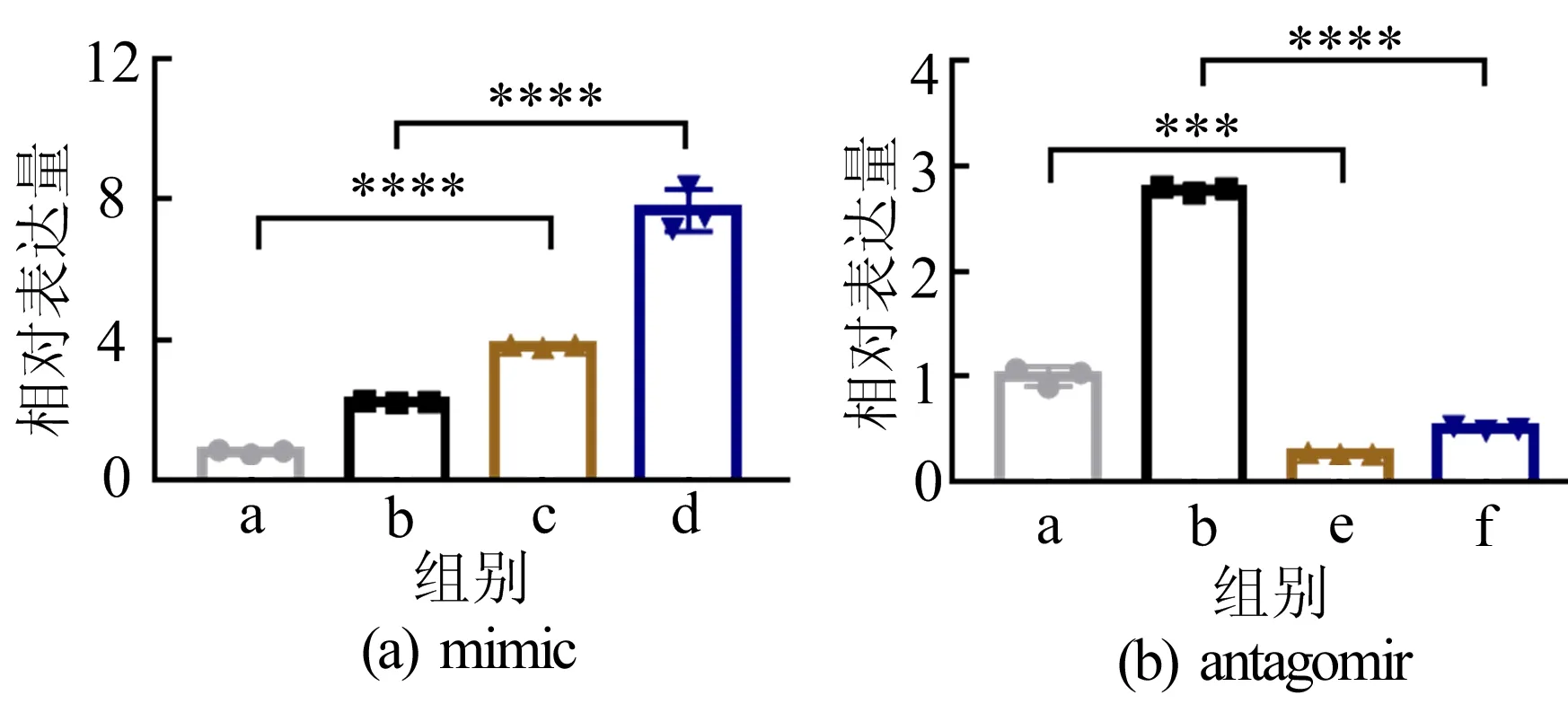
图6 HASMCs转染mimic和antagomir后 miRNA-130b-3p的相对表达
从图6可以看出,转染mimic在钙化时将进一步提高miRNA-130b-3p的水平,而转染antagomir则可以抑制miRNA-130b-3p的水平,为了确定这一上升和降低的miRNA是否会影响钙化进程,本文通过茜素红染色分析转染时HASMCs的对应钙化情况,如图7所示。从图7可以看出,茜素红染色显示转染mimic将会增加钙盐沉积,而转染antagomir则可减少钙盐沉积。也可通过体外培养主动脉环的实验验证这一结论。
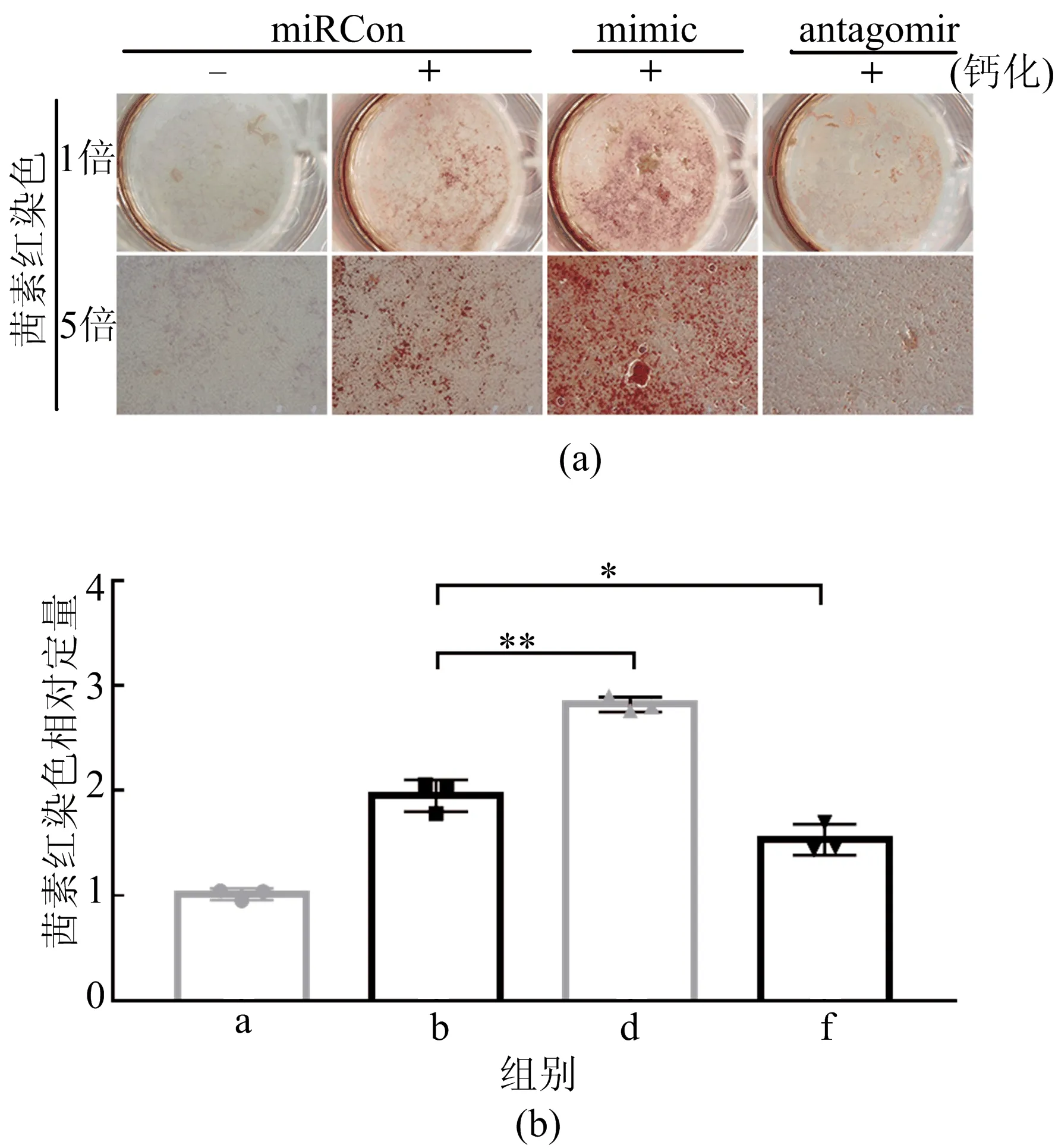
图7 茜素红染色和钙盐相对定量分析
体外培养动脉环,并转染mimic和antagomir,结果与HASMCs实验结果一致,如图8所示。由图8可知,过表达miRNA-130b-3p将增加钙化,而封闭miRNA-130b-3p则会减轻钙化程度。
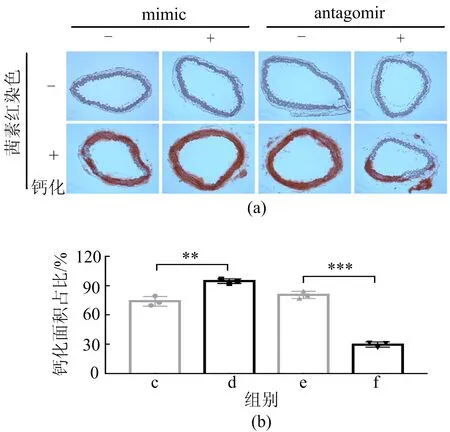
图8 茜素红染色及钙化面积占比统计
2.4 RUNX2及凋亡对钙化的影响
为了进一步确定具体发挥作用的信号途径,通过Western Blot实验检测相关转录因子RUNX2和关键蛋白BMP2的表达变化,如图9所示。从图9可以看出,在钙化时过表达miRNA-130b-3p将促进BMP2和RUNX2的表达,相反地,封闭miRNA-130b-3p则抑制BMP2和RUNX2的表达。随后,通过免疫荧光分析碱性磷酸酶(ALPL)和磷酸化SMAD1/5(pi-SMAD1/5)的表达,如图10所示。与WB中RUNX2和BMP2的表达变化一致,钙化诱导时mimic将促进ALPL和pi-SMAD1/5的表达,而antagomir则具有相反的效果。这些结果说明,miRNA-130b-3p通过BMP2信号途径和RUNX2来影响HASMCs的钙化进程。
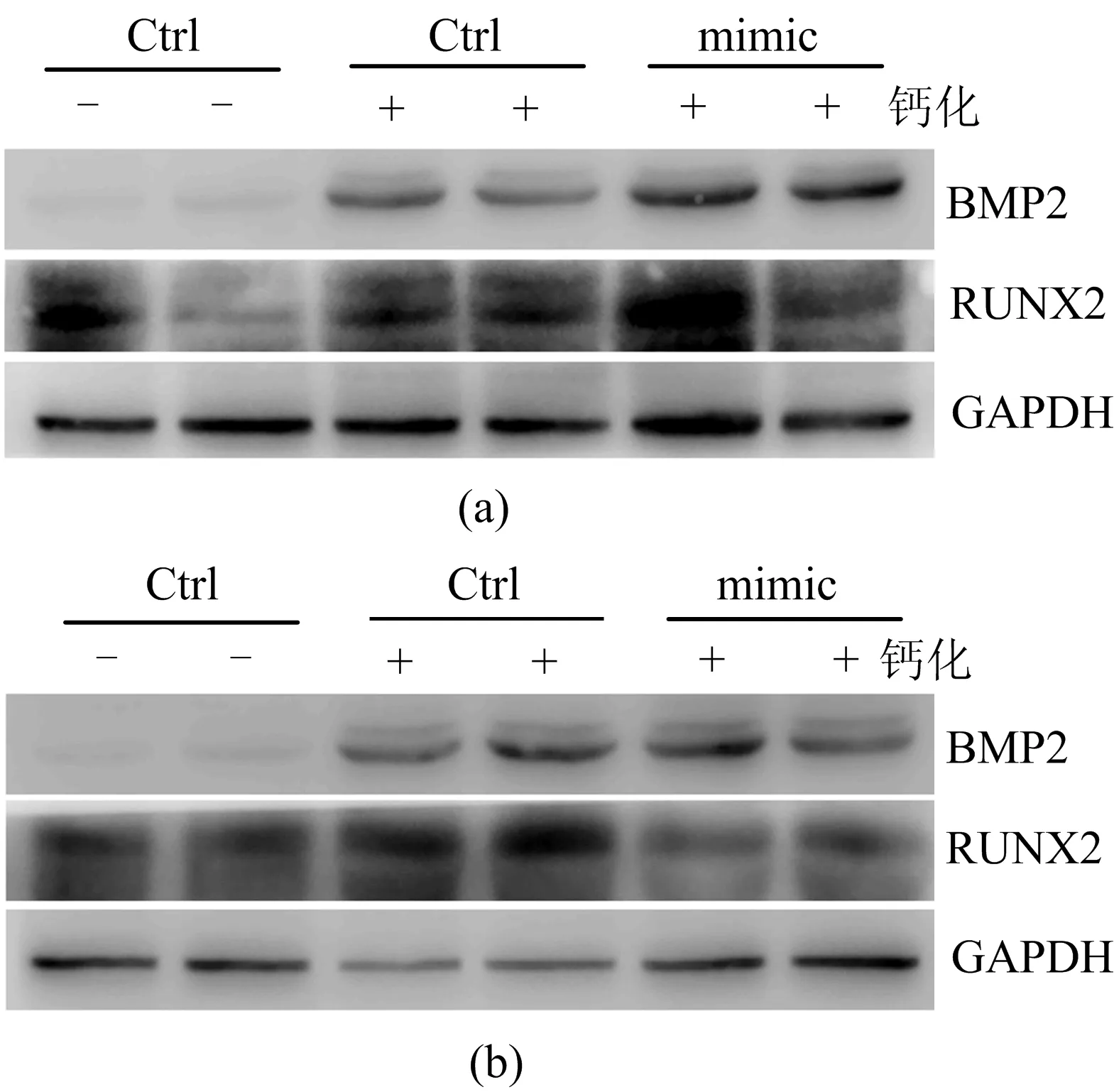
图9 RUNX2和BMP2蛋白表达、转染mimic和antagomir
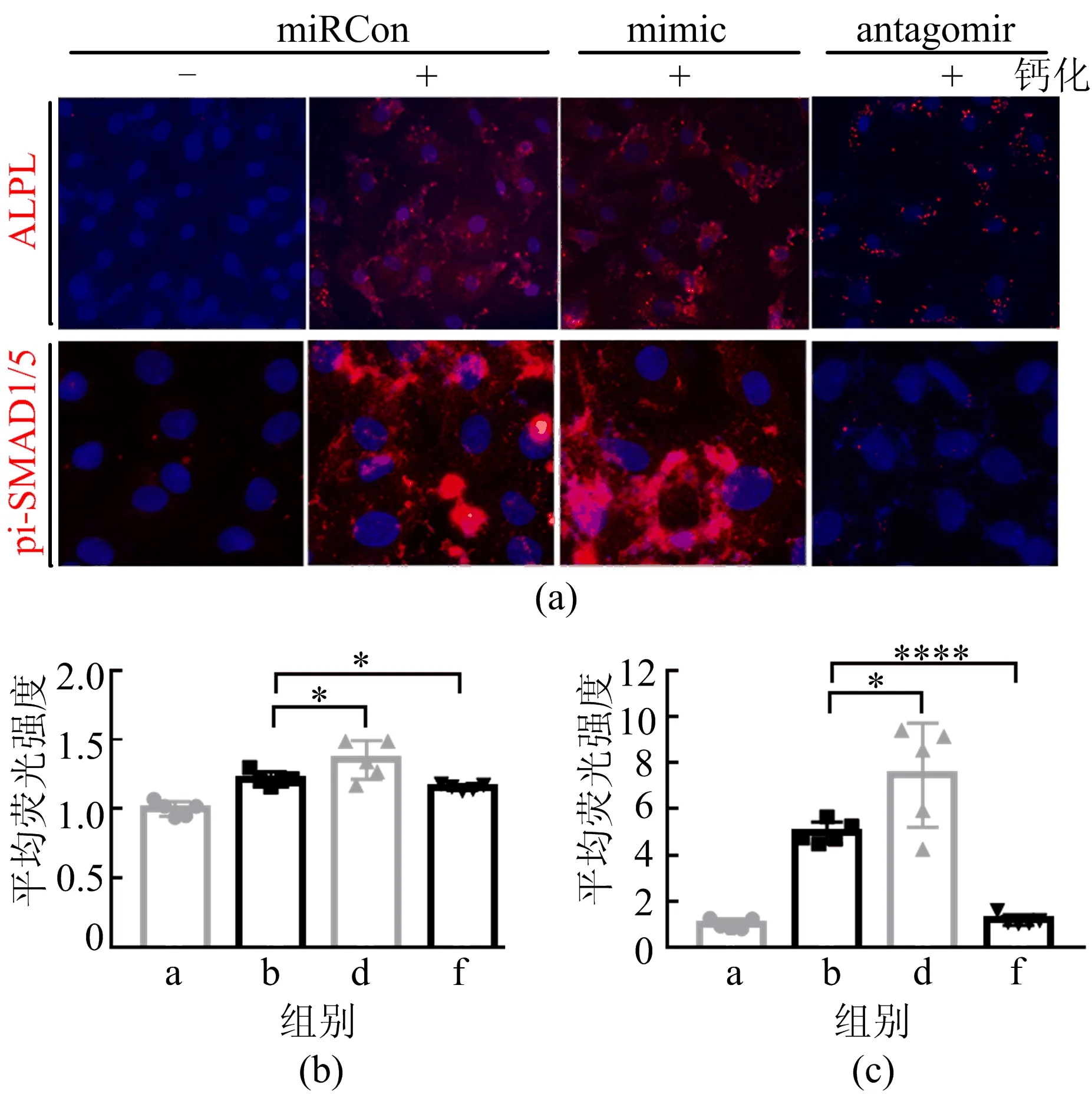
图10 ALPL和pi-SMAD1/5的表达及平均荧光强度
文献[20]报道HASMCs的凋亡将影响钙化,本文采用FACS检测当转染miRNA-130b-3p并钙化诱导时细胞凋亡状况,结果如图11所示。从图11可以看出,当转染mimic并钙化处理时会促进HASMCs的凋亡,而转染antagomir则会抑制HASMCs的凋亡,这些实验结果进一步说明,在钙化诱导处理时miRNA-130b-3p可以改变细胞的凋亡,从而影响钙化进程。
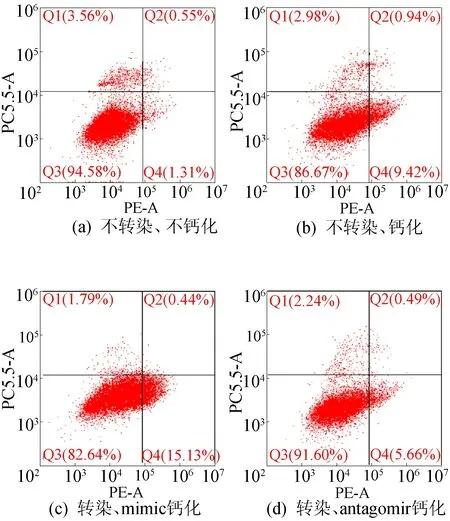
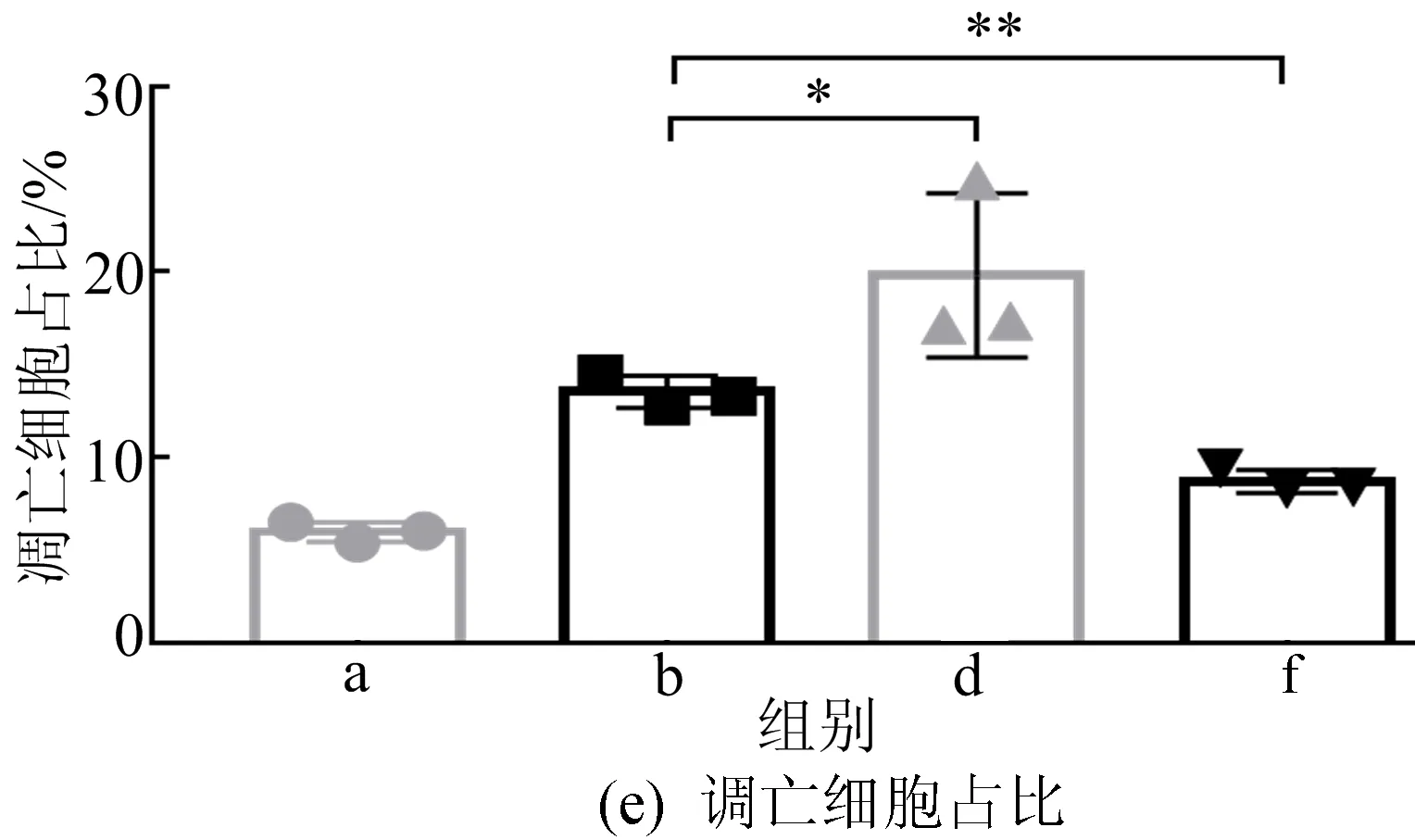
图11 FACS检测HASMCs转染并钙化诱导后的凋亡及统计
3 结 论
据统计2019年全球死于心血管疾病的人数为1 860万,占总死亡人数的32%(数据来源Global Burden of Disease),而钙化作为主要的病理之一,在其中扮演着重要角色,近20年来,关于血管钙化的机制不断被发掘,目前普遍接受的观点是钙化为一个主动的、类似骨生成的生物过程,多种信号途径参与其中。miRNA作为非编码RNA也在其中发挥关键作用,为了给临床治疗血管钙化提供更多的靶点,本研究主要探讨关于miRNA-130b-3p在血管钙化中的作用。
在由VD3诱导的中膜钙化小鼠模型中,检测到显著上升的miRNA-130b-3p及关键成骨、软骨分化转录因子RUNX2和SOX9,这表明miRNA-130b-3p参与血管钙化。通过体外诱导HASMCs的钙化确定了钙盐的沉积(即钙化水平)与上升的miRNA-130b-3p显著相关,通过转染miRNA-130b-3p的模拟物和抑制剂,确定miRNA-130b-3p是作为钙化的上游信号来影响下游的BMP2、RUNX2、si-SMAD1/5的表达,进而影响钙化进程,并分析在转染和钙化处理时细胞的凋亡情况,结果发现,模拟物能够促进细胞凋亡,而抑制剂能够抑制细胞凋亡。
虽然本研究未能确定miRNA-130b-3p的具体靶点,但文献[21]报道的miRNA-130b-3p靶向PTEN影响细胞凋亡;文献[22]发现PTEN参与HASMCs的钙化进程,结合本文的研究结果,miRNA-130b-3p靶向PTEN影响HASMCs的凋亡来影响钙化进程,需要进一步的研究验证其可能性。
综上所述,本研究的结果表明miRNA-130b-3p在钙化中发挥关键作用,这一结果有望为临床治疗血管钙化提供新的靶点。
