局部进展期直肠癌新辅助放化疗术后淋巴结持续受累的临床病理因素及预后分析
2022-10-11柯友忠贾后军
陈 朝,柯友忠,刘 渊,贾后军
(重庆医科大学附属第一医院胃肠外科,重庆 400000)
直肠癌(rectal cancer)是全世界最常见的消化道恶性肿瘤之一,近年来直肠癌的发病率和死亡率均呈明显的上升趋势,分别位居恶性肿瘤的第3 位和第5 位,且发病年龄呈年轻化态势[1]。由于早期症状不典型,大部分直肠癌患者确诊时即为局部进展期。目前术前新辅助放化疗联合全直肠系膜切除术(totle mesorectal exision,TME)及术后辅助化疗已成为可切除局部进展期直肠癌的标准治疗模式[2]。通过新辅助放化疗可以有效提升患者的肿瘤病理缓解率、手术保肛率及控制率,改善患者的生存质量。然而部分患者由于多种因素的影响,仍出现术后淋巴结阳性,已有多项研究表明,术后淋巴结转移是影响患者预后的重要因素之一[3-5]。本研究通过分析可能影响新辅助放化疗术后淋巴结持续转移的临床病理因素,旨在为指导患者的个体化治疗方案提供一定的参考依据,现报道如下。
1 资料与方法
1.1 一般资料 回顾性分析2016 年1 月-2019 年1 月就诊于重庆医科大学附属第一医院胃肠外科的局部进展期直肠癌患者的临床病理资料。纳入标准:①病理诊断明确为直肠腺癌且为原发性;②术前MRI 或直肠超声考虑有周围淋巴结转移;③无肝肺等远处转移;④新辅助放化疗后行根治性手术且肿瘤组织送病理性检查;⑤术前术后资料完整。排除标准:①既往其他肿瘤或放化疗病史;②肠道多源性肿瘤;③放化疗期间因远处转移更改化疗方案患者;④一般情况差,不能耐受新辅助放化疗患者;⑤术前术后资料缺失。最终共有103 例患者纳入研究,根据术后淋巴结转移情况将其分为ypN0 和ypN+两组。
1.2 方法
1.2.1 新辅助放化疗前评估 所有纳入研究患者行新辅助放化疗前均完善肠镜检查并取得病理活检结果,以明确诊断;完善胸部、全腹及盆腔的计算机断层扫描(CT),以排除肝、肺等远处转移及评估其他脏器功能;完善盆腔高分辨率磁共振成像(MRI),以明确肿瘤浸润深度、肿瘤长径、肿瘤距肛缘距离(DIS)、淋巴结转移情况、环周切缘(CRM)是否阳性及有无壁外血管侵犯(EMVI)等;并评估患者一般情况,完善相关查血,包括血常规、血生化、凝血象、肿瘤抗原标志物等,排除新辅助放化疗相关禁忌证。
1.2.2 新辅助放化疗前淋巴结评估 所有患者行新辅助放化疗前均完善高分辨率MRI 或直肠内超声,根据2021 中国临床肿瘤学会(CSCO)结直肠癌诊疗指南,对符合以下条件的淋巴结,则考虑有肿瘤转移:淋巴结短径>8 mm,形态不规则、边界不清楚、信号/回声不均匀。
1.2.3 新辅助放化疗方法 采用长程放疗,放疗剂量为45~50.4 Gy,共25~28 次,单次剂量为1.8~2.0 Gy,每周连续放疗5 d,5 周完成。在放疗期间同时给予卡培他滨(罗氏制药,国药准字H20073023,规格:500 mg/片)口服,剂量825 mg/m2,2 次/d。放疗结束后给予标准的CapeOx 化疗方案2 个周期,每周期包括第1 天静脉输注奥沙利铂130 mg/m2(江苏恒瑞制药,国药准字H20000337,规格:50 mg/支),第1~14 天口服卡培他滨1000 mg/(m2·次),2 次/d,随后休息1 周,开始第2 周期化疗。放化疗结束后8~12周,再次评估,准备下一步手术治疗。
1.3 观察指标 观察指标包括性别、年龄、BMI、肿瘤距肛缘距离(DIS)、肿瘤长径、治疗前T 分期、治疗前N 分期、治疗前环周切缘(CRM)、壁外血管侵犯(EMVI)、癌胚抗原(CEA)、CA19-9、血小板淋巴细胞比率(PLR)、中性粒淋巴细胞比率(NLR)、预后营养指数(PNI)。
1.4 术后随访 通过门诊、电话等方式随访,术后前3年每3~6 个月随访1 次,此后每年随访1 次。复查内容包括病情询问、一般查体、肿瘤抗原标志物、CT及肠镜等,记录患者随访档案。
1.5 统计学方法 采用SPSS 21.0 软件进行统计学处理,符合正态分布的计量资料以()表示,不符合正态分布的以[M(P25,P75)]表示,计数资料以[n(%)]表示。两独立样本计量资料比较符合正态分布的采用t检验,不符合正态分布的采用Mann-WhitneyU秩和检验,计数资料比较采用χ2检验。采用Kaplan-Meier 法进行生存分析,将与淋巴结持续受累有关的危险因素采用Logistic 回归模型进行多因素分析,P值均采用双侧检验,P<0.05 为差异有统计学意义。
2 结果
2.1 直肠癌患者不同临床病理特征新辅助治疗术后淋巴结持续转移的比较 术后淋巴结持续转移者有36 例(34.95%)。治疗前N2期患者术后淋巴结持续受累者(41.33%)高于术前N1期者(17.86%)(P<0.05);治疗前CEA≥5 μg/L 的患者术后淋巴结持续受累者(47.27%)高于术前CEA<5 μg/L 者(20.83%)(P<0.05);治疗前EMVI 阳性患者术后出现淋巴结持续受累者(43.75%)高于治疗前EMVI 阴性者(20.51%)(P<0.05);性别、年龄、治疗前BMI、DIS、肿瘤长径、CRM、T 分期、CA19-9、PLR、NLR 及PNI 与术后淋巴结持续转移无关(P>0.05),见表1。
表1 两组不同临床病理特征比较[,M(P25,P75)]
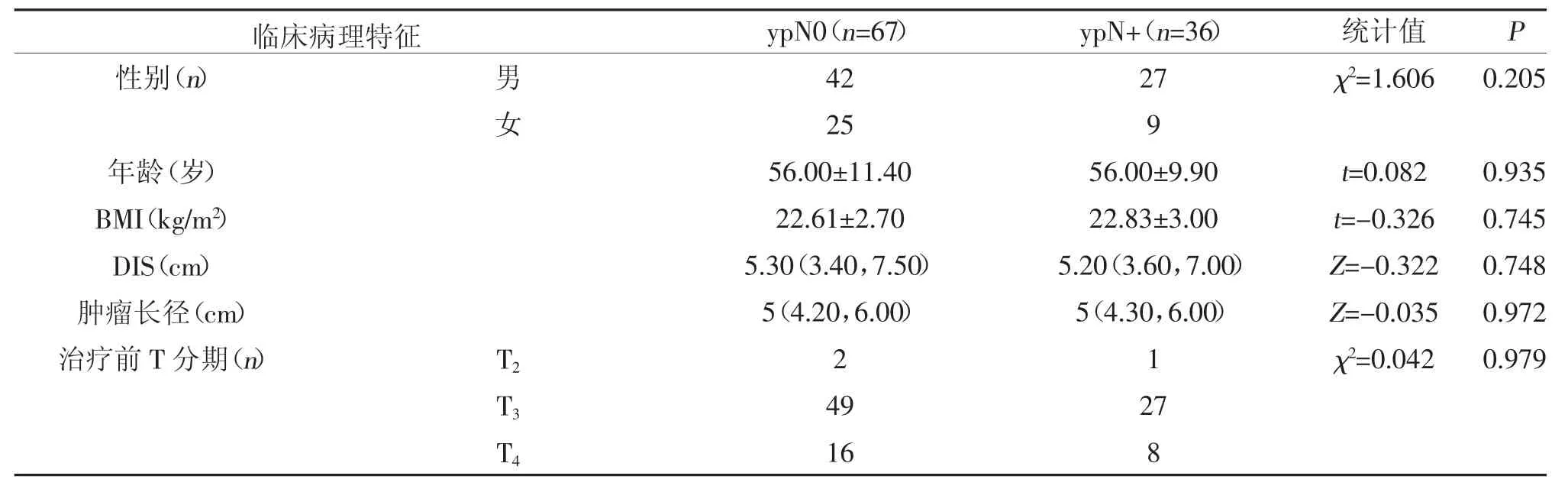
表1 两组不同临床病理特征比较[,M(P25,P75)]
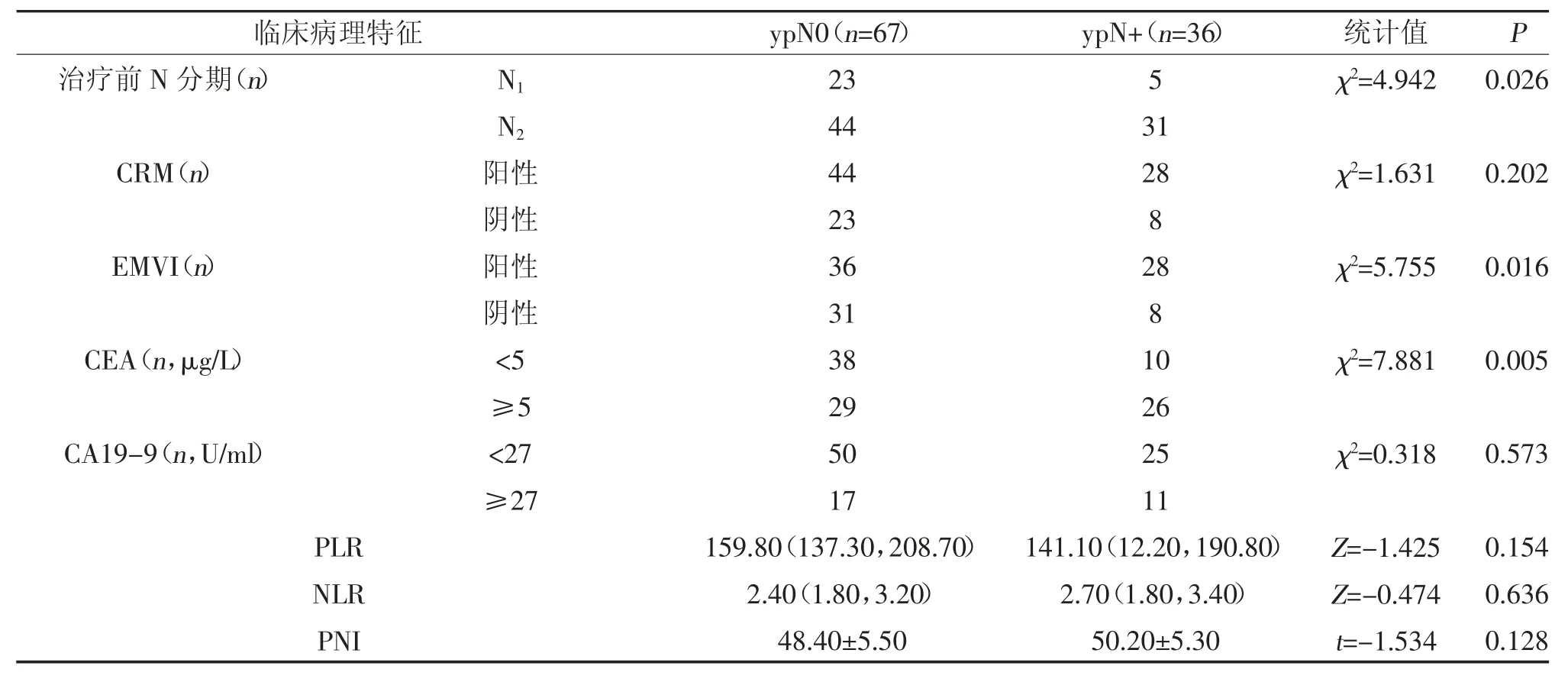
表1(续)
2.2 术后淋巴结持续转移影响因素的Logistic 分析多因素分析结果显示,治疗前N 分期处于N2期和EMVI 阳性是直肠癌新辅助治疗术后淋巴结持续转移的独立危险因素,见表2。

表2 新辅助治疗术后淋巴结持续转移的多因素分析
2.3 ypN0 和ypN+两组患者的生存分析 全组103例患者中,术后淋巴结阴性者(ypN0)67 例(65.05%),术后淋巴结淋巴结持续转移者(ypN+)36例(34.95%),中位随访时间为[42(33,54)]个月。ypN0 组患者的3 年总生存率为95.50%,高于ypN+组患者的66.70%(χ2=9.256,P=0.002),见图1。
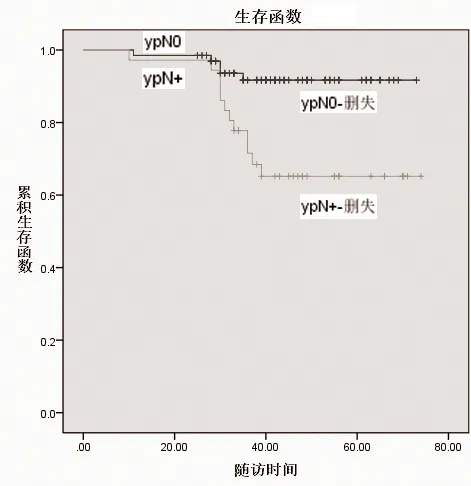
图1 ypN0 和ypN+患者的Kaplan-Meier 生存曲线图
3 讨论
肿瘤消退分级(TRG)是直肠癌新辅助放化疗后疗效的判断的重要指标,并且被广泛应用于患者预后的评估。不同的学者制定了不同的TRG 标准,但这些评分标准都只考虑了原发肿瘤的消退情况,往往忽视了淋巴结情况;而淋巴结情况是术后病理TNM分期的重要组成部分,与患者的预后密切相关。已有多项研究证实直肠癌新辅助放化疗术后淋巴结持续受累与患者的预后密切相关[6,7]。因此新辅助治疗前识别具有治疗抵抗性淋巴结的患者并调整新辅助治疗方案可能会获得更好的预后。目前国内外关于直肠癌新辅助放化疗术后淋巴结持续受累相关的研究相对较少,本课题通过分析影响术后淋巴结持续受累可能的临床病理因素,旨在为提前识别术后淋巴结持续受累的患者提供一定的参考依据,更好的指导患者的个体化治疗方案。同时也通过比较ypN0 和ypN+两组患者的总生存率,验证了ypN+患者的不良预后,这也与已有的研究结论相一致[8,9]。
淋巴结转移是直肠癌患者TNM 分期的重要组成部分,是评价患者预后的重要影响因素。对于术前淋巴结分期的评估,目前最常用也相对准确的无创检查为直肠内超声(EUS)和盆腔核磁共振(MRI)。有文献报道,相较于EUS,MRI 在N 分期中的敏感性更高,更适用于局部晚期的直肠癌患者[10],在保证N 分期准确的前提下,随着淋巴结转移数目的增加,患者的预后也相应越差。本研究中治疗前N 分期处于N2期与N1期的患者术后出现淋巴结持续受累者分别占41.33%和17.86%(P<0.05),认为治疗前MRI 提示处于N2期的直肠癌患者更容易出现术后淋巴结持续受累,从而预后更差。有研究表明直肠癌EMVI阳性与患者的预后密切相关[11-13],究其原因可能与其可能导致的肿瘤细胞淋巴结转移与远处转移有关[14,15]。Tripathi P 等[16]研究纳入了863 例EMVI阳性直肠癌患者和1212 例EMVI 阴性患者的资料,结果表明EMVI 阳性和EMVI 阴性患者的淋巴结病患病率分别为75.90%和52.56%(P<0.001),提示阳性EMVI 与直肠癌淋巴结转移密切相关。Liu L 等[17]研究纳入183 例局部进展期直肠癌患者,从临床和影像等因素分析可能影响区域淋巴结转移的因素,得出相同的结论,即阳性EMVI 可能是直肠癌患者区域淋巴结转移的独立预测因子。本研究中治疗前EMVI 阳性患者术后出现淋巴结持续受累者占43.75%,而治疗前EMVI 阴性者则占20.51%(P<0.05),且多因素分析结果提示治疗前EMVI 阳性是新辅助放化疗术后出现淋巴结持续受累的独立危险因素,这与已有的研究结论基本一致。
Dinaux AM[18]等研究显示新辅助治疗后持续淋巴结受累与远处转移风险增加和无病生存期缩短有关。Tominaga T 等[19]研究表明,ypN+患者的5 年无复发生存率较ypN0 患者明显变差,提示了不良预后。本研究结果提示ypN+组患者的总生存率低于ypN0组,差异有统计学意(P<0.05),表明新辅助放化疗术后淋巴结持续受累与患者的不良预后相关。与上述研究结论相符。
综上所述,新辅助治疗前准确评估N 分期及壁外血管侵犯情况有助于评估患者NCRT 术后的淋巴结消退情况,对于治疗前处于N2期及EMVI 阳性的患者,可通过调整新辅助治疗的方案或剂量,从而改善患者的预后,提高患者的生存率。
