基于自噬相关基因构建的预后模型对脑胶质瘤免疫微环境的影响
2022-10-11乔秋江
乔秋江,庞 琦
(山东大学附属山东省立医院神经外科,山东 济南 250021)
脑胶质瘤(glioma)是当前中枢神经系统最常见的原发性恶性肿瘤,预后较差[1]。胶质母细胞瘤(Ⅳ级)是其中恶性程度最高的一种,中位生存期不足15 个月[2]。异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH)突变状态、1p/19q 共缺失和O-6-甲基鸟嘌呤-DNA 甲基转移酶(O-6-Methylguanine-DNA Methyltransferase,MGMT)启动子甲基化等被证明可以预测胶质瘤患者的药物反应及预后[3,4]。也有研究发现[5-7],不同类型胶质瘤中DNA 修复通路的激活、抗凋亡潜能或保护性自噬及胶质瘤干细胞(GSCs)的差异同样导致了预后的不同。由于恶性胶质瘤的肿瘤微环境异质性,目前治疗仍未见明显进展,探究影响胶质瘤肿瘤预后的潜在分子标志物对临床治疗有重要意义。自噬是一种高度保守的细胞动态自我消化过程,主要包括自噬体的形成以及自噬体与溶酶体的融合和降解[8]。自噬有助于维持细胞的能量代谢,也可消除受损细胞器和错误折叠的蛋白质,维持细胞内环境稳定。而过度自噬的发生,可引起细胞死亡,这种死亡方式称为Ⅱ型程序性细胞死亡[9]。自噬对于肿瘤微环境中抗肿瘤免疫中也有重要作用[10],调节肿瘤细胞生存的潜在能力使其成为癌症治疗的目标。缺氧是影响胶质瘤肿瘤微环境的重要因素,可以导致肿瘤细胞的营养不足和基因表达的改变,也影响着细胞内自噬水平的改变[11]。缺氧诱导因子(HIF-1α)是细胞缺氧反应中的重要调控因子,能够影响细胞内自噬相关基因的表达,进而影响肿瘤细胞的免疫微环境。有研究表示[12],缺氧可以激活HIF-1α 依赖的自噬,从而通过抵消细胞毒性T 淋巴细胞和NK 细胞介导的抗肿瘤免疫反应来促进肿瘤细胞的生存。而本研究旨在通过公共数据库挖掘脑胶质瘤缺氧与自噬相关基因的关系,并建立模型预测患者预后和免疫微环境,以期为脑胶质瘤的发生、发展及治疗提供更可靠的依据。
1 资料与方法
1.1 数据下载及数据处理 在Human Autophagy Database(HADb)(http://www.autophagy.lu/)下载232个自噬相关基因。通过The Cancer Genome Atlas(TCGA)(https://portal.gdc.cancer.gov/)和 Chinese Glioma Genome Atlas(CGGA)(http://www.cgga.org.cn/)数据库分别收集610 例和658 例胶质瘤患者临床信息和基因表达数据,数据分析过程中去除临床信息不完整的样本。
1.2 基因相关性分析 利用R4.1 软件进行Pearson相关性分析,并挑选出|与HIF-1α 相关性值|>0.3,P<0.05 的基因。通过与已下载的232 个自噬相关基因(ARGs)对比,筛选出与缺氧相关的ARGs。
1.3 差异表达基因功能分析 使用org.Hs.eg.db,cluster Profiler,ggplot2 等R 包对已筛选出的ARGs进行GO[生物过程(BP)、细胞成分(CC)和分子功能(MF)]和KEGG 功能富集分析,FDR<0.05 视为差异有统计学意义。富集分析筛选出与缺氧相关的ARGs 潜在分子机制和信号通路。
1.4 预后分析 对以上筛选出的ARGs 使用单因素Cox 回归分析,选出与预后相关的基因,筛选阈值为:风险比HR≠1,P<0.05。对预后相关基因进行多因素Cox 比例风险回归分析,获得预后相关基因的回归系数。使用基因的表达水平和回归系数计算患者的风险分数。根据风险评分中位数将以上患者分为高风险组和低风险组。使用K-M 生存曲线评估两组之间生存预后的差异;绘制ROC 曲线,计算AUC值,引入CGGA 数据库数据作为验证集评估该风险评分模型效能。
1.5 构建风险预测模型与肿瘤免疫微环境的关系分析 使用R 语言分别通过ESITMATE 算法和Cibersort 算法计算高、低风险组的免疫浸润分数和22 种免疫细胞浸润的差别,利用两组中抑制性免疫检查点的表达差异推测其对免疫治疗的反应。
1.6 统计学分析 使用R4.1、Adobe Illustrator 2019进行统计分析和作图。生存曲线使用Log-rank 检验,以P<0.05 表示差异有统计学意义。
2 结果
2.1 基因表达相关性分析 共筛选出2370 个基因与HIF-1α 存在相关性(图1A)。通过与从HADb 下载的232 个ARGs 比较,结果筛选出40 个HIF-1α 表达相关的ARGs,见图1B。

图1 基因表达相关性分析
2.2 GO 和KEGG 富集分析 GO 分析显示,BP 中主要包括对外界刺激的反应、自噬的调控和对营养水平的反应;CC 中主要为膜筏、自噬体以及死亡诱导复合体;MF 中主要为半胱氨酸型内肽酶活性参与的凋亡信通路,见图2A;KEGG 富集分析显示,上述ARGs 主要富集于自噬、凋亡、多种神经退行性疾病以及内质网中的蛋白质加工等,见图2B。
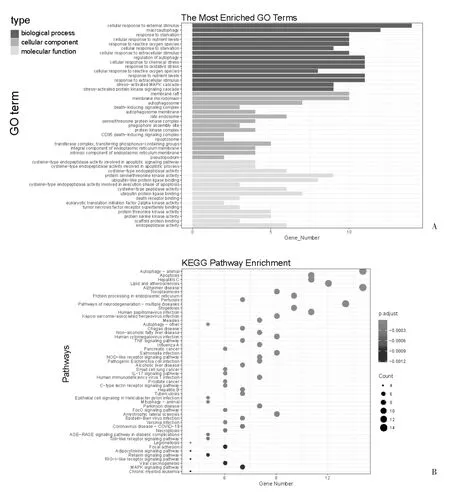
图2 HIF-1α 相关性ARGs 的GO 和KEGG 富集分析
2.3 风险评估模型的建立 通过单因素Cox 回归分析,在40 个与HIF-1α 相关的ARGs 中有36 个与患者生存预后密切相关(图3A)。对其进行多元Cox回归分析,筛选出4 个ARGs(CASP3、MAPK9、NAMPT、CAMKK2)以构建风险评估模型(图3B)。通过所选基因的回归系数系数及相对表达量构建胶质瘤患者的风险评分,并以中位风险评分将患者分为低风险组和高风险组,散点图显示高风险组死亡率高于低风险组,热图显示随着风险评分的升高,CASP3 和NAMPT 在高风险组中表达升高,与不良预后相关;MAPK9 与CAMKK2 在高风险组中表达降低,其低表达与不良预后相关,为保护性因素(图3C)。
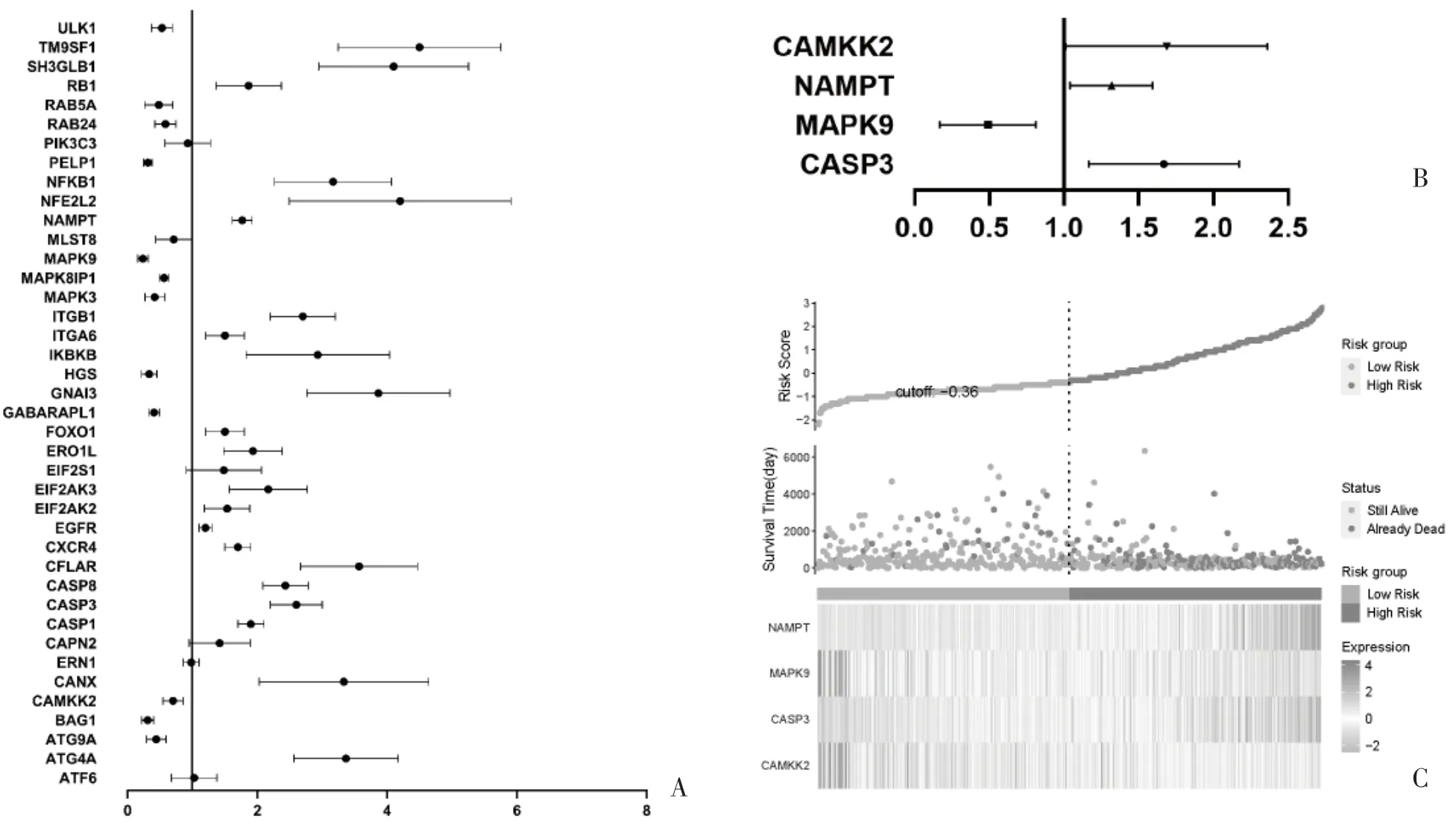
图3 构建基于HIF-1α 相关的ARGs 的风险评分预后模型
2.4 预后模型的验证 使用R 语言的survival ROC包,制作不同时间点的ROC 曲线,并计算AUC,结果显示该风险模型可预测胶质瘤患者预后的效果,其中3 年时AUC 最大,为0.89(图4A)。K-M 生存曲线显示,低风险组生存率高于高风险组(图4B)。随着风险评分的升高,死亡患者随之增加,4 个ARGs 表达情况与上述结果基本一致,K-M 生存曲线同样验证了该风险评估模型在预测胶质瘤患者的良好表现(图4C、4D)。
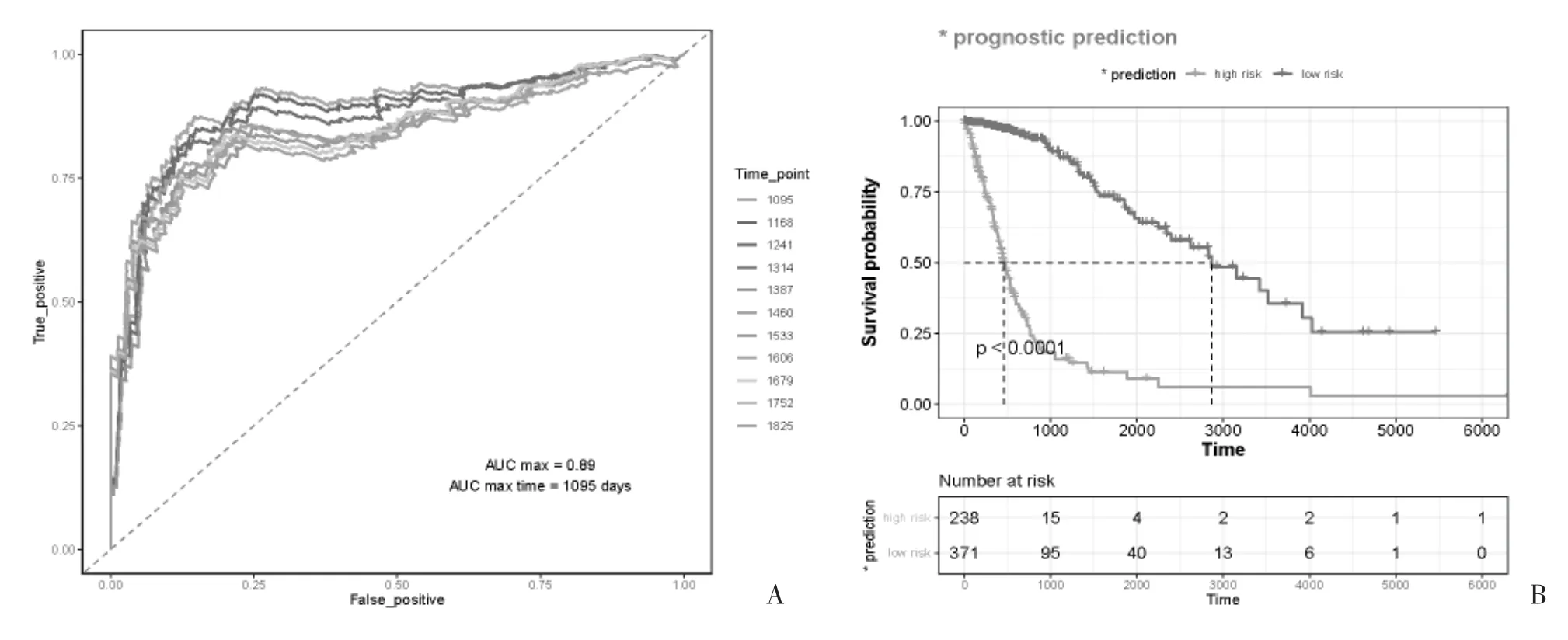
图4 预后风险模型效能的评价
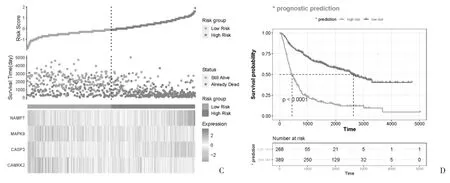
图4 预后风险模型效能的评价(续)
2.5 风险评估模型与免疫微环境的关系 ESITMATE算法显示,高风险组免疫浸润评分高于低风险组(图5A);免疫检查点基因结果显示,高风险组PD1、PDL1、PDL2、LAG3、B7H3、TIM3、CTLA4 高于低风险组(图5B);免疫细胞浸润结果显示,高风险组单核细胞、活化自然杀伤细胞和浆细胞低于低风险组(图5C)。

图5 风险评估模型与免疫微环境的关系
3 讨论
胶质瘤具有很强的肿瘤异质性,相比肺癌、乳腺癌等其他恶性肿瘤,目前针对胶质瘤的靶向治疗仍未取得较大进展。恶性胶质瘤的遗传不稳定性和不均一性明显,相关信号通路作用及相互调节机制尚未清楚,多靶点联合分析并构建相关风险模型是胶质瘤治疗中重要的研究思路。缺氧在胶质瘤肿瘤微环境起重要作用,参与了血管生成、转移、耐药、免疫逃逸等在内的多个方面。同时研究证明[13],缺氧与肿瘤细胞自噬的发生密切相关,自噬可以通过缺氧环境依赖的方式抑制或驱动肿瘤的发生与进展。HIF-1α是肿瘤缺氧环境的重要调控因子,也是肿瘤微环境中免疫逃逸的重要组成部分。研究报道[14],HIF-1α 通过诱导自噬促进肿瘤细胞免疫逃避。
本研究中用于构建风险评估模型的4 个ARGs,包 括 CASP3、MAPK9、NAMPT、CAMKK2。NAMPT 是烟酰胺腺嘌呤二核苷酸(NAD+)合成的重要限速酶,在调节肿瘤免疫逃逸中发挥重要作用,可以驱动IFN-γ 诱导PD-L1 的表达,并以CD8+T 细胞依赖的方式调控肿瘤免疫逃避,进而调控肿瘤的发生、发展、侵袭和转移。有研究证明[15],抑制NAMPT 可以通过激活线粒体功能障碍有效地靶向调控胶质瘤的遗传异质性。另有研究报道[16],CAMKK2 抑制剂可以CD8+T 细胞依赖的方式抑制乳腺癌细胞生长,并促进免疫细胞的重新编程。MAPK9 是MAP 激酶家族的一员,在基因表达调控和细胞质生物功能中起关键作用。有研究证明[17],MAPK9 在非小细胞肺癌中发挥作用。
肿瘤细胞具有多种免疫逃避的机制,但其受限于患者肿瘤免疫微环境的区别,存在应用局限性。通过此风险评估模型判断胶质瘤患者免疫微环境差异有助于免疫治疗的临床应用。肿瘤细胞通过产生异常的免疫检查点信号来减弱免疫反应,从而促进免疫逃逸[18]。PD1 是重要的T 细胞抑制因子,其与肿瘤细胞的PD-L1 结合可以明显抑制细胞毒性T 细胞的增殖和活性,导致肿瘤细胞的免疫逃逸,且抑制性免疫检测点的阻断治疗方法已经在多种肿瘤治疗中展现了良好的效果。有研究证明[19],HIF-1α 在非小细胞肺癌细胞中通过表皮生长因子受体突变调控程序性细胞死亡配体1 的表达。PD1、PDL1、LAG3、TIM3、B7H3 等免疫检查点的高表达通常代表肿瘤细胞对免疫检查点抑制剂的反应较好。本研究中高风险组PD1、PDL1、PDL2、LAG3、B7H3、TIM3、CTLA4 高于低风险组,提示本预后模型可以用于判断胶质瘤免疫治疗的效果。而免疫细胞浸润结果显示,高风险组单核细胞、活化自然杀伤细胞和浆细胞低于低风险组;同时高风险组免疫浸润评分高于低风险组,以上结果说明该风险评估模型可以用于判断胶质瘤免疫微环境的改变。
基于生物信息学构建的风险评估模型仍具有一定的局限性,使用公共数据库构建预后模型的基因仅有具有统计学意义的关联,暂不能肯定其相互作用。本研究中基因的生物学功能及作用的信号通路仍需在体内实验和体外实验中验证,其临床意义也需在大规模多中心临床队列中进行验证。总之,本研究提供了一种通过构建基于缺氧这一重要肿瘤微环境相关ARGs 的模型来预测胶质瘤患者预后的方法,为胶质瘤提供了研究方向和靶点。
