罗耳阿太菌多糖经Nrf2 通路预防小鼠肝脏铅损伤机制
2022-10-11李鸿梅王志超闵伟红
赵 盼,李鸿梅,王志超,闵伟红
(吉林农业大学食品科学与工程学院,吉林长春 130118)
肝脏是机体铅代谢的重要场所,铅在体内随血液流动进入肝脏并在肝脏中蓄积,易造成肝脏损伤。1965 年,Wills 发现长期过量与铅接触会导致各脏器发生氧化应激。铅通过直接诱导机体产生大量活性氧和抑制抗氧化防御系统引发氧化应激,对DNA、蛋白质等生物大分子产生影响,从而干扰多种生化过程。核因子E2 相关因子(nuclear factor erythroid-2-related factor 2,Nrf2)是机体对抗外源性刺激的防御机制之一,Nrf2 信号通路的激活有利于减轻肝脏铅损伤。因此,Nrf2 作为改善小鼠肝脏铅损伤的研究靶点具有重大意义。
螯合剂通常用于治疗铅中毒,但它们被证实具有多种副作用。近年来,研究发现多糖具有改善器官铅损伤作用,如改善铅中毒大鼠学习记忆力、抑制炎症反应、保护肝脏和生殖系统等。罗耳阿太菌多糖(polysaccharides,AEPS)是由罗耳阿太菌()以玉米淀粉和玉米黄浆为碳源和氮源发酵分泌的一种胞外多糖,具有良好的吸湿、保湿、抗氧化和螯合金属离子的性质。前期研究发现,灌胃AEPS 减少了小鼠体内铅的积累,病理切片也证明AEPS 减轻了小鼠大脑、肝脏、肾脏和睾丸的损伤。然而,AEPS 能否通过调节Nrf2 信号通路改善小鼠肝脏铅损伤的研究尚未见报道。本研究旨在探究AEPS 保护铅暴露小鼠肝脏的作用机制,并通过腹腔注射Nrf2 信号通路的抑制剂揭示上述作用机制与Nrf2 信号通路的联系,为开发安全的能改善器官铅损伤的功能性食品添加剂提供一定的理论依据。
1 材料与方法
1.1 材料与仪器
罗耳阿太菌() 吉林农业大学发酵工程实验室;昆明种小鼠(生产许可证号:SCXK(辽)2020-0001,SPF 级,雄性,4 周龄) 辽宁长生生物技术股份有限公司;EDTA 二钠钙和全反式维甲酸(all-trans-retinoic acid,ATRA) 美国Sigma 公司;Nrf2 抗体、激活型半胱氨酸天冬氨酸蛋白酶3(cysteine aspartic acid specific protease 3,Cspase-3)抗体、Bcl-2 相关X 蛋白(Bcl-2-associated X protein,Bax)抗体、B 淋巴细胞瘤-2(B lymphocyte tumor-2,Bcl-2)抗体 武汉爱博泰克(ABclonal)生物科技有限公司;多药耐药相关蛋白2(multidrug resistanceassociated protein 2,MRP2)抗体 英国Abcam 公司;丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、乳酸脱氢酶(lactate dehydrogenase,LDH)、谷草转氨酶(aspartate aminotransferase,AST)、谷丙转氨酶(alanine aminotransferase,ALT)、谷胱甘肽(glutathione,GSH)和谷胱甘肽巯基转移酶(glutathione-s-transferase,GST)检测试剂盒 南京建成生物工程研究所;辣根过氧化物酶标记山羊抗兔IgG 二抗、内参、BCA 蛋白浓度测定试剂盒和细胞核蛋白与细胞浆蛋白抽提试剂盒 碧云天生物技术研究所;PVDF 膜 北京鼎国昌盛生物技术有限责任公司;醋酸铅 广东省精细化学品工程技术研究开发中心。
Z36HK 型低温高速离心机 德国Hermle 公司;AA-6200 型火焰原子吸收分光光度计 日本津岛公司;EG1140 型石蜡包埋机、RM2255 型石蜡切片机德国Leica 公司;Olympus BX51 型光学显微镜日本Olympus 公司;NIS-ELEMNT BR 型图像分析系统 日本尼康公司;Infinite M200Pro 型酶标仪瑞士康泰集团有限公司;Mini-ProteanTetra 型电泳槽美国伯乐公司;DYCZ-40D 型转膜仪 北京六一仪器厂。
1.2 实验方法
1.2.1 罗耳阿太菌多糖的制备 参照文献[11]培养罗耳阿太菌。发酵液依次用1 mol/L NaOH 溶液调至pH7.0,80 ℃加热30 min,4 ℃,10000 g 离心30 min。上清液经微孔滤膜除菌丝,用10 mg/mL 木瓜蛋白酶脱蛋白,再用无水乙醇沉淀(上清液:乙醇,1:1.7,V/V),透析和冷冻干燥(-50 ℃)后得罗耳阿太菌多糖。罗耳阿太菌多糖的纯度为78.91%。罗耳阿太菌多糖由木糖、核糖、鼠李糖、葡萄糖、葡萄糖醛酸、半乳糖、半乳糖醛酸、塔罗糖和肌糖组成。
1.2.2 动物模型与分组 试验程序由吉林农业大学实验动物中心批准,所有动物手术都获得了当地伦理批准(批准号:2021 04 13 001)。试验开始前,72 只昆明种小鼠适应试验环境7 d(环境温度22±1 ℃,环境湿度60%~65%),自然采光,动物自由饮食和饮水。所有小鼠随机等分为9 组:空白对照组(NC)、模型组(MC)、阳性对照组(PC)、AEPS 低剂量组(LD)、AEPS 中剂量组(MD)和AEPS 高剂量组(HD)、ATRA 单独组(ATRA+NC)(该组用于验证ATRA 的注射剂量能否抑制小鼠肝脏组织Nrf2 信号通路)、ATRA 干预组(ATRA+MC)(该组用于验证铅暴露小鼠肝脏组织Nrf2 信号通路能否被ATRA抑制)、ATRA+AEPS 高剂量组(ATRA+HD)(该组用于验证AEPS 是否通过Nrf2 信号通路发挥保护铅暴露小鼠肝脏组织)。
试验小鼠连续30 d 自由饮用1 g/L 醋酸铅水溶液建立铅中毒小鼠模型。NC 组和ATRA+NC 组小鼠自由饮用12.5 μL/L 醋酸水溶液,持续30 d,其余组小鼠自由饮用1 g/L 的醋酸铅水溶液,并补充醋酸溶液保持醋酸浓度为12.5 μL/L,以避免铅盐和氢氧化铅发生沉淀反应。ATRA+NC 组、ATRA+MC 组、ATRA+HD 组小鼠腹腔注射10 mg/kg bw ATRA(ATRA 先用DMSO 溶解,再用玉米油稀释,ATRA终浓度为0.1 mg/mL,DMSO 终浓度为1%),其余组小鼠腹腔注射含1% DMSO 的玉米油。30 min 后,ATRA+HD 组和HD 组小鼠灌胃400 mg/kg bw AEPS,MD 组和LD 组分别灌胃200 和100 mg/kg bw AEPS,PC 组小鼠灌胃200 mg/kg bw EDTA 钙二钠,NC、MC、ATRA+NC 和ATRA+MC 组小鼠灌胃生理盐水,持续30 d。30 d 后,小鼠禁食12 h,称重,麻醉,腹主动脉取血,血液在室温中静止放置30 min,4 ℃,2700 g 离心15 min,吸取上清液测定AST、ALT和LDH 活性。然后迅速收集肝脏组织分为两个子样本,一部分用于组织病理学观察,另一部分保存在-80 ℃中用于Western blot 分析、铅水平和理化指标的测定。
1.2.3 肝脏中铅含量测定 肝脏的铅含量通过石墨炉吸收分光光度法测定。将保存的肝脏标本置于110 ℃的硝化釜中,加入3 mL 氢氟酸和20 mL 混合酸(硝酸:高氯酸,6:1,V/V),在硝化反应釜中硝化3 h。硝化至近干,用25 mL 0.1%的稀硝酸溶液溶解样品,最后,用火焰原子吸收分光光度计测定样品溶液的吸光度。肝脏铅含量按如下公式计算:
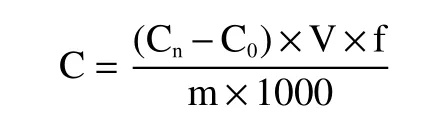
式中:C 表示小鼠肝脏中铅的浓度,mg/kg;C表示测试溶液中铅的浓度,ng/mL;C表示空白对照溶液中铅的浓度,ng/mL;V 表示25,mL;f 表示样品稀释倍数;m 表示被检测样品的质量,g。
1.2.4 肝脏GSH、GST、SOD、CAT 和MDA 的测定 取上述保存于-80 ℃的肝脏组织至离心管中,加入生理盐水(组织:生理盐水,1:9,W/V),充分匀浆,4 ℃,3400 g 离心10 min,收集上清液,BCA 法测定上清液中的蛋白浓度。严格遵守试剂盒说明书测定GST、CAT、SOD 活性和GSH、MDA 含量。
1.2.5 血清中ALT、AST 和LDH 活性的测定 严格遵守试剂盒说明书进行测定。
1.2.6 病理切片分析 肝脏组织样品依次用4%多聚甲醛固定,用100%、95%、90%和80%的乙醇将样品脱水,用石蜡包埋,切成5 μm 厚的标准切片,用苏木伊红染色切片,使用光学显微镜观察切片,最后用图像分析系统对切片进行分析。
1.2.7 Western blot 检测 参考文献[16]进行Western blot 实验并做适当修改。取出保存在-80 ℃的小鼠肝脏组织加入裂解液(裂解液:PMSF,1:99,V/V),充分匀浆,冰上裂解30 min,4 ℃,12000 g 离心10 min,上清液做为肝脏组织的总蛋白保留。提取肝脏核蛋白严格遵守试剂盒说明书进行。蛋白样品经SDSPAGE 凝胶电泳分离,再转印至PVDF 膜上。膜用脱脂奶粉封闭1 h 后,加入相应一抗,4 ℃孵育过夜。膜用TBST 清洗,用二抗溶液室温孵育1 h。用ECL 法在化学发光成像系统中曝光显影蛋白条带,用Image J 软件分析蛋白条带灰度值。
1.3 数据处理
GraphPad Prism 软件用于分析试验数据和作图。所有试验数据以平均数±标准差(x±SD)的形式显示。两组数据采用检验(Student's-test)方法进行分析。两组以上数据采用单因素方差分析(ANOVA)方法进行分析,并使用Tukey-Kramer 进行多重比较检验。<0.05 表示差异具有显著性。
2 结果与分析
2.1 AEPS 对铅暴露小鼠肝脏铅含量的影响
如图1 所示,MC 组小鼠肝脏铅含量显著高于NC 组(<0.05),表明铅暴露模型建立成功。与MC组相比,PC 组和AEPS 剂量组小鼠肝脏铅水平显著降低(<0.05),表明AEPS 和EDTA 二钠钙可抑制铅在肝脏中积累。相同剂量下,AEPS 抑制铅积累作用优于EDTA 二钠钙。ATRA 是Nrf2 信号通路的抑制剂,通过抑制Nrf2 向细胞核转移影响Nrf2 信号通路发挥抗氧化和解毒的作用。由于NC 组和ATRA+NC 组小鼠均未饮用醋酸铅溶液,因此两组肝脏铅含量低且没有显著差异性(>0.05)。ATRA+MC 组铅含量显著高于MC 组(<0.05),ATRA+HD组铅含量也显著高于HD 组(<0.05),可能的原因是ATRA 抑制了小鼠肝细胞中将铅离子转运出细胞的蛋白的表达,如MRP2。
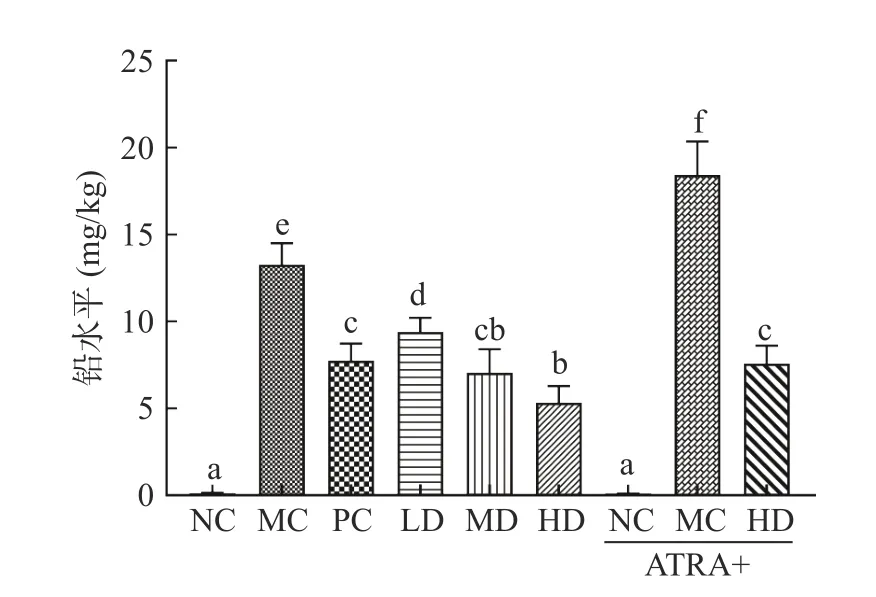
图1 AEPS 对铅暴露小鼠肝脏铅含量的影响Fig.1 Effects of AEPS on lead levels in liver of lead-exposed mice
2.2 AEPS 对铅暴露小鼠肝脏中GSH 和GST 的影响
由表1 可知,铅降低肝脏GSH 含量和GST 活性。与MC 组相比,PC 组和AEPS 剂量组小鼠肝脏GSH 含量和GST 活性被显著提高(<0.05)。在相同剂量下,AEPS 提高GST 活性的能力优于EDTA二钠钙。与NC 组相比,ATRA+NC 组小鼠肝脏GSH含量没有显著差异(>0.05),GST 活性显著下降(<0.05)。ATRA+MC 组小鼠肝脏GSH 含量和GST 活性均显著低于MC 组(<0.05)。ATRA+HD 组小鼠肝脏GSH 含量和GST 活性也显著低于HD 组(<0.05)。结果表明,AEPS 可能通过影响Nrf2 信号通路提高铅暴露小鼠肝脏GSH 含量和GST 活性。
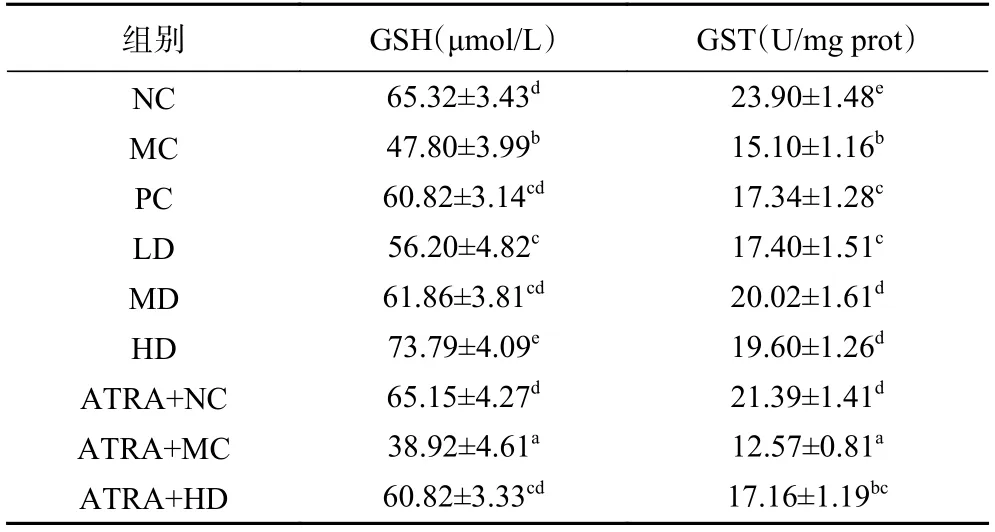
表1 AEPS 对铅暴露小鼠肝脏GSH 含量和GST 活性的影响Table 1 Effects of AEPS on GSH levels and GST activity in the liver of lead-exposed mice
2.3 AEPS 对铅暴露小鼠肝脏中抗氧化能力的影响
表2 为AEPS 对各组小鼠肝脏组织抗氧化能力的影响。相比NC 组,MC 组小鼠肝脏CAT 和SOD活性显著降低(<0.05),MDA 水平显著上升(<0.05),表明铅引起小鼠肝脏抗氧化能力的减弱。相比MC组,PC 组和AEPS 剂量组小鼠肝脏CAT 和SOD 活性显著升高(<0.05),MDA 水平显著降低(<0.05),表明AEPS 和EDTA 二钠钙都能提高铅暴露小鼠肝脏组织的抗氧化能力,且在相同剂量下,AEPS 在升高CAT 活性的表现优于EDTA 二钠钙。CAT、SOD活性和MDA 水平在NC 组和ATRA+NC 组没有显著性差异(>0.05)。相比MC 组,ATRA+MC 组小鼠肝脏CAT、SOD 活性显著降低(<0.05),MDA 水平显著升高(<0.05)。相比HD 组,ATRA+HD 组小鼠肝脏CAT、SOD 活性显著降低(<0.05),MDA水平显著升高(<0.05)。结果表明,AEPS 的增强铅暴露小鼠肝脏抗氧化活性作用可被ATRA 抑制。

表2 AEPS 对铅暴露小鼠肝脏抗氧化能力的影响Table 2 Effects of AEPS on the antioxidant activity of the liver in lead-exposed mice
2.4 AEPS 对血清中AST、ALT 和LDH 的影响
表3 表示的是AEPS 对小鼠血清AST、ALT 和LDH 活性的影响。相比NC 组,MC 组小鼠血清AST、ALT 和LDH 活性显著升高(<0.05),提示铅影响了小鼠肝功能。与MC 组对比,PC 组和AEPS 剂量组小鼠血清AST、ALT 和LDH 活性显著降低(<0.05),表明AEPS 和EDTA 二钠钙能恢复铅暴露小鼠肝功能,相同剂量的AEPS 和EDTA 二钠钙具有相同的效果。NC 组与ATRA+NC 组小鼠AST、ALT 和LDH活性没有显著差异(>0.05)。ATRA+MC 组AST、ALT 和LDH 活性显著高于MC 组(<0.05)。ATRA+HD 组AST、ALT 和LDH 活性显著高于HD 组(<0.05)。结果说明,AEPS 恢复铅暴露小鼠肝功能作用可能与Nrf2 信号通路有关。
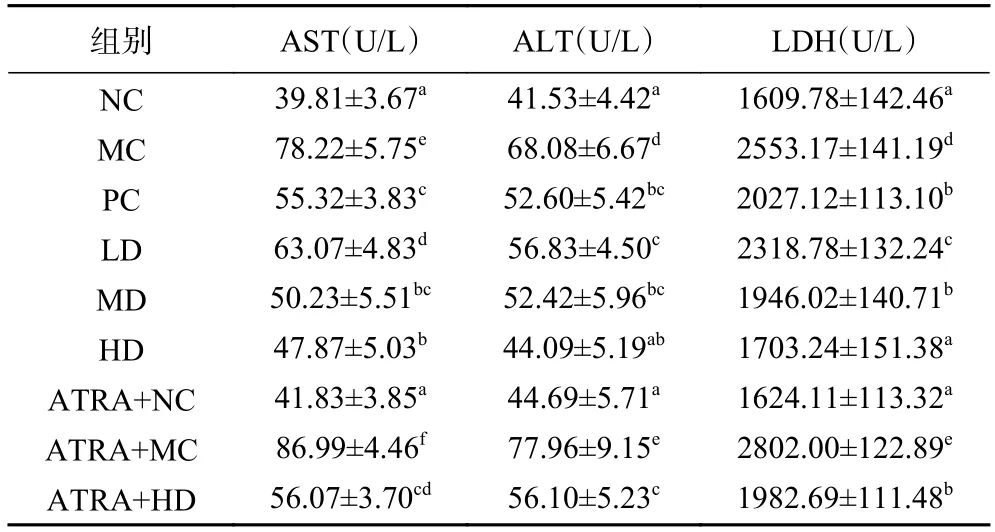
表3 AEPS 对血清中AST、ALT 和LDH 活性的影响Table 3 Effects of AEPS on AST,ALT and LDH activity in the serum
2.5 肝脏切片评估
小鼠肝脏组织HE 染色切片结果如图2 所示,NC 组小鼠肝脏未观察到异常,肝细胞呈索状排列,肝窦分布清晰,肝细胞核清晰。ATRA+NC 组小鼠肝细胞胞浆中出现轻微疏松,未见明显细胞变性。MC 组小鼠肝脏中央静脉扩张,充血,细胞胞浆疏松变性,肝索排列紊乱,肝窦间隙分布不清,细胞核仁不清晰。ATRA+MC 组小鼠肝索排列紊乱,肝细胞可见大面积严重的疏松变性,细胞核仁不清晰,胞浆红染呈嗜酸性。PC 组小鼠肝细胞排列规律,肝细胞胞浆疏松变性程度得到改善,部分胞浆红染呈嗜酸性,因此EDTA 二钠钙有效缓解了肝损伤。AEPS 剂量依赖性减轻小鼠肝脏损伤。LD 组小鼠核内染色质分布紊乱,少量核仁模糊不清,肝细胞胞浆疏松程度得到改善。MD 组小鼠中央静脉轻微扩张轻度充血,肝细胞排列规律,核仁清晰,部分细胞胞浆疏松变性。HD 组小鼠中央静脉无明显的扩张。与HD 组相比较,ATRA+HD 组小鼠肝细胞肿胀,肝窦间隙缩小,少量核内染色质分布紊乱,局部肝细胞胞浆疏松,表明ATRA 抑制了AEPS 对铅暴露小鼠肝脏病理损伤的改善作用。

图2 小鼠肝脏组织HE 染色切片(400×)Fig.2 HE staining of the mice liver tissues(400×)
2.6 AEPS 对铅暴露小鼠肝脏中Nrf2 的影响
结果如图3 所示,与NC 组比较,MC 组小鼠肝细胞核Nrf2 水平显著升高(<0.05),表明铅促进了Nrf2 核移位,进而启动了机体自身抵御毒物的防御机制。与MC 组比较,PC 组和AEPS 剂量组肝细胞核Nrf2 水平显著增加(<0.05),说明EDTA 二钠钙和AEPS 具有促进Nrf2 核移位的作用。ATRA 单独处理没有影响小鼠肝细胞核Nrf2 水平。与MC组相比,ATRA+MC 组肝细胞核Nrf2 水平显著下降(<0.05),表明ATRA 抑制了铅诱导的Nrf2 核移位,并且由AEPS 引起的Nrf2 核移位作用也被ATRA抑制。上述结果表明,AEPS 可能通过促进Nrf2 的核移位激活了Nrf2 信号通路,而ATRA 抑制了AEPS的Nrf2 激活作用。

图3 AEPS 对铅暴露小鼠肝细胞核Nrf2 蛋白水平的影响Fig.3 Effects of AEPS on Nrf2 protein levels in liver cell nucleus of lead-exposed mice
2.7 AEPS 对铅暴露小鼠肝脏中细胞凋亡的影响
采用Western blot 方法测定铅暴露小鼠肝脏组织中激活型Caspase-3、Bax 和Bcl-2 的表达水平。如图4 所示,铅处理显著提高激活型Caspase-3 和Bax 表达水平(<0.05),显著降低了Bcl-2 表达水平(<0.05),表明铅诱导小鼠肝细胞凋亡。PC 和AEPS剂量组显著降低激活型Caspase-3 和Bax 水平(<0.05),显著提高Bcl-2 水平(<0.05),并且在相同剂量下,AEPS 的抗凋亡能力强于EDTA 二钠钙。与NC 组相比,ATRA+NC 组小鼠肝组织中激活型Caspase-3 和Bax 水平未发生显著变化(>0.05),但Bcl-2水平显著降低(<0.05)。ATRA+MC 组激活型Caspase-3 和Bax 水平显著高于MC 组(<0.05),Bcl-2 显著低于MC 组(<0.05),表明ATRA 加重了铅引发的肝细胞凋亡。与HD 组相比,ATRA+HD 组激活型Caspase-3 和Bax 水平显著升高(<0.05),Bcl-2 水平显著降低(<0.05),表明ATRA 能抑制AEPS 在小鼠肝脏组织中发挥的抗凋亡作用。
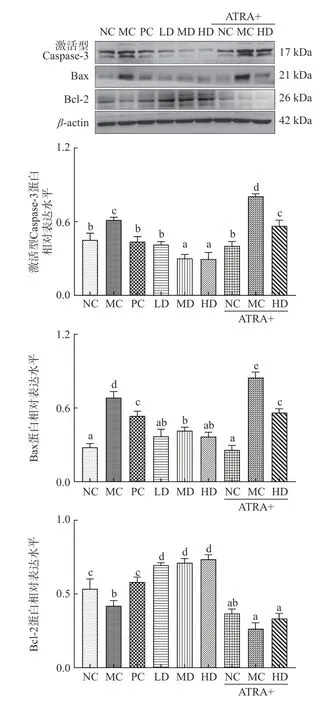
图4 AEPS 对铅暴露小鼠肝脏细胞凋亡的影响Fig.4 Effects of AEPS on apoptosis of the liver of leadexposed mice
2.8 AEPS 对铅暴露小鼠肝脏中MRP2 的影响
MRP2 在细胞中具有运输重金属的作用。如图5所示,与NC 组比较,铅显著促进了小鼠肝脏MRP2的表达(<0.05),提高了肝细胞对铅的耐受性。EDTA二钠钙对MRP2 表达没有产生影响。与MC 组相比,AEPS 剂量组小鼠肝脏MRP2 水平显著提高(<0.05)。ATRA+NC 组与NC 组MRP2 水平没有显著差异(>0.05)。ATRA+MC 组MRP2 水平显著低于MC 组(<0.05)。与HD 组比,ATRA+HD 组MRP2 水平显著降低(<0.05),表明腹腔注射ATRA后,AEPS 不能促进小鼠肝脏MRP2 的表达。因此,AEPS 可能通过Nrf2 信号通路影响铅暴露小鼠肝脏MRP2 表达。

图5 AEPS 对铅暴露小鼠肝脏MRP2 蛋白表达的影响Fig.5 Effect of AEPS on MRP2 protein expression of the liver of lead-exposed mice
3 讨论
铅是一种弱氧化剂,能诱发肝脏氧化应激。MDA是脂质过氧化产物,当肝脏发生氧化应激时伴随脂质过氧化的发生,因此MDA 能反映肝脏受氧化应激侵害的严重程度,MDA 含量越高,表示肝脏受到越严重的氧化损伤。CAT 和SOD 活性直接反映体内减少自由基和抵御氧化应激的能力。铅抑制CAT 和SOD 等抗氧化酶的活性,进而抑制抗氧化系统,同时促进MDA 的产生,最终诱发氧化应激。试验结果表明,铅暴露后小鼠肝脏MDA 水平显著升高(<0.05),SOD 和CAT 活性被抑制。试验结果也表明AEPS 能显著提高小鼠肝脏CAT 和SOD 活性,降低MDA 含量,提高了铅暴露小鼠肝脏抗氧化活性并抑制脂质过氧化。与EDTA 二钠钙相比较,AEPS提高CAT 活性的效果更好。
细胞凋亡过程是由Caspase 家族和Bcl-2 家族等其他家族蛋白参与的细胞程序性死亡过程,细胞凋亡的异常会引发多种疾病。Bcl-2 和Bax 是Bcl-2家族中具有相反作用的两种蛋白,Bcl-2 抑制细胞凋亡,Bax 促进细胞凋亡。Bcl-2 的减少和Bax 的增加导致线粒体膜通透性增加,使线粒体中的细胞色素C、Smac 等凋亡相关因子进入细胞质,活化细胞质中的凋亡启动因子(如Caspase-2、Caspase-9 和Caspase-10)并激活凋亡执行因子(如Caspase-3、Caspase-6 和Caspase-7),最终发生细胞凋亡。其中激活型Caspase-3 的激活代表着凋亡已经进入了不可逆转的阶段。本试验结果说明灌胃AEPS 减少铅暴露小鼠肝细胞中促凋亡蛋白Bax 蛋白表达水平,增加抑凋亡蛋白Bcl-2 蛋白表达水平,进而减小线粒体膜通透性,抑制凋亡相关因子与激活型Caspase-3 的结合,降低激活型Caspase-3 蛋白的表达,最终抑制肝细胞凋亡。
AST、ALT 和LDH 是检查肝功能的重要指标。正常情况下,血清中的AST、ALT 和LDH 活性较低,一旦肝脏受损,肝细胞膜通透性增加使它们释放到血液中,血清中AST、ALT 和LDH 活性增加。本试验中,MC 组小鼠血清中AST、ALT 和LDH 活性明显增强,说明肝脏已经明显受损。这与肝脏组织病理学切片的观察结果一致,铅引起细胞排列紊乱、肝细胞质疏松变性等异常变化。灌胃AEPS 后,血清中AST、ALT 和LDH 活性均显著降低(<0.05),并且肝脏病理学切片中也显示出AEPS 具有减轻肝脏损伤的作用。以上结果表明,AEPS 能保护铅暴露小鼠肝脏组织。
MRP2 是多药耐药相关蛋白家族发现的第二个成员,依靠ATP 水解的能量跨膜输出内外源性有毒物质。MRP2 在很多组织中都有分布,尤其是在肝脏组织中,参与了肝细胞有毒物质的排出。MRP2 的表达水平受Nrf2 信号通路的影响。GSH 是含有丰富巯基的三肽,与某些药物或毒物(如重金属)等通过巯基结合,从而发挥解毒作用。大量研究表明,GSH 与重金属化合物形成的共轭复合物可以被MRP2转运出细胞,实现解毒作用。此外,GST 存在于哺乳动物的很多组织中,催化内源性和外源性毒物与GSH 结合,在体内解毒功能上起到重要的作用。因此,GSH、GST 和MRP2 共同参与了细胞重金属的流出。试验结果发现,AEPS 显著增加了铅暴露小鼠肝脏MRP2 蛋白水平(<0.05),并升高肝脏GSH 含量和GST 活性,减少铅在小鼠肝脏的累积。
Nrf2 信号通路是机体应对外源性刺激的防御机制之一,能有效抵御氧化应激,保护机体免受外源性毒物的伤害。正常生理状态下,Nrf2 在细胞浆中与Kelch 样环氧氯丙烷相关蛋白1(Kelch-like ECH-associated protein 1,Keap1)结合,被不断泛素化降解。发生氧化应激时,Nrf2 脱离Keap1,向细胞核转移。在细胞核内,Nrf2 结合抗氧化反应元件(Antioxidant-Response Element,ARE),促进下游抗氧化酶基因和MRPs 家族基因的转录,以此提高机体抗氧化和解毒能力,防止机体氧化损伤。研究发现,Nrf2 信号通路的激活能缓解铅毒性引起的损伤。试验结果表明,AEPS 促进Nrf2 转移进入细胞核,激活了Nrf2 信号通路,肝脏的病理损伤也得到了改善。ATRA 是一种Nrf2 特异性抑制剂,通过影响Nrf2 向细胞核转移抑制Nrf2 信号通路的激活。试验结果表明AEPS 促进Nrf2 核移位作用被ATRA 抑制,导致AEPS 不能通过Nrf2 信号通路保护铅暴露小鼠肝脏组织。除此之外,AEPS 的抗氧化、抗凋亡、减少肝脏铅积累和减轻肝脏铅损伤作用都受到ATRA 抑制,说明AEPS 对铅暴露小鼠肝脏的保护作用与Nrf2 信号通路相关。
4 结论
AEPS 提高了铅暴露小鼠肝脏的抗氧化酶活性,缓解了铅诱导的肝脏损伤和肝细胞凋亡,提高了GSH 含量和GST 活性,增强了肝脏MRP2 输出铅的能力,减少了肝脏铅积累。这些作用都与AEPS能促进Nrf2 核移位有关,即AEPS 对铅暴露小鼠肝脏的保护作用依赖于Nrf2 信号通路。因此,AEPS可以作为一种能改善器官铅损伤并能减少器官铅积累的功能性食品添加剂。
