人肠道来源霍氏肠杆菌4-2-1 的分离及其对枸杞多糖的发酵作用
2022-10-11王艳萍方海田胡海明殷明珠刘洪涛
王艳萍,方海田, ,胡海明,殷明珠,刘洪涛
(1.宁夏大学食品与葡萄酒学院,宁夏食品微生物应用技术与安全控制重点实验室,宁夏银川 750021;2.湖北中医药大学基础医学院,湖北武汉 430065)
宁夏枸杞(L.)别名茄果,枸杞子,是我国备受喜爱的药食同源食物,其中含有多种活性成分,主要包括多糖、多酚、类胡萝卜素、萜烯类、有机酸以及多种微量元素。而多糖又是枸杞中最主要的活性成分之一,在免疫调节、抗氧化、抗疲劳、护肝等方面贡献颇大。枸杞多糖与疾病的相互作用已成为关注的热点。有研究表明,枸杞多糖不仅可以维持肠道微生物群的平衡,改善非酒精性肝病,而且能够调节肠道菌群,减少压力因素对后代情绪伤害的影响。
人体肠道是一个大型的发酵、消化场所。其中人体肠道菌群组成复杂、数量巨大,包括拟杆菌属、肠杆菌属、芽孢杆菌属等。霍氏肠杆菌属于肠杆菌科,是存在与人和动物肠道内的正常菌株之一,现在国内对霍氏肠杆菌的研究较少,汪芳芳发现优化霍氏肠杆菌A20 培养条件之后,叶黄素的降解率提高了20%左右,增加了叶黄素的商业价值,同时霍氏肠杆菌WM1 可以发酵碳水化合物产生青霉素酶,并在检测牛奶中青霉素的残留发挥一定作用。而人肠道菌群也不是固定不变的,与很多因素都有密切关系,比如年龄、环境、性别、饮食等多种因素,其中饮食被认为是改变肠道菌群最直接、最有效的方法之一。有研究表明,碳水化合物是人类饮食的主要成分,但其中的植物多糖不能被口腔、胃液吸收,只有被分解成小分子物质才能达到其益生元作用,而肠道微生物能够定植在远端肠道分解复杂碳水化合物,Fu 等人对鼠尾藻多糖的体外发酵研究中发现,鼠尾藻多糖只有被结肠微生物发酵后才能对人体发挥作用,亚麻籽多糖在被人类粪便微生物水解利用后才能有助于成为促进结肠的益生元。枸杞多糖是一种水溶性多糖,为含有多种微量元素和氨基酸的蛋白多糖,具有重要生理活性。而目前对枸杞多糖的发酵作用大多研究主要集中在粪便菌群的发酵上,对单菌和枸杞多糖之间的作用了解甚少。因此明确对枸杞多糖发挥作用的肠道单菌具有重要意义。
本研究从为了阐明肠道细菌在人体吸收枸杞多糖过程中的作用,通过形态学观察,生理生化实验以及16S rRNA 基因对其进行鉴定,筛选出一株肠道单菌株,最后将该单菌应用到枸杞多糖发酵中,通过对枸杞多糖发酵指标的研究,以揭示枸杞多糖在人体内的作用机制,为之后相关方面的研究提供一定的借鉴和参考。
1 材料与方法
1.1 材料与仪器
人体肠道粪便 联系3 位健康志愿者,要求志愿者无消化系统疾病,3 个月内未服用抗生素或益生菌;枸杞,购自宁夏银川市中宁;枸杞多糖 由本实验室制备得到。细菌基因组DNA 提取试剂盒 北京索莱宝科技有限公司;苯酚、浓硫酸 国药集团化学试剂有限公司,琼脂糖 北京擎科生物科技有限公司。
BXM-30R 压力蒸汽灭菌器 上海博讯实业有限公司;超净工作台 北京东联哈尔仪器制造有限公司;V-5100 紫外分光光度计 上海精科实业有限公司;LRH-250 生化培养箱 广东省医疗器械厂;凝胶成像系统 Eppendorf 公司;梯度PCR 仪 Eppendorf公司;LB 培养基 青岛高科技工业园海生物技术有限公司;琼脂粉 北京索莱宝科技有限公司;Spectra-Max iD3 多功能酶标仪 美谷分子仪器上海有限公司;S210 pH 计 上海仪电科学仪器股份有限公司。
1.2 实验方法
1.2.1 培养基的配制 无碳源SM 液体培养基:氯化钾4.5 g/L、氯化钠4.5 g/L、碳酸氢钠1.5 g/L、磷酸二氢钾0.5 g/L、磷酸氢二钾0.5 g/L、硫酸镁0.4 g/L、氯化铵0.3 g/L、碱性微量元素(NaSeO0.087 g/L,NaWO0.165 g/L,NaMoO0.121 g/L,NaOH 2 g/L)1 mL/L、酸性微量元素(FeClZnCl、CuCl、HCl)1 mL/L,高温高压115 ℃灭菌15 min 后,按照500:1的比例加入CaCl母液,按照1000:1 的比例加入维生素溶液(维生素B、维生素B、维生素B、维生素B),配制固体培养基所需琼脂粉为20 g/L。
1.2.2 人粪便样品预处理 称取一定质量新鲜人类粪便,在超净工作台中加入无菌PBS 进行涡旋,500 r/min 离心5 min,吸上清至灭完菌的离心管中,再加入无菌PBS 旋涡,500 r/min 离心5 min,再次吸上清至灭完菌的Ep 管中,得到粪便悬液。粪便悬液一部分用于实验,剩余部分加入无菌厌氧甘油,分装,保存在-80 ℃,备用。
1.2.3 人体粪便中菌的富集 取一定量粪便悬液,500 r/min 离心5 min,弃去上清,用PBS 洗涤两次后,离心重悬,按照合适的体积比,接种至LB 液体培养基中,37 ℃摇床培养48 h。
1.2.4 肠道菌分离筛选 将1.2.3 富集的样品用PBS溶液进行稀释至10~10梯度,在LB 固体培养基中进行涂布,放置37 ℃恒温培养箱中进行培养24~36 h。挑选培养基中不同颜色、形状和大小的菌株至LB 液体培养基,37 ℃摇床培养18~24 h。将液体培养基中得到的菌株在LB 固体培养基中反复划线,已保证得到纯度较高的单菌,将上述得到的单菌落以50%甘油进行保菌,并保存于-80 ℃冰箱中。
1.2.5 菌株发酵能力的比较 将经过反复划线得到的两株单菌按照1:50 的比例加入含有枸杞多糖的SM 液体培养基中,放置在37 ℃摇床中摇床培养72 h,测量发酵液中多糖含量的变化。
1.2.6 菌株鉴定 将1.2.4 中得到对枸杞多糖发酵能力较好的菌株4-2-1 进行鉴定。根据《常见细菌系统鉴定手册》和《伯杰氏细菌系统分类学手册》对分离出的细菌进行细菌形态和生理生化鉴定。
采用16S rRNA 基因进行分子生物学鉴定,以4-2-1 菌株的基因组为模板进行PCR 扩增,正反向引物为8F:5'-AGAGTTTGATCCTGGCTCAG-3'/1492R:5'-GGTTACCTTGTTACGACTT-3'。PCR 反应体系(50 μL)为:模板DNA 1 μL,KOD 酶1 μL,10×KOD buffer 5 μL,dNTP(2 mmol/L)5 μL,引物(F+R)3 μL,MgSO(25 mmol/L)3 μL,ddHO 22 μL。PCR 扩增参数设置为:94 ℃预变性2 min,98 ℃变性10 s,55 ℃退火30 s,68 ℃延将。得到的PCR 扩增产物进行1%(质量分数)琼脂糖凝胶电泳。确认聚合酶反应扩增片段,若PCR 扩增产物在1500 bp 左右,则可送至上海生工进行测序,将该16S rDNA 序列递交NCBI进行BLAST 同源序列检索,比较筛出菌株与已知菌株的系统发育关系和系统地位,如果同源性大于99%,则确认为同一类细菌,借助Mega X 软件建立系统发育树。
1.2.7 霍氏肠杆菌4-2-1 对枸杞多糖发酵的影响将枸杞多糖(2 mg/mL)加入无碳源的SM 固体培养基中,使得枸杞多糖成为培养基中的唯一碳源,放置37 ℃恒温培养箱中对菌株4-2-1 培养至有明显菌落。并接种至含枸杞多糖的无碳源SM 液体培养基中,放置37 ℃摇床中培养18 h,培养后吸取1 mL 的菌液,的以3000 r/min 进行离心3 min,收集菌体并用PBS 稀释至1 mL,按照1:50 的比例将霍氏肠杆菌接种至以枸杞多糖为唯一碳源的SM 液体培养基中进行摇床培养,动态监测发酵过程中细菌生长含量(OD)、pH 的变化、多糖含量、还原糖含量以及分子量变化。
1.2.7.1 发酵过程中菌株生长曲线测定 将菌株按照1:50 的比例加入含有枸杞多糖为唯一碳源的SM液体培养基中,放置在37 ℃摇床中摇床培养,分别在0、6、12、24、48 h 取样,用紫外分光光度计测每个时间点的OD,实验在相同条件下重复三次。
1.2.7.2 发酵过程中pH 测定 将菌株加入含有枸杞多糖为唯一碳源的的SM 液体培养基中,放置在37 ℃摇床中摇床培养,分别在0、6、12、24、48 h 取样,用pH 计测每个时间点的pH,以按照1:50 的比例接种霍氏肠杆菌4-2-1 的SM 液体培养基作为对照组,实验在相同条件下重复三次。
1.2.7.3 发酵过程中多糖含量测定 硫酸-苯酚法测定发酵液中多糖含量,参考Masuko 等方法略作修改。取各个时间段的发酵液,13000 r/min 离心3 min,取上清,分别吸取0.3 mL 不同时间点发酵样品溶液和葡萄糖标准溶液加入0.2 mL 的6%苯酚溶液,震荡摇匀后迅速加入1 mL 浓硫酸,摇匀加塞后置于沸水浴放置20 min,取出后用凉水冷却10 min;用酶标仪进行测定,在波长为490 nm 处测定吸光度,以葡萄糖浓度X 为横坐标(μg/mL),OD为纵坐标,绘制标准曲线,并根据标准曲线Y=0.02200X+0.04749,=0.9997 计算样品中总碳水化合物含量。
1.2.7.4 发酵中还原糖含量测定 采用二硝基水杨酸(DNS)法测定发酵液中还原糖,参照牟佳红等方法略作修改。分别吸取0.4 mL 不同时间点发酵样品溶液和葡萄糖标准溶液,加入DNS 试剂0.8 mL,摇匀后置于恒温混匀仪100 ℃加热5 min,取出后置于冰水混合物中冷却至室温,用酶标仪进行测定,在波长为540 nm 处测定吸光度,以葡萄糖浓度X 为横坐标(mg/mL),D为纵坐标,绘制标准曲线,并根据标准曲线Y=1.54300X+0.04671,=0.9991 计算样品还原糖含量含量。
1.2.7.5 发酵过程中多糖分子量测定 分子量的测定参照唐雨薇方法略作修改。发酵产物使用80%的乙醇进行4 ℃过夜沉淀,并用0.22 μm 滤膜过滤。采用Wasters-2424 蒸发光检测器测定多糖的分子量,检测条件:色谱柱:GE 水溶性凝胶柱(7.8 mm×300 mm);柱温:30 ℃;流速:0.6 mL/min;流动相:纯化水;雾化器模式:加热(90%功率,36 ℃);载气:N;气流压力:0.28 MPa;柱温:30 ℃;进样量:10 μL。
1.3 数据处理
实验均重复三次取平均值,实验结果均用平均值±标准差来表示,采用Mega X 软件建立系统发育树,用统计学分析软件SPSS 进行显著性分析,Excel 2019 进行数据统计并分析,由Graph Pad Prism 8 软件进行实验数据作图。
2 结果与分析
2.1 发酵能力较优菌株的筛选
通过反复划线可得纯度较高的两株细菌,将菌株3-2-1 和菌株4-2-1 接种至含枸杞多糖的无碳源SM 液体培养基中进行培养,测定培养基中多糖含量的变化,无碳源SM 培养基作为对照组。由图1 可知,发酵72 h 后,与对照组相比,两个发酵组多糖含量明显降低,说明这两株菌均可以利用枸杞多糖,并且菌株4-2-1 的发酵能力强于3-2-1,因此选择发酵能力较优菌株4-2-1 进行后续实验。
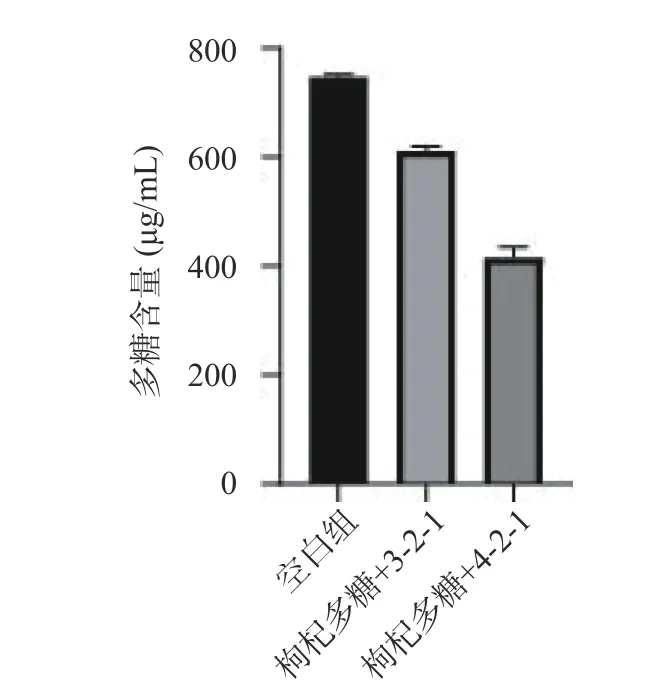
图1 菌株筛选过程中多糖含量的变化Fig.1 Changes in polysaccharide content during strain screening
2.2 人肠道菌株的鉴定
2.2.1 形态学鉴定 采用三区划线法将4-2-1 在LB 固体培养基上划线。通过对4-2-1 菌株形态学观察,发现菌株4-2-1 在LB 培养基平板上生长情况如图2,圆形,边缘透明,中间呈乳白色,有光泽,略隆起,边缘整齐;对4-2-1 菌株进行革兰氏染色后发现,该菌周身鞭毛运动,无芽孢,无夹膜,通过革兰氏染色初步判定4-2-1 为革兰氏阴性菌,在显微镜下成杆状。
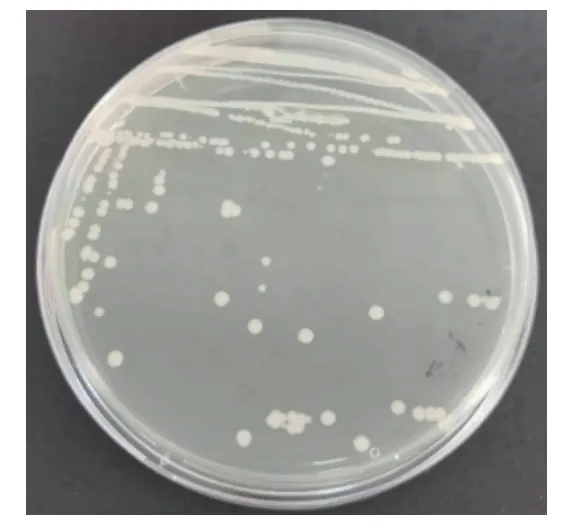
图2 菌株4-2-1 的形态学特征Fig.2 Morphologic characteristics of strain 4-2-1
2.2.2 16S rRNA 扩增结果 利用引物对所提取的基因组DNA 进行扩增,所扩增的结果如图3 所示,在1500 bp 左右出现了目的条带,条带整齐,表明PCR 产物可用于测序分析。

图3 1%琼脂凝胶电泳图Fig.3 Agarose gel electrophoresis diadram
2.2.3 4-2-1 系统进化树分析 用Snap Gene Viewer软件对4-2-1 测序序列进行拼接,借助NCBI 中的BLAST 和数据库中已知菌株的16S rRNA 基因进行序列比对,用相似度最高的菌株来确定4-2-1 的种属状况。结果表明,菌4-2-1 的16S rRNA 基因序列与数据库中已知霍氏肠杆菌的16S rRNA 基因的相似性大于99%。为了进一步明确该菌株与已知菌株的亲缘关系及分类地位,构建系统发育树,结果显示该菌株与KK736258.1 在系统发育树聚为一支,系统发育树如图4 所示。

图4 菌株4-2-1 的16S rRNA 基因序列系统发育树Fig.4 Phylogenetic tree of Enterobacter 16S rRNA gene sequence of strain 4-2-1
2.3 对枸杞多糖发酵的影响
2.3.1 发酵筛选及菌株生长特性 OD可以用来描述霍氏肠杆菌4-2-1 在含有枸杞多糖的培养基中的生长特性。而从图5 可以发现,霍氏肠杆菌4-2-1 在36 h 后基本进入稳定期,在0~12 h 处于对数生长期,达到平台期时菌株的OD在0.15 左右。由此可知,霍氏肠杆菌4-2-1 可以在含枸杞多糖的培养基中很好的生长,并且存活率较高,所测结果和岳喜庆等筛选出霍氏肠杆菌的生长趋势相似。

图5 发酵液中菌株生长情况Fig.5 Growth of strains in fermentation broth
由上可知,细菌总量增长,说明霍氏肠杆菌4-2-1 能在含枸杞多糖的唯一碳源培养基中生长。
2.3.2 霍氏肠杆菌4-2-1 发酵枸杞多糖过程中pH、多糖含量、还原糖含量的变化 在发酵过程中,检测多糖含量、还原糖含量和pH 的动态变化。如图6(a)所示,多糖的初始含量在682 μg/mL 左右,此后,在12 h 的发酵期间内,多糖含量逐渐降低,逐渐趋于稳定,剩余多糖含量在205.7 μg/mL 左右,之前也有研究表明,多糖含量的变化与粪便微生物的作用息息相关。同样的,还原糖也由刚开始的最高含量逐渐降低,直到24 h(图6(b))。通过发酵后多糖和还原糖的分解程度,说明霍氏肠杆菌4-2-1 可在枸杞多糖作为唯一碳源的培养基上进行生长。
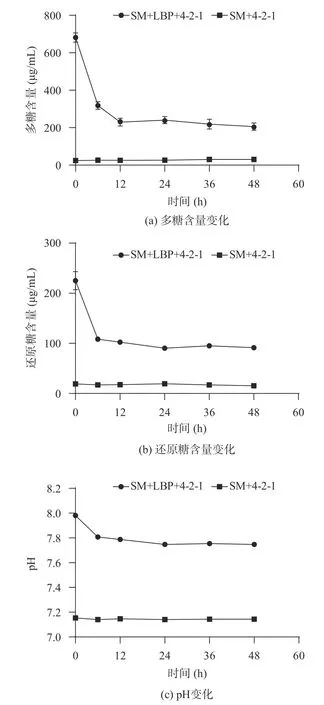
图6 发酵过程中不同时间点的特征指标测定Fig.6 Measurement of indicators at different time points
多糖在肠道里可以被肠道菌选择利用,引起pH的变化,因此,pH 是反应发酵过程的一个重要指标。如图6(c)所示,发酵12 h 后,发酵组的pH 从7.98 降至7.79,在24 h 发酵结束时,降低至7.75 并保持稳定。然而在整个发酵过程中,对照组的pH 保持不变,和之前的荔枝多糖作为益生元的研究相似。表明枸杞多糖可被肠道菌霍氏肠杆菌4-2-1 发酵利用,引起培养基相应pH 的变化,并可能产生相应的有机酸。
2.3.3 霍氏肠杆菌4-2-1 发酵枸杞多糖过程中枸杞多糖分子量变化 对发酵后枸杞多糖的分子量进行检测,结果如图7。在发酵的过程中,枸杞多糖的含量随着霍氏肠杆菌的发酵时间推移而降低,分子量也从8.02 kDa 变为3.44 kDa,表明枸杞多糖在霍氏肠杆菌的发酵下被分解,由此可以推测,霍氏肠杆菌对于枸杞多糖在人体肠道的消化吸收发挥着重要的作用。

图7 不同时间点枸杞多糖分子量测定Fig.7 Determination of molecular weight of Lycium barbarum polysaccharide at different time points
3 结论
多糖经微生物发酵后可以被人体利用并发挥有益作用。因此研究对枸杞多糖的发酵是了解枸杞多糖在体内作用的重要部分。本研究从人体粪便样品中分离出一株对枸杞多糖具有很好发酵作用的霍氏肠杆菌4-2-1,检测培养基中细菌生长曲线、pH 变化、多糖含量、还原糖含量和分子量变化。结果发现,该菌为革兰氏阴性菌霍氏肠杆菌,能在以枸杞多糖为碳源的培养基中进行生长,且随着发酵的进行,细菌数量显著增加,导致发酵体系内pH 由7.98 变化至7.79,多糖含量、还原糖含量和多糖分子量发生变化,分别降低了30.2%、40.6%和42.9%,说明从人肠道粪便样品中分离的霍氏肠杆菌4-2-1 能对枸杞多糖进行发酵。综上,人肠道来源的霍氏肠杆菌4-2-1 可发酵枸杞多糖,这可能部分解释了枸杞多糖作为益生元对机体健康的改善作用,为多糖的生理活性进一步提供依据,但详细的机制还需要进一步研究。
