三种非酿酒酵母对贵人香白葡萄酒发酵进程及挥发性组分的影响
2022-10-11周洪江姜文广阮仕立李记明
周洪江,姜文广,阮仕立,李记明
(烟台张裕集团有限公司,山东省葡萄酒微生物发酵技术重点实验室,山东烟台 264001)
香气是决定葡萄酒品质的重要指标,是上百种挥发性化合物相互作用的结果,也是吸引消费者和增强市场竞争力的重要因素。在葡萄酒酿造中,接种商业化酿酒酵母并使其主导完成酒精发酵是常规操作,这是基于酿酒酵母()的若干优良酿造特性,如发酵完全、酒精产率高、发酵可重复性强、抑制杂菌生长等,但是只接种商业化酿酒酵母带来的共性问题是产品风格单一、缺乏典型性。将非酿酒酵母与酿酒酵母联合使用,发挥每种酵母的酿造特性和优势,形成对酒体的提升是解决以上问题的有效方法。
非酿酒酵母是一类自然存在于浆果、果梗表面、果园土壤或酿酒环境中可参与葡萄酒发酵的微生物,在发酵过程中会产生甘油、酯类、高级醇、萜类化合物等代谢产物,并且能够分泌糖苷酶、脂肪酶、蛋白酶等多种酶类,通过酶的活性反应将果实中的香气前体物质分解并释放出香气组分,从而影响葡萄酒的香气、风味和复杂性。随着研究者对非酿酒酵母的深入研究,非酿酒酵母的潜在应用价值受到越来越多的关注。目前葡萄酒酿造领域研究较多的非酿酒酵母主要有孢圆酵母属()、有孢汉逊酵母属()、假丝酵母属()、毕赤酵母属()、美奇酵母属()、克鲁维酵母属()等,它们以不同的代谢机制影响着果酒的风味。Azzolini 等发现和酿酒酵母混合发酵能够增加芳香醇类和酯类的合成量,明显提升葡萄酒的香气和复杂性,以及缓和葡萄酒的发酵进程。Whitener 等证实某些特定的戴尔有孢圆菌株可生成高浓度的萜烯化合物,如-萜品醇、芳樟醇、香叶醇等,从而提高葡萄酒的品种香气。Hranilovic 等研究发现美极梅氏酵母()与酿酒酵母顺序接种发酵葡萄酒时,能够促进三羧酸循环代谢产物的合成,如富马酸、琥珀酸、甘油等,同时增加多种乙酸酯、高级醇等挥发性组分的产量。Ciani 等发现耐热克鲁维酵母()与酿酒酵母实施混合发酵时可以改善影响葡萄酒品质和感官质量,如增加萜烯、异丁酸等芳香化合物,限制乙酸、乙醛等物质的合成,还能提高甘油、葡萄花色苷和多糖的含量。但是非酿酒酵母目前在红葡萄酒酿造中研究及应用较多,白葡萄酒中涉及较少,急需开展相关研究。
挥发性组分的测定利用气相色谱-离子迁移谱(Gas chromatography-ion mobility spectrometry,GCIMS)技术完成,这是近年出现的检测风味化合物的新手段。GC-IMS 的分析原理是样品经气相色谱分离后,先经IMS 离子源进行离子化然后进入漂移区,根据在漂移区的迁移速率不同,不同物质按照先后顺序到达检测器,从而被检测。相较于气相色谱,该技术具有灵敏度高、检测速度快、检测限低、样品无需复杂预处理、可用于现场快速检测等优势。本研究以在烟台种植的“贵人香”葡萄为酿造原料,测试三种商业化非酿酒酵母,即戴尔有孢圆酵母()、美极梅奇酵母()和耐热克鲁维酵母()与酿酒酵母混合发酵对白葡萄酒的理化指标、挥发性组分和感官品质的影响,以酿酒酵母单独发酵的白葡萄酒为对照,分析比较三种非酿酒酵母间的区别,及其对解决白葡萄酒香气淡、风格典型性不突出问题的贡献,以期为在白葡萄酒中酿造应用提供参考。
1 材料与方法
1.1 材料与仪器
贵人香 酿造葡萄品种,采自烟台莱州,2019 年9 月完成成熟采摘。果实理化指标:总糖189 g/L,总酸6.1 g/L(以酒石酸计),pH3.51;酿酒酵母Lalvin D21、美极梅奇酵母Flavia®MP346 加拿大Lallemand 公司;戴尔有孢圆酵母Prelude、耐热克鲁维酵母Concerto丹麦科汉森公司;n-酮C4~C9色谱纯,国药化学试剂北京有限公司;葡萄糖、酵母粉、琼脂等培养基成分 分析纯,国药化学试剂北京有限公司。
FlavourSpec® GC-IMS 联用仪(配有CTC 自动顶空进样器、Laboratory Analytical Viewer(LAV)分析软件及Library Search 定性软件的GC-IMS 系统)德国G.A.S 公司;20 mL 顶空进样瓶 宁波哈迈仪器科技有限公司;酸度计FE28 梅特勒集团。
1.2 实验方法
1.2.1 培养基的配制 WL 营养培养基(1 L):葡萄糖50 g,酵母粉5 g,胰蛋白胨5 g,磷酸二氢钾550 mg,氯化钙125 mg,氯化铁2.5 mg,氯化钾425 mg,硫酸锰2.5 mg,硫酸镁125 mg,溴甲酚绿22 mg,琼脂20 g,pH6.5,121 ℃灭菌20 min。
赖氨酸琼脂培养基(1 L):D-葡萄糖10 g,DL-蛋氨酸2 mg,DL-色氨酸2 mg,L-组氨酸1 mg,对氨基苯甲酸200 μg,泛酸2 mg,生物素20 μg,叶酸2 μg,烟酸400 μg,盐酸吡哆醇400 μg,核黄素200 μg,盐酸硫胺素400 μg,肌醇10 mg,硼酸500 μg,碘化钾100 μg,氯化铜40 μg,氯化铁200 μg,钼酸钠200 μg,硫酸锌400 μg,硫酸锰400 μg,磷酸氢二钾150 mg,磷酸二氢钾850 mg,氯化钙100 mg,硫酸镁500 mg,赖氨酸盐酸盐2.5 g,氯化钠100 mg,琼脂20 g,pH自然,121 ℃灭菌20 min。
1.2.2 白葡萄酒发酵 将新鲜葡萄破碎挤压出葡萄汁入发酵罐中,加入SO并使其浓度达到50 mg/L,再加入30 mg/L 的果胶酶于5 ℃下反应12 h,分离出上清液。添加适量蔗糖,使还原糖浓度达到210 g/L。将经过上述处理的葡萄汁等分为8 份,6 份用于非酿酒酵母/酿酒酵母混合发酵,2 份为酿酒酵母单独发酵,即每组发酵酒样均有2 组平行样品。
每份葡萄汁倒入20 L 小型发酵罐中,进行葡萄酒发酵实验。所有酵母在使用前均需要进行充分活化,即将酵母置于20%蔗糖水溶液中,30 ℃下轻轻搅拌至酵母产生丰富气泡,而后直接接种于葡萄酒中。为便于区分四种发酵葡萄酒,对其进行代码命名。将接种美极梅奇酵母Flavia®MP346、戴尔有孢圆酵母 Prelude和耐热克鲁维酵母Concerto的混合发酵葡萄酒分别用M1、M2、M3 表示,酿酒酵母Lalvin D21 单独发酵的葡萄酒用M4 表示。
M1、M2、M3 中先分别上述接种商业化非酿酒酵母,接种量为250 mg/L,24 h 后接种酿酒酵母Lalvin D21,接种量为300 mg/L。20 ℃恒温发酵,并监测白葡萄酒中的酵母增殖情况和还原糖浓度变化情况,直至还原糖浓度小于4 g/L。M4 中酿酒酵母的接入量为250 mg/L,其它处理与以上三种样品完全相同。上述样品中酵母增殖情况通过检测酵母的活细胞数进行表征,测定方法见1.2.3;还原糖浓度测定方法见1.2.4。
发酵结束后将SO加入到酒样品中,使游离SO浓度达到30 mg/L,所有样品均保存于4 ℃冰箱中,待后续完成理化指标以及挥发性香气组分测定。
1.2.3 酵母活细胞数的测定方法 WL 鉴别培养基和赖氨酸琼脂培养基分别应用于酿酒酵母和非酿酒酵母的菌落计数,并采用梯度稀释法对它们在发酵过程中的增殖情况进行培养和计数。取5 mL 酒样,用无菌生理盐水梯度稀释后(稀释倍数为10~10),涂布于WL 营养培养基,在28 ℃好氧条件下培养48 h后统计酿酒酵母的数目。相同的酒样经无菌生理盐水梯度稀释后,涂布于赖氨酸培养基,在28 ℃好氧条件下培养72 h 后统计非酿酒酵母的数量。菌体量的表示方法为CFU/mL。
1.2.4 理化指标测定 酒精度、总糖、总酸、挥发酸的测定方法参照《葡萄酒、果酒通用分析方法》(GB/T 15038-2006)执行。其中:酒精度采用密度瓶法;总糖采用斐林氏剂滴定法测定,以葡萄糖计;挥发酸和总酸:采用氢氧化钠滴定法测定,分别以乙酸和酒石酸计。pH 采用酸度计测定。每个样品检测3 次。
1.2.5 挥发性组分分析 取1 mL 样品,放入20 mL顶空进样瓶中,保温孵化后经顶空进样,用气相离子迁移谱仪FlavourSpec®进行测试。每个样品分析3 次。
顶空进样条件:顶空孵化于60 ℃,孵化10 min;振荡加热;顶空进样针温度为65 ℃;进样量为100 μL,不分流模式。
GC 条件:载气为高纯氮气(纯度≥99.999%),流速设定为2 mL/min,保持2 min,8 min 上升至30 mL/min,10 min 第二次上升至150 mL/min,保持150 mL/min,持续10 min。
IMS 条件:漂移管长度98 mm;漂移管温度45 ℃;管内线性电压5 kV/cm;漂移气为N(纯度≥99.999%),漂移气流速150 mL/min;放射源为3H;离子化模式为正离子。
1.2.6 香气感官质量评价 利用定量描述分析法对白葡萄酒进行香气感官质量分析,由15 位具有葡萄酒品评经验的品评者(6 名女性,9 名男性,年龄21~52 岁)组成感官评价小组。在正式品评之前,小组成员先接受葡萄酒描述性感官分析的培训,通过进行多次检验与讨论,品评小组确定了葡萄酒中主要的香气属性特征,包括果香、花香、植物香、蜂蜜、化学味及整体香气。品评实验在感官评价室进行,室温20 ℃,通风良好,无噪音,无任何气味。以3位数字随机编码12 份葡萄酒样品,平均分为2 组呈送给评价员。评价员按顺序闻香,并采取10 点制打分,0 表示无,9 表示特征性最强。0.0~3.0:香气属性微弱;3.1~6.0:香气属性强度适中,与其它属性平衡;6.1~9.0:呈现典型的、浓郁的属性香气,且与其它属性协调。
1.3 数据处理
样品中挥发性组分的鉴定通过GC-IMS 联用仪自带分析软件LAV(Laboratory Analytical Viewer)、定性软件GC×IMS Library Search(内置NIST2014、IMS 数据库)完成。运用LAV 中插件Reporter 进行样品GC-IMS 谱图对比,用插件Gallery Plot 进行GCIMS 指纹图谱的对比。
采用设备自带的Laboratory Analytical Viewer(LAV)分析软件及Library Search 定性软件对葡萄酒的风味物质成分进行分析,以n-酮C4~C9 为外标参照物,通过插值法计算迁移时间与保留指数(RI)的对应关系,获得RI 值,并利用软件内置的NIST 数据库和IMS 数据库对物质进行定性分析。
采用SPSS Statistics 21.0 软件对获取的葡萄酒样品的各指标数据做方差分析(ANOVA)和显著性差异(<0.05)分析。利用SPSS Statistics 21.0 软件中的主成分分析方法(PCA),对所得葡萄酒的香气成分指标进行降维处理,旋转方法采用最大方差法。
2 结果与分析
2.1 发酵过程跟踪情况
分别使用WL 鉴别培养基和赖氨酸琼脂培养基对酿酒酵母和非酿酒酵母细胞增殖情况进行培养和统计。酿酒酵母在赖氨酸培养基上不能生长,因而可以利用该培养基对非酿酒酵母的活细胞数进行统计;而两类酵母在WL 培养基上的菌落形态及颜色差异较大,因而可以利用WL 培养基对酿酒酵母的生长情况进行计数。
四种白葡萄酒发酵过程中的酵母细胞生长和还原糖消耗情况见图1。在混合发酵样品中,非酿酒酵母优先接种,从图1A、1B 和1C 中可以看出,美极梅奇酵母、戴尔有孢圆酵母和耐热克鲁维酵母均能较好地适应各自的发酵环境,在微氧条件下快速繁殖,细胞数量急剧增加。发酵24 h 后接种Lalvin D21,它能够耐受非酿酒酵母产生的竞争性抑制,自接种之初便维持较高的发酵速率。非酿酒酵母在与酿酒酵母共发酵的环境中表现不同,戴尔有孢圆酵母的活细胞数仍在稳步增加,耐热克鲁维酵母也能实现较好的生长,美极梅奇酵母却被明显抑制,活细胞数在混合发酵24 h 后开始下降。美极梅奇酵母、戴尔有孢圆酵母和耐热克鲁维酵母分别于第2、3 和3 d 达到峰值,活细胞数分别达到7.39、8.12 和7.40 lg(CFU/mL)。酿酒酵母在M1、M2、M3 三个混合发酵样品中达到生长峰值均在第4~5 d,活细胞数分别是8.17、7.68 和9.98 lg(CFU/mL)。随着发酵的进行,醪液中的糖分和营养素大部分被消耗掉,酵母开始衰老死亡,数量逐渐减少。所有混合发酵样品均在第8 d完成发酵。由图1D 可知,M4 酒样中的酿酒酵母D21 在接种 3 d 时活细胞数达到最高,之后菌体数量缓慢下降,并于第 7 d 完成发酵。综上,混合发酵较之M4 样品延长了1 d。此外,针对还原糖的消耗而言,在M1、M2 和M3 葡萄酒中,两种酵母从共存起始至发酵结束(第2~8 d),还原糖消耗速率分别是23.6、19.8 和21.9 g/(L·d),而对照样品(M4)中还原糖代谢速率为29.6 g/(L·d),说明酿酒酵母单独发酵时能够更快速的利用糖类促进自身的生长及乙醇的合成。
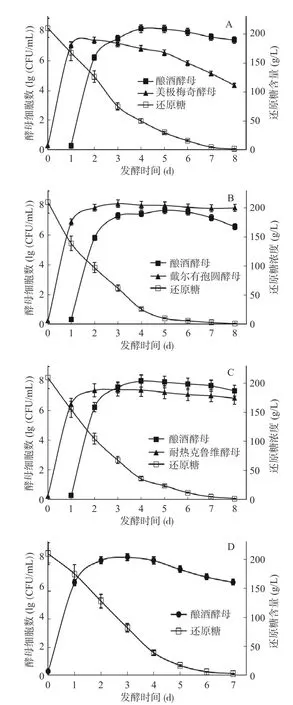
图1 白葡萄酒中酵母的增殖进程和还原糖代谢过程Fig.1 Growth kinetics of yeasts and sugar consumption in white wines.
2.2 白葡萄酒理化指标比较
发酵结束后对葡萄酒的理化指标进行检测,结果经均值化处理和标准差计算后见表1。所有样品的总糖含量都低于4 g/L,表明发酵比较充分,残糖含量较低,均为干型葡萄酒。酒精度在10.81%vol~11.58%vol 之间,M4 酒样最高,M1 最低。pH 在3.45~3.60 范围内,M1、M2 和M4 之间差异较小,M3 最低。总酸在5.52~6.37 g/L 之间,以M3 最高,证实了耐热克鲁维酵母具有产酸能力。挥发酸的浓度在0.19~0.38 g/L之间,M4 葡萄酒的该数值较高。
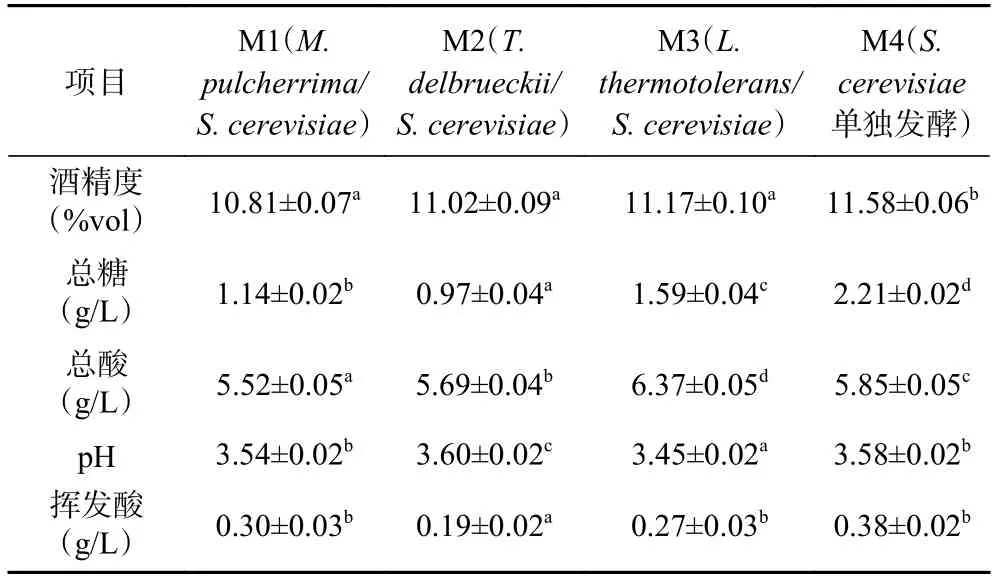
表1 不同发酵模式酿造贵人香白葡萄酒理化指标Table 1 Compositional profile of Italian Riesling white wines resulting from different fermentations
2.3 白葡萄酒挥发性组分的比较
发酵结束后,利用GC-IMS 对白葡萄酒的挥发性香气组分进行检测,结果以三维谱图(保留时间,迁移时间和峰强度)形式呈现。为了更直观地反映每种葡萄酒挥发性组分的差异,使用俯视图进行表示(图2),这是通过对离子迁移时间和反应离子峰(RIP)的归一化而获得的横坐标1.0 处的红色垂直线是反应离子峰(RIP)。每个RIP 代表一种风味化合物,颜色表示其信号强度。红色表示高浓度,白色表示低浓度,红色越深表示该挥发性组分的浓度越高。根据挥发性化合物气相色谱保留时间和离子迁移时间对葡萄酒挥发性香气化合物进行分析,共计鉴定出34 种挥发性化合物,包括酯类、醇类、醛类、酮类、酸类和萜烯类物质。每种化合物的检测结果经均值化处理和标准差计算后见表2。由表中数据可以看出,接种不同非酿酒酵母发酵葡萄酒的挥发性成分信号强度差异较大。此外,利用挥发性指纹图谱快速对比出不同葡萄酒样品风味物质之间的差异(图3),图中每一行代表一个葡萄酒挥发性组分的全部信号峰,每一列代表同一挥发性有机物在不同样品中的信号峰强度。从图中可以清晰看出每种葡萄酒的完整挥发性组分信息以及样品之间挥发性组分的差异。
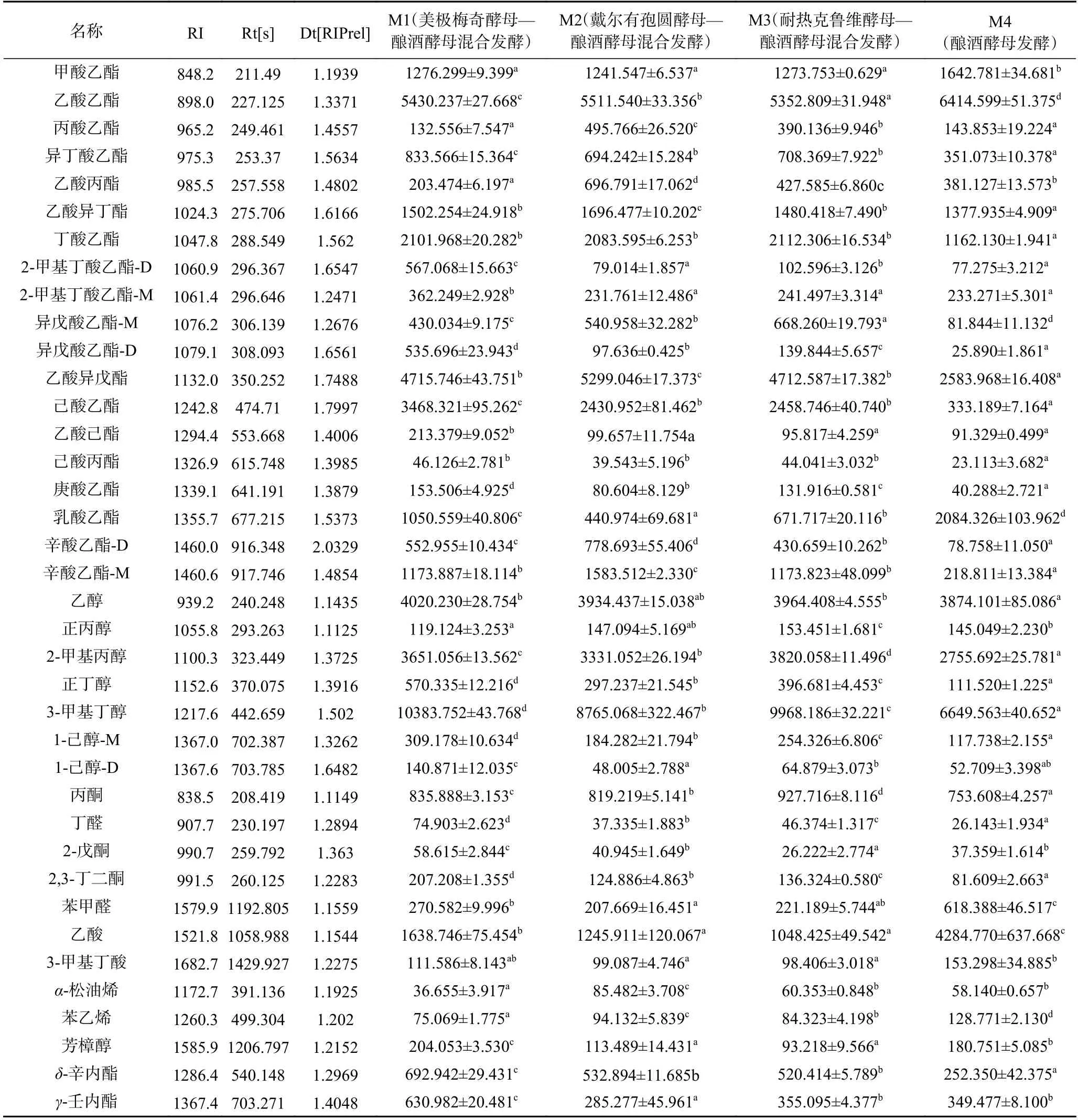
表2 不同发酵模式酿造贵人香白葡萄酒挥发性组分的信号强度Table 2 Signal intensities of volatile compounds detected in Italian Riesling white wine resulting from different fermentations by GC-IMS

图2 不同发酵模式酿造贵人香白葡萄酒中挥发性化合物的GC-IMS 图谱Fig.2 GC-IMS patterns of volatile compounds in Italian Riesling white wines resulting from different fermentations
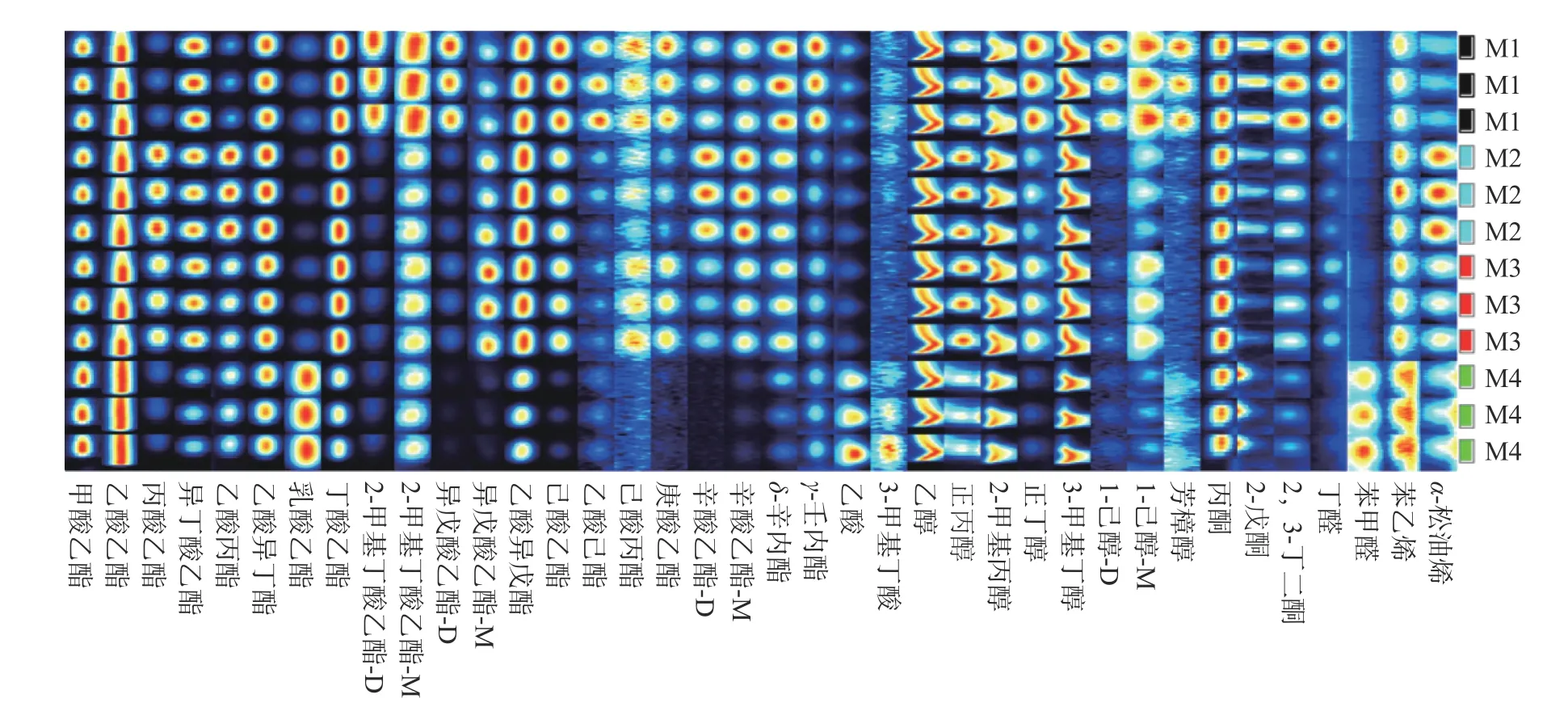
图3 混合发酵对贵人香白葡萄酒挥发性指纹图谱的影响Fig.3 Gallery plot of volatile fingerprints of Italian Riesling white wines resulting from combined fermentations.
2.3.1 酯类 酯类物质是贵人香白葡萄酒的最主要风味物质,对酒的整体香气具有重要贡献。本研究共检测到16 种酯类物质,信号强度最高的是乙酸乙酯、乙酸异戊酯和己酸乙酯。表2 结果显示,M4 的酯类信号总强度最低,而混合发酵则显著提高了多种挥发性酯类化合物的信号强度,包括异丁酸乙酯、乙酸异丁酯、异戊酸乙酯、己酸乙酯、己酸丙酯、庚酸乙酯和辛酸乙酯。以己酸乙酯为例,该物质能够散发出花香果香等气息,其在M4 中的强度为333.19,接种了三种商业化非酿酒酵母,即美极梅奇酵母、戴尔有孢圆酵母和耐热克鲁维酵母进行混合发酵后,该物质在M1、M2 和M3 的强度分别提升了9.4、7.3 和7.4 倍。就三种混合发酵的葡萄酒而言,M1 和M2酒样中的挥发性酯类总强度最高,M3 次之。丁酸乙酯、2-甲基丁酸乙酯和乙酸异戊酯能够释放类似草莓、香蕉、青苹果等果香香气,乙酸异丁酯呈花香,这些酯类化合物在M1 和M2 样品中的浓度较高,可能增强上述两种葡萄酒的果香或花香,提高其风味复杂性。
2.3.2 醇类 葡萄酒中的挥发性醇类化合物主要来源于发酵、氨基酸的转化及亚麻酸降解物的氧化。当酒中的高级醇质量浓度适中时,有助于提高葡萄酒的风味复杂性,但当其浓度过高时,就会对感官质量带来负面影响。贵人香白葡萄酒中共检测出6 种醇类物质,总强度最高的是M1,M3 次之,最低的是M4。M1 样品显著提升了正丁醇、3-甲基丁醇和正己醇和含量,其它两组混合发酵主要增加了丙醇和2-甲基丙醇的合成量。乙醇含量在各样品间的差异较小。
2.3.3 醛酮类 贵人香葡萄酒中还检测到了2 种醛类化合物(丁醛、苯甲醛)和3 种酮类(丙酮、2-戊酮、2,3-丁二酮)。苯甲醛具有苦杏仁气味,在M4 酒样中信号强度最高(618.388),分别是M1、M2 和M3样品的2.3、3.0 和2.8 倍。2-戊酮具有果香味,丁二酮散发黄油味,这两种酮类组分在M1 样品中信号强度最高,可能使得M1 风味更复杂。它们在M2 和M3 中含量差异较小,在M4 中浓度最低。
2.3.4 其它挥发组分 除挥发性酯类、醇类、醛类、酮类物质以外,白葡萄酒中还检测出2 种挥发酸类(乙酸、3-甲基丁酸)、3 种萜烯和杂环类物质(-松油烯、苯乙烯、芳樟醇)和2 种内酯类化合物(-辛内酯和-壬内酯)。乙酸是具有典型酸味的化合物,在M4 样品中信号强度最高(4284.770),分别是M1、M2和M3 样品的2.6、3.4 和4.1 倍。萜烯类和杂环类化合物会为葡萄酒带来一定程度的花香甜味和草木味,富含这类化合物可能会赋予葡萄酒更加丰富的香气风格。与酿酒酵母单独发酵相比,戴尔有孢圆酵母—酿酒酵母混合发酵提升了-松油烯的含量(M2样品),美极梅奇酵母—酿酒酵母混合发酵则增加了芳樟醇的合成量(M1 样品)。-松油烯和芳樟醇分别具有柠檬、铃兰气味,可能增强上述两种葡萄酒的果香或花香,增强其风味特征。
2.4 主成分分析
为了进一步了解混合发酵对白葡萄酒中香气成分的变化,对其进行主成分分析(PCA)。由图4 可得,PC1 和PC2 对总方差的解释率分别为52.3%和37.5%,该两个主成分对初始数据总方差的解释率为89.8%,能体现葡萄酒的香气成分信息。

图4 贵人香白葡萄酒PCA 分类结果及与香气组分的对应关系Fig.4 PCA score plots of Italian Riesling white wines resulting from different fermentations and corresponding loadings of volatile variables.
酒样M1 位于载荷图中的第一象限,并与PC1和PC2 正向端含量较高的相关变量有关,包括己酸乙酯、异丁酸乙酯、异戊酸乙酯、2-甲基丁酸乙酯、庚酸乙酯、乙酸己酯、-壬内酯、-辛内酯、己醇、丁醇、3-甲基丁醇、2-戊酮、2,3-丁二酮、芳樟醇。酒样M2 和M3 比较类似,分布在第四象限,与PC2 负向端含量较高的辛酸乙酯、乙酸丙酯、丙酸乙酯、-松油烯、丙酮、丙醇有关。M4 与其它酒样的香气成分含量差异较大,位于第三象限,与PC1 负向端含量较高的甲酸乙酯、乙酸乙酯、乳酸乙酯、乙酸、3-甲基丁酸、苯甲醛、苯乙烯有关。
2.5 香气感官质量分析
虽然采用HS-GC-IMS 对不同混合发酵模式的贵人香白葡萄酒挥发性成分进行了检测分析,但其结果不能完全体现出酒体的整体香气质量,因此由一个训练有素的15 人小组对酒体香气进行感官评估分析,评价样品的香气特征,包括果香、花香、植物香、蜂蜜、化学味及整体香气,结果如图5 所示。
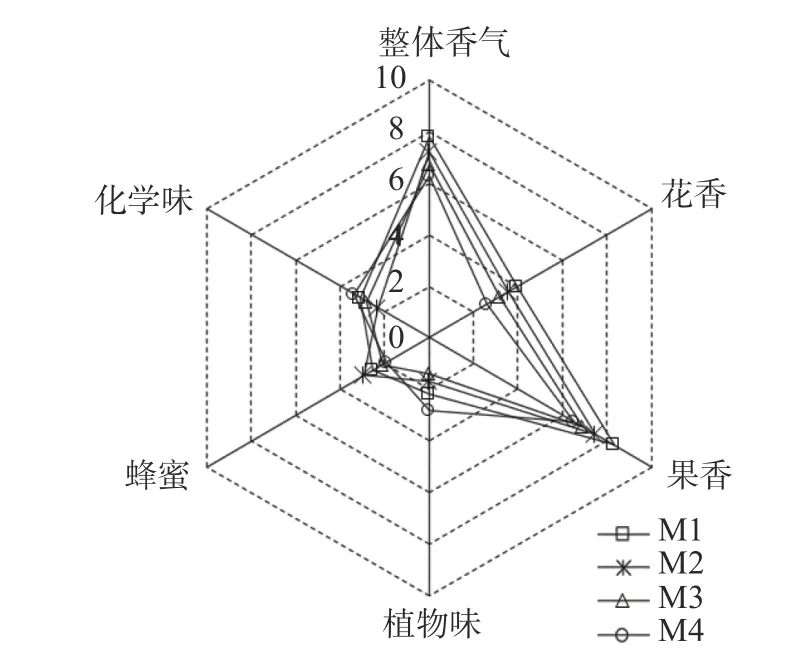
图5 贵人香白葡萄酒香气品质定量分析结果Fig.5 Average values of sensory evaluation scores of Italian Riesling white wines resulting from different fermentations.
酒样M1 具有浓郁的果香,中等强度的花香,以及一定强度的蜂蜜、植物和化学味,整体香气质量得分最高。酒样M2 和M3 的香气质量的评分结果比较相似,果香、花香的评分值是分别为M1 的83.1%~90.4%、84.9%~89.8%,但以上两种属性的评分M2均高于M3,而M3 的化学味强度高于M2。M4 在花香和果香属性上的得分都低于其他三个酒样,植物味和化学味评分均最高,整体香气得分最低。
3 讨论
3.1 混合发酵对酵母细胞增殖的影响
在混菌发酵的环境中,非酿酒酵母和酿酒酵母的共生可能会有多种表现,如相互促进、互不干扰或产生抑制。在本文研究的混合发酵组合中,戴尔有孢圆酵母和耐热克鲁维酵母能够更好地与酿酒酵母共存,其自身的增殖未受到明显影响,在发酵结束时两种非酿酒酵母在各自发酵环境中的活细胞数仍然达到6.31×10和9.77×10CFU/mL。据文献报道,该两类非酿酒酵母均属于温和发酵型酵母,增殖速率较慢,与酿酒酵母协同发酵时容易被酿酒酵母抑制,但某些菌株能够分泌弑杀同环境中其它微生物的分泌物,以保障自身的优势存活。在本研究中戴尔有孢圆酵母和耐热克鲁维酵母在混合发酵葡萄酒环境中的增殖均未见明显抑制作用,可能也是上述原因所致。与以上结果形成鲜明对比的是M1 样品,美极梅奇酵母的增殖被酿酒酵母显著抑制,前者在发酵结束时的活细胞数仅为其峰值时的0.9%。该研究结果与Alexandre 团队和Sun 等比较一致,这可能与酿酒酵母分泌的某些针美极梅奇酵母生长有关的弑杀毒素或代谢物有关,使其在与酿酒酵母竞争的生长环境中处于劣势,活细胞数迅速下降。
3.2 混合发酵对基本理化指标的影响
本研究测试了三种非酿酒酵母与酿酒酵母混合发酵对白葡萄酒基本组成的影响,发现与酿酒酵母单独发酵相比,混合发酵明显降低了酒体的酒精浓度。之所以出现上述结果,与它们利用糖类合成酒精的能力不及酿酒酵母有关。而挥发酸浓度下降则与所用酿造菌种低产乙酸的能力有关,虽然较早的研究一度认为发酵时混入非酿酒酵母是造成葡萄酒品质低劣的主要原因,但随着研究的逐步深入,研究者和酿酒师发现在酿造实践中非酿酒酵母能够改善葡萄酒的风味物质组成,如增加挥发性酯类含量,降低乙酸含量,从而改善产品的整体品质。再者,利用GC-IMS 获得的挥发性物质数据也能说明该问题,M1、M2 和M3 酒样中的乙酸信号强度显著低于M4,说明混合发酵在一定程度上限制了乙酸的合成。本文中所测试的三种商业化非酿酒酵母,即美极梅奇酵母、戴尔有孢圆酵母和耐热克鲁维酵母均属于低产乙酸的菌株,对提高白葡萄酒的品质具有积极作用。
3.3 混合发酵对挥发性组分的影响
挥发性香气化合物的种类、含量及相互作用是形成葡萄酒香气特征的化学基础,因此对挥发性组分进行有效分析是阐明葡萄酒香气特征的前提。本研究运用GC-IMS 技术分析不同葡萄酒的挥发性香气指纹图谱,通过信号峰的数量和信号强度进而综合判断不同混合发酵模式对葡萄酒香气化合物的影响和差异。
近年来非酿酒酵母引起广泛关注的一个重要原因是其对葡萄酒香气的积极影响,有望增加多种有益挥发性物质的含量,如酯类、醇类、萜烯、硫醇等,从而提升果酒的香气复杂性和品种特异性。以本研究中涉及的三种非酿酒酵母为例,据报道,戴尔有孢圆酵母和酿酒酵母混合发酵能够在一定程度上降低葡萄酒中乙醛、乙酸和部分高级醇的生成量,增加乳酸乙酯、己酸乙酯等乙酯类化合物浓度,并能释放较高浓度的萜烯。但也有文献指出戴尔有孢圆酵母对葡萄酒香气无影响甚至有负面作用,可能与菌株特异性和发酵条件特异性等有关。据研究,美极梅奇酵母与酿酒酵母混合接种时可以增加酯类、萜烯、中链脂肪酸和高级醇产量,提高葡萄酒中的果香特征和总体得分。利用耐热克鲁维酵母作为产香酵母与酿酒酵母实施混合发酵时可以提高萜烯、异丁酸等挥发性组分的生成量,同时减少乙酸、乙醛等物质的合成。
从本研究获得的实验结果来看,较之酿酒酵母单独发酵,接种戴尔有孢圆酵母的葡萄酒提升了丙酸乙酯、乙酸异丁酯、乙酸异戊酯、异丁酸乙酯、辛酸乙酯、己酸乙酯、-辛内酯、2,3-丁二酮、-松油烯等多种酯类、酮类化合物的含量,但是对萜烯类化合物的释放程度低于酿酒酵母单独发酵。萜烯类物质一般都具有果香花香特征,多以非挥发性糖苷结合态存在,只有降解成挥发性游离态时才能增强感官香气。本研究中测试的商业化戴尔有孢圆酵母适应葡萄酒发酵环境时可能未完全激活其β-葡萄糖苷酶活性,所以未能将萜烯类前体物质进行彻底分解。M3样品的检测结果与M2 具有一定的相似性,因此在主成分分析时二者位于同一象限,距离接近。接种美极梅奇酵母的葡萄酒则全面提升了挥发性酯类、醇类、醛酮类的含量,多种具有花香、果香、品种香的化合物均在M1 样品中信号强度最大,如异丁酸乙酯、乙酸异丁酯、2-甲基丁酸乙酯、己酸乙酯、-辛内酯、乙酸己酯、己酸丙酯、庚酸乙酯、3-甲基丁醇、己醇、2-戊酮、2,3-丁二酮、芳樟醇等。不同非酿酒酵母的生理活性及代谢过程不同,对风味物质的影响也不同。本研究中M1 酒样中挥发性芳香化合物的强度最高,说明该商业化美极梅奇酵母虽然不能完全适应与酿酒酵母共存的葡萄酒发酵环境,但能仍高效合成与香气合成有关的酶类,如酯酶、脂肪酶、-葡萄糖苷酶等,因此能较充分的分解多种香气前体物质,从而生成较多的芳香化合物。
3.4 白葡萄酒感官评定与香气组分之间的关系
香气感官质量分析结果表明非酿酒酵母-酿酒酵母混合发酵对提升葡萄酒的香气品质贡献较大,因为混合发酵葡萄酒的评分均高于酿酒酵母单独发酵。M1 贵人香白葡萄酒总体评分最高,M2 次之,其次是M3,得分最低的是M4。品评结果与本实验中GCIMS 挥发性组分测定结果基本符合,M1 生成了丰富的酯类和萜烯类化合物,如己酸乙酯、异丁酸乙酯、异戊酸乙酯、2-甲基丁酸乙酯、γ-壬内酯、δ-辛内酯、芳樟醇,以上这些挥发性化合物具有多样的水果香气和花香,因而能够赋予M1 酒样更浓郁的上述两种属性。M2 和M3 样品中大多数化合物的信号强度低于M1,所以在多个香气属性上的评分均低于M1。M4 样品中含有较高浓度的乙酸异丁酯、乙酸、丙酮等具有溶剂气味的挥发性组分,因此化学味最为强烈,造成其总体香气得分较低。
4 结论
本研究比较三种商业化非酿酒酵母,即戴尔有孢圆酵母、美极梅奇酵母和耐热克鲁维酵母分别与酿酒酵母混合发酵对贵人香白葡萄酒品质的影响,特别是对发酵进程、挥发性组分含量和香气质量的影响。研究结果显示,在混合发酵过程中,美极梅奇酵母易被酿酒酵母所抑制,最大活细胞数仅有酿酒酵母的16.6%;而其它两种产香酵母则能与酿酒酵母良好共存。就挥发性组分而言,美极梅奇酵母能够增加贵人香白葡萄酒中多种与花香、果香有关的挥发性酯类、萜烯类化合物的合成量,如己酸乙酯、2-甲基丁酸乙酯、芳樟醇等,显著提高了产品的感官品质。戴尔有孢圆酵母和耐热克鲁维酵母对白葡萄酒的香气品质提高也有贡献,增强了产品的复杂性,整体香气得分分列第2 和第3 位。本研究对指导白葡萄酒及其他果酒的酿造生产具有重要的理论价值和借鉴意义,也凸显了根据发酵目的合理选择酿造微生物的重要性。
