灵芝发酵麸皮粗多糖的组成及抗氧化活性分析
2022-10-11范明君安晓萍齐景伟
刘 娜,范明君,安晓萍,王 园,齐景伟,
(1.内蒙古农业大学动物科学学院,内蒙古呼和浩特 010018;2.内蒙古自治区草食家畜饲料工程技术研究中心,内蒙古呼和浩特 010018)
麸皮是小麦加工的主要副产物,含有丰富的营养物质,包括多糖、淀粉、蛋白质、酚类物质和其他组分。麸皮中的非淀粉多糖含量较高,不利于被机体消化吸收,活性物质利用率低,在一定程度上造成了资源的浪费。大量研究报告显示,利用微生物发酵可以降解麸皮中的非淀粉多糖和抗营养因子含量,释放多种活性物质,如酚酸类物质、多糖、蛋白质等,对动物提高抗氧化水平、增强机体免疫力起到促进作用,从而大幅提高其应用价值。
近几年,天然抗氧化剂由于能抑制有害活性氧的生成和清除体内存在的活性氧而成为国内外的研究热点。过量的氧自由基可以诱导细胞损伤,并促使各种疾病,如癌症、肝硬化、糖尿病发生。抗氧化剂是抑制或延缓氧化的物质,具有保护生物系统免受过度氧化的作用,可通过提高机体的抗氧化能力来预防多种疾病。抗氧化剂分为天然抗氧化剂和合成抗氧化剂。据报道,使用合成抗氧化剂可能存在细胞毒性和致癌潜能。因此,天然抗氧化剂的开发引起了食品和医药行业从事者的广泛关注。
多糖是麸皮中重要的活性物质,具有抗氧化、免疫调节和益生的作用。通过微生物发酵提取麸皮中的多糖有望开发为天然的抗氧化剂使用。史俊祥采用酿酒酵母菌和枯草芽孢杆菌发酵麸皮,发酵后多糖含量提高3.8 倍,用发酵麸皮多糖灌胃大鼠,结果表明发酵麸皮多糖有明显的抗氧化活性。目前微生物发酵麸皮的菌种大多采用芽孢杆菌、乳酸菌、酵母菌和霉菌,鲜少有利用灵芝菌发酵提取麸皮多糖的研究。灵芝是一种大型食药用真菌,具有抗氧化、抗肿瘤、提高免疫力等生理活性。人工培育灵芝子实体所需成本高、耗时长、且会对自然资源及环境造成负面影响。灵芝菌丝体液态发酵具有生产周期短、生长状况稳定等优点。灵芝液态发酵过程中能分泌丰富的纤维素和半纤维素降解酶系,还能产生灵芝多糖、三萜、酚酸等活性物质。因此,本研究采用灵芝液态发酵的方法提取麸皮中的多糖,探讨发酵前后麸皮粗多糖抗氧化活性及组分变化,初探灵芝发酵麸皮粗多糖的单糖组成、分子量和红外光谱表征,为灵芝发酵麸皮粗多糖天然抗氧化剂的开发提供参考。
1 材料与方法
1.1 材料与仪器
灵芝菌(CGMCC 5.616) 购自中国普通微生物菌种宝藏管理中心;麸皮 购买于市场;麸皮固体培养基(g/L):麸皮100 g、麦芽糖10 g、蛋白胨2 g、蔗糖10 g、过磷酸钙1 g、磷酸二氢钾1 g、七水合硫酸镁0.5 g、琼脂30 g,自然pH,120 ℃高压灭菌20 min。麸皮液体培养基(g/L):麸皮100 g、麦芽糖10 g、蛋白胨2 g、蔗糖10 g、过磷酸钙1 g、磷酸二氢钾1 g、七水合硫酸镁0.5 g,自然pH,120 ℃高压灭菌20 min;乙腈(HPLC 级)、单糖标准品 均购自圣路易斯化工公司;1-苯基-3-甲基-5-吡唑酮(PMP) 北京化学试剂有限公司;磷酸二氢钠、磷酸氢二钠、六氰合铁酸钾、二氯乙酸、氯化铁、丁基羟基茴香醚(BHA)、维生素C、1,1-2 二苯基-2-三硝基苯肼(DPPH)、硫酸亚铁、水杨酸乙醇、HO等 均为分析纯,国药集团化学试剂有限公司。
TG16-WS 台式高速离心机 湖南湘仪仪器开发有限公司;HH-2 数显恒温水浴锅 中国鄄城华鲁电热电器有限公司;DGX-9053B-1 电热鼓风干燥箱上海一恒科学仪器有限公司;TP214 分析天平梅特勒-托利多仪器有限公司;VFD-1000 冷冻干燥机 上海荣威仪器有限公司;RE-201D 旋转蒸发仪上海科兴仪器有限公司;Nicolet iS5N 傅里叶变换红外光谱仪 Thermo 公司;1200 高效液相色谱仪安捷伦科技有限公司。
1.2 实验方法
1.2.1 灵芝发酵麸皮的条件 将购买的灵芝菌种接种到麸皮固体培养基中进行活化,30 ℃培养6~10 d,挑取约1 cm大小的菌块接入到麸皮固体培养基中进行第二次活化,30 ℃培养6~10 d,灵芝菌丝体长满平板。从麸皮平板培养基中挑取3 块1 cm的菌丝块接种到麸皮液体培养基中,30 ℃、150 r/min培养3 d 后得到一代灵芝发酵液,将一代发酵液按10%的接种量再接种到麸皮液体培养基中,30 ℃、150 r/min 培养5 d,得到灵芝麸皮发酵液。
1.2.2 发酵前后麸皮粗多糖的提取 将灵芝麸皮发酵液和麸皮液体培养基分别离心20 min(5000 r/min),沉淀物用3 倍体积的沸水浸提4 h,水提物旋转蒸发冷冻干燥后置于4 倍体积的90%乙醇溶液中,4 ℃沉淀过夜,收集沉淀,冷冻干燥。采用Sevage 结合酶法去蛋白,将沉淀样品配制成4%的溶液,加入0.2%的中性蛋白酶,在40 ℃水浴锅中继续搅拌酶解1.5 h 后沸水浴10 min,冷却后离心(5000 r/min,15 min),取上清液加入Sevage 试剂(三氯甲烷:正丁醇=4:1)3:1 混合,使用磁力搅拌器振荡30 min,离心(5000 r/min,15 min),再取上清液再按3:1 与Sevage 试剂混合,离心,相同步骤重复两次。收集最后一步的上清液,旋转蒸发冷冻干燥,最终得到灵芝发酵麸皮粗多糖(GWBP)和麸皮粗多糖(WBP)。
1.2.3 抗氧化活性指标测定
1.2.3.1 DPPH 自由基清除率 吸取1 mL 不同浓度(0、0.5、1.0、2.0、4.0 g/L)粗多糖样液,加1 mL DPPH 应用液,混匀静置30 min,在517 nm 处测定吸光度A;用蒸馏水代替样液测定吸光度A;用95%乙醇代替DPPH 应用液测定吸光度A。维生素C(V)和丁基羟基茴香醚(BHA)为阳性对照。
计算公式:
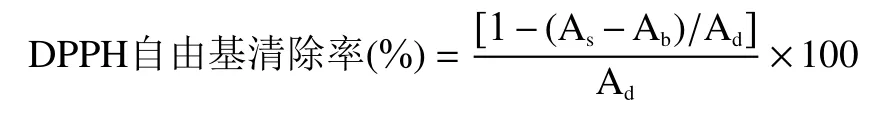
1.2.3.2 羟基自由基清除率 吸取1 mL 不同浓度(0、0.5、1.0、2.0、4.0 g/L)的样液,加入0.5 mL 9 mmoL/L FeSO、8.8 mmoL/L HO反应10 min 后,加入9 mmoL/L 水杨酸乙醇0.5 mL,反应30 min,在510 nm 处测定吸光度。A:蒸溜水代替样品吸光度;A:样品吸光度;A:蒸馏水代替FeSO溶液吸光度。维生素C(V)和丁基羟基茴香醚(BHA)为阳性对照。
计算公式:

1.2.3.3 还原力的测定 吸取0.75 mL 不同浓度(0.5、1.0、2.0、4 g/L)的样液,加入同体积0.2 moL/L磷酸缓冲液和1%六氰合铁酸钾,50 ℃反应20 min,再加入同样体积的10%三氯乙酸终止反应,取1.5 mL反应液加入1.5 mL 蒸馏水和400 μL 0.1% FeCl,室温反应10 min,700 nm 处测吸光度。维生素C(V)和丁基羟基茴香醚(BHA)为阳性对照。
1.2.4 发酵前后粗多糖组成分析 多糖的测定参照文献[15],多酚的测定参照文献[16],黄酮的测定参照文献[17],蛋白的测定参照文献[13]。
1.2.5 灵芝发酵麸皮粗多糖单糖组成的测定 采用范明君的方法,分别称取GWBP 和WBP 2 mg,加入0.5 mL 浓度为2 mol/L 三氟乙酸,120 ℃水解120 min,使用氮吹仪吹干。用单糖标准品配制成10 mg/mL 溶液,取5 μL 各个单糖标品溶液,加入0.5 mL 浓度为2 mol/L 三氟乙酸中,与样品同时在120 ℃下水解120 min,并使用氮吹仪吹干。向吹干后得到的样品中加入0.5 mL 甲醇溶液(0.5 mol/L)和0.5 mL NaOH 溶液(0.3 mol/L),混匀后在70 ℃水浴条件下反应30 min。冷却至室温,加入0.3 mol/L盐酸0.5 mL 中和。用0.5 mL 氯仿反复萃取3 次,5000 r/min 离心5 min,取上清液,经0.22 μm 微孔滤膜过滤后待HPLC 分析。
HPLC 条件:SHISEIDO C色谱柱(250 mm×4.6 mm,5 μm),流动相A 为0.1 mol/L 磷酸盐缓冲液(pH7.0);流动相B 为乙腈水溶液(82:18,v/v);流速为1.0 mL/min;柱温25 ℃;进样量10 μL;采用VWD 检测器在245 nm 处检测。
1.2.6 分子量测定 色谱柱:PL gel 色谱柱(300 mm×7.5 mm MIXED-BLS);洗脱液:TCB+0.5 mg/L BHT;流速:1 mL/min;样品浓度:2.0 mg/mL;进样量:100 μL;温度:150 ℃;检测器:示差检测器(RI)、90°角光散射检测器(RALS)、7°角光散射检测器(LALS)和粘度检测器。
1.2.7 红外光谱分析 称取GWBP 1 mg,与KBr 混合后研磨至粉末状,采用红外光谱仪扫描分析,于500~4000 cm波长范围,观察其吸收峰,确定其苷键类型,进行红外光谱分析。
1.3 数据处理
采用Excel 2016 和SAS 9.2 对数据进行处理、绘图和显著性分析(ANOVA,<0.05),试验结果除有特殊说明外,均为三次实验平均值±标准偏差。
2 结果与分析
2.1 灵芝发酵麸皮粗多糖的抗氧化活性
2.1.1 DPPH 自由基清除率 由图1 可知,GWBP 和WBP 的DPPH 自由基清除率随着样品浓度的增加而增高。GWBP 的DPPH 清除率在浓度0.5~4.0 g/L的范围内显著高于WBP 组(<0.05)。在浓度4 g/L时,GWBP 组对DPPH 自由基的清除率为91.37%,显著高于BHA 组(86.81%)和WBP 组(75.15%),接近V组(95.44%)。说明灵芝发酵可以提高麸皮粗多糖的DPPH 自由基清除率。

图1 不同浓度粗多糖的DPPH 自由基清除率Fig.1 DPPH radical scavenging rate of crude polysaccharides with different concentrations
2.1.2 羟基自由基清除率测定 由图2 可知,GWBP和WBP 的羟基自由基清除率随着样品浓度的增加而增高。GWBP 的羟基自由基清除率在浓度0.5~4.0 g/L 的范围内显著高于WBP 组(<0.05)。在浓度4 g/L 时,GWBP 组的羟基自由基清除率为95.74%,显著高于BHA 组(63.70%)和WBP 组(67.96%),接近V组(99.9%)。说明灵芝发酵可以提高麸皮粗多糖的羟基自由基清除率。
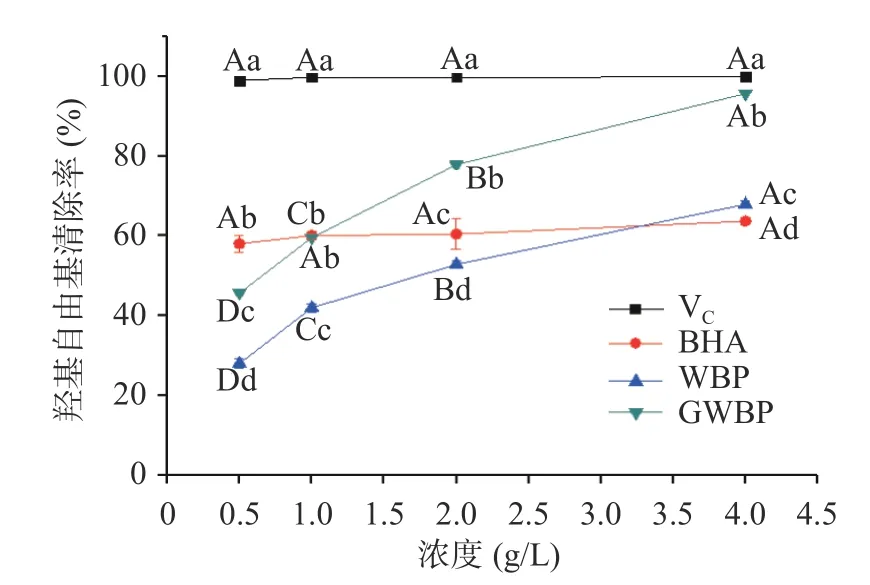
图2 不同浓度粗多糖的羟基自由基清除率Fig.2 Hydroxyl radical scavenging rate of crude polysaccharides with different concentrations
2.1.3 还原力测定 由图3 可知,GWBP 和WBP 的还原力随着样品浓度的增加而增高。在样品浓度为0.5~4.0 g/L 的范围内,各组还原力由大到小的顺序为:V>BHA>GWBP>WBP;其中,GWBP 组的还原力显著高于WBP 组(<0.05)。当样品浓度为4.0 g/L时,GWBP 组的还原力为0.92,显著高于WBP 组(0.83),接近BHA 组(0.97)和V组(0.98)(<0.05)。说明灵芝发酵可以提高麸皮粗多糖的还原力。
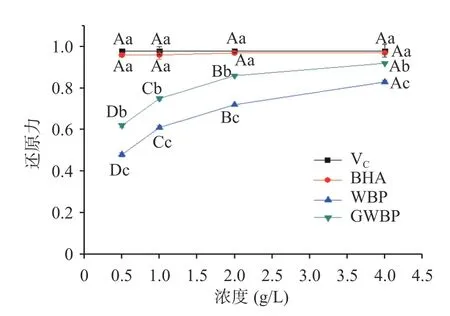
图3 不同浓度粗多糖的还原力Fig.3 Reducing power of crude polysaccharides with different concentrations
2.2 灵芝发酵麸皮粗多糖组分
对比发酵前后麸皮粗多糖的组成(见表1)。由表可知,GWBP 组中的黄酮、多酚和蛋白含量分别为5.41、12.74 和206.41 mg/g,显著高于WBP 组(<0.05)。GWBP 中的多糖含量与WBP 组相比则显著降低(<0.05)。说明灵芝发酵后麸皮粗多糖中的黄酮、多酚和蛋白含量显著提高(<0.05)。多酚作为一类具有多羟基化合物的次生代谢产物,能与蛋白质、多糖等大分子相结合,清除并抑制自由基的生成,表现出较强的抗氧化功能。灵芝发酵麸皮粗多糖自由基清除率和还原力提升的原因可能与多糖组分中黄酮、多酚、蛋白含量的增加有关。
表1 发酵前后麸皮粗多糖组成(,n=3)Table 1 Composition analysis of wheat bran crude polysaccharide before and after fermentation (,n=3)
2.3 灵芝发酵麸皮的粗多糖结构
2.3.1 单糖组成分析 初探灵芝发酵麸皮粗多糖的结构表征。表2 为灵芝发酵麸皮粗多糖的单糖组成。由表2 可知,GWBP 的单糖组成为葡萄糖:木糖:核糖:阿拉伯糖:半乳糖:甘露糖:鼠李糖29.95:28.47:28.47:8.26:1.65:2.98:0.23。GWBP 组分主要以葡萄糖、木糖和核糖为主,三者的摩尔百分比达86.89%,还有少量的阿拉伯糖、半乳糖、甘露糖和鼠李糖。杜涓用复合菌固态发酵麸皮,得到的糖蛋白单糖组成为甘露糖:核糖:鼠李糖:葡萄糖醛酸:半乳糖醛酸:葡萄糖:半乳糖:木糖:阿拉伯糖:岩藻糖

表2 灵芝发酵麸皮粗多糖的单糖组成Table 2 Monosaccharide composition of crude polysaccharide from Ganoderma lucidum fermented wheat bran
4.18 :0.57:0.28:0.21:007:33.33:4.59:31.29:25.31:0.16,以葡萄糖、木糖、阿拉伯糖为主,三者的摩尔百分比为89.93%。与本实验中的单糖组成结果不一致,原因可能是不同的发酵方式、菌种对麸皮粗多糖的单糖组成有不同的影响。
2.3.2 分子量分析 由图4、表3 可以看出,粗多糖分子量分布系数可由Mw/Mn 的比值显示,当Mw/Mn值为1,说明粗多糖是由链长均相等的单分散聚合物组成,比值越大,分子量分布就越宽即分散度就越大。GWBP 的Mw/Mn 比值为1.170,结合GPC 谱图可以看出,GWBP 分布较为集中。分子量测定结果显示,GWBP 的分子量为4.172×10Da。

表3 灵芝麸皮粗多糖的分子量Table 3 Molecular weight of crude polysaccharide from Ganoderma lucidum fermented wheat bran
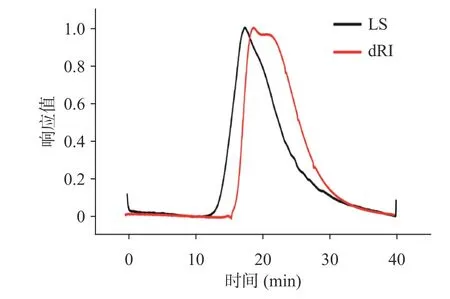
图4 灵芝发酵麸皮粗多糖的GPC 谱图Fig.4 GPC chromatogram of crude polysaccharide from Ganoderma lucidum fermented wheat bran
2.3.3 红外光谱分析 红外光谱用于定性测定多糖中重要的有机官能团,特别是O-H、C-H 和C=O 官能团,它们是多糖的重要组成部分。从图5 可以看出,GWBP 在3400 cm附近有较强的吸收峰,归因于O-H 的拉伸振动;在2920 cm附近的吸收峰是由于C-H 拉伸振动引起的。在1660 和1412 cm处的吸收峰是COO-的特征峰,糖甙键C-O-C 出现在1152 和1077 cm附近的不对称振动,表明样品中含有吡喃基糖环。红外光谱结果显示GWBP 是一种吡喃糖,在4000~500 cm范围内有多糖特征吸收峰。

图5 GWBP 的红外光谱图Fig.5 Infrared spectra of the GWBP
3 讨论
本文探讨了灵芝液态发酵对麸皮粗多糖组成及抗氧化活性的影响。DPPH 自由基清除率是最常见的体外抗氧化活性指标。羟基自由基主要导致相邻生物分子的氧化损伤,被认为是最有害的ROS。因此,清除羟自由基对细胞或食物系统的抗氧化防御具有重要意义。灵芝发酵麸皮粗多糖(GWBP)的DPPH、羟基自由基清除率和还原力在0.5~4.0 g/L的浓度范围内显著高于未发酵麸皮粗多糖(WBP)(<0.05)。GWBP 在浓度4 g/L 时的DPPH、羟基自由基清除率显著高于丁基羟基茴香醚(BHA)组(<0.05),接近V组。说明灵芝发酵可以显著提高麸皮粗多糖的体外抗氧化活性,灵芝发酵麸皮粗多糖在一定浓度范围内可以替代合成的抗氧化剂BHA使用,清除DPPH 和羟基自由基。
对比灵芝发酵前后麸皮粗多糖的单糖组成,GWBP 组分中的黄酮、多酚和蛋白含量显著高于WBP(<0.05),多糖含量显著下降(<0.05),原因可能是灵芝生长代谢过程中产生的酶系降解了一部分麸皮中的非淀粉多糖,同时灵芝代谢产生的黄酮、多酚、小肽等物质与大分子的多糖结合在一起导致了GWBP 组分的变化。杜涓等研究表明发酵麸皮多糖的抗氧化活性与其多糖组分中的多酚和蛋白含量存在显著的正相关。本试验中GWBP 体外抗氧化活性升高的原因也可能与其多糖组分中的多酚和蛋白含量的增加有关。
初探GWBP 的结构发现,GWBP 是一种吡喃糖,其单糖组成主要以葡萄糖、木糖和核糖为主,三者的摩尔百分比达86.89%。GWBP 的分子量为4.172×10Da,分布较为集中。杜涓用复合菌固态发酵麸皮,得到的糖蛋白单糖组成以葡萄糖、木糖、阿拉伯糖为主。这与本研究结果不同,原因可能是不同的发酵方式、发酵菌株对麸皮多糖的结构产生了不同的影响。有研究报道称由几种单糖组成的异多糖和小分子量的多糖具有更高的生物活性。本实验中的灵芝发酵麸皮粗多糖单糖组成种类丰富,且分子量也较小。
本文采用灵芝液态发酵麸皮的方法提取麸皮粗多糖,对灵芝发酵麸皮粗多糖的体外抗氧化活性、组成变化及单糖组成、分子量、红外光谱进行了探索性研究,结果证明灵芝发酵麸皮粗多糖具有开发为天然抗氧化剂的潜力。
4 结论
本文采用灵芝液态发酵麸皮,通过热水浸提、乙醇沉淀、Sevage 结合酶法去蛋白,提取出灵芝发酵麸皮粗多糖;对比了灵芝发酵前后麸皮粗多糖的体外抗氧化活性及组成变化,发现灵芝发酵麸皮粗多糖的体外抗氧化活性显著提高(<0.05),其组分中黄酮、多酚、蛋白含量的提高可能是其抗氧化活性增强的原因。灵芝发酵有利于麸皮的高值化、资源化利用。灵芝发酵麸皮粗多糖有望开发为一种天然抗氧化剂应用在食品工业、保健品等领域。
