QuEChERS/高效液相色谱-串联质谱法测定动物源性食品中14 种蛋白同化激素残留
2022-10-11张海超贾海涛艾连峰
王 敬,张海超,贾海涛,艾连峰
(石家庄海关技术中心,河北石家庄 050051)
蛋白同化激素是一类可以调节机体代谢,促进细胞的生长分化,进而增强食欲、促进发情、提高饲料转化率的甾体激素,在畜牧养殖业应用广泛。然而,滥用该类抗生素会造成其在动物组织不同程度的残留,进而引起消费者内分泌紊乱,导致儿童性早熟,甚至增加致癌、致畸等风险。因此世界各国均规定了动物源性食品中蛋白同化激素的最大残留限量,欧盟、美国和日本等国家或组织就规定禁止将蛋白同化激素应用到食用型动物的饲养中。我国农业部第250 号公告将群勃龙、甲睾酮、美仑孕酮等同化激素列为禁用兽药;GB 31650-2019《食品安全国家标准 食品中兽药最大残留限量》要求苯丙酸诺龙和丙酸睾酮不得在动物性食品中检出,同时世界反兴奋剂机构发布的《禁用清单国际标准》将蛋白同化剂列为禁止使用的兴奋剂类药物。
激素通过代谢残留于动物体内,含量非常低,大部分在μg/kg 水平,目前国内外分析蛋白同化激素残留的检测方法主要有高效液相色谱法(HPLC)、气质联用法(GC/MS)、液相色谱-串联质谱法(HPLCMS/MS)和高分辨线性离子阱法等。由于动物源性食品基质的复杂性,HPLC 法和GC/MS 法由于干扰严重,检出限高难以满足要求;高分辨线性离子阱法由于设备昂贵,仍然难以大规模推广使用;HPLC-MS/MS 法因其灵敏度高,选择性强等特点应用广泛;QuEChERS 是一种新的前处理技术,广泛应用于动植物样品中的农兽药残留检测,但采用QuEChERS 前处理方法同时测定动物源食品中蛋白同化激素残留的研究尚未见报道。
目前针对动物源性食品中蛋白同化剂的检测也有一些相关文献报道,但检测基质仅局限于肌肉、牛奶和饲料等动物源性食品,未涉及调制肉制品。西方食用调制肉制品的人群较多,该类食物为动物源性食品的重要部分,其监管绝对不能出现漏洞。因此,建立一种快速、准确的适用于动物源性食品中蛋白同化激素的检测方法即可满足当前食品安全检测的需求,又能避免重大赛事中运动员因误服误用导致兴奋剂阳性事件的发生。本文采用QuEChERS 前处理技术,通过优化样品前处理及色谱、质谱分析条件,建立了同时测定肌肉组织(猪肉、牛肉、羊肉)、调制肉(火腿、牛肉饼、咖喱肉、羊肉串)、肝脏组织(猪肝、猪肾)、牛奶和鸡蛋等基质动物源食品中14 种蛋白同化激素残留量的高效液相色谱-串联质谱法。该方法快速准确、适用基质范围广,能为打击在动物源性食品中激素类药物的违法使用提供强有力的技术支持。
1 材料与方法
1.1 材料与仪器
肌肉组织(猪肉、牛肉、羊肉)、调制肉(火腿、牛肉饼、咖喱肉、羊肉串)、肝脏组织(猪肝、猪肾)、牛奶和鸡蛋等样品 均购自当地市场;群勃龙(Trenbolone,CAS:1061-33-8)、勃地龙(Boldenone,CAS:846-48-0)、诺龙(Nandrolone,CAS:433-22-0)、睾酮(Testosterone,CAS:58-22-0)、美雄酮(Methandienone,CAS:72-63-9)、甲睾酮(17-methyltesterone,CAS:58-18-4)、脱氢表雄酮(Dehydroepiandrosterone,CAS:53-43-0)、丙酸诺龙(Nandrolone 17-propionate,CAS:7207-92-3)、丙酸睾酮(Testosterone propionate,CAS:57-85-2)、黄体酮(Progesterone,CAS:57-83-0)、雄诺龙(Stanolone,CAS:521-18-6)、司坦唑醇(Stanozolol,CAS:10418-03-8)、美替诺龙(Methenolone,CAS:153-00-4)、苯丙酸诺龙(Nandrolone phenylpropionate,CAS:62-90-8)等14 种蛋白同化激素 纯度≥95%,德国Dr.Ehrenstorfer 公司;乙腈(色谱纯)、甲酸(色谱纯)、甲醇(色谱纯)、正己烷(色谱纯)、-葡萄糖醛酸酶及芳香基硫酸酯酶(-葡萄糖醛酸酶>100000 Units/mL,芳香基硫酸酯酶<20000 Units/mL)、QuEChERS 净化管(300 mg 无水硫酸镁、50 mg PSA、50 mg C、300 mg 中性氧化铝)上海安谱实验科技股份有限公司;乙酸、乙酸铵、氯化钠 分析纯,广州化学试剂厂;实验用水Milli-Q 超纯水 美国Millipore 公司。
Waters Acquity UPLC/XEVOTQ-S 液相色谱-质谱/质谱仪(配电喷雾离子源) 美国Waters 公司;VORTEX 2 涡旋振荡器 德国Heidolph 公司;KQ-200 TDB 超声波清洗器 昆山市超声仪器有限公司;ML 204/02 分析天平 梅特勒-托利多仪器(上海)有限公司;CR22GIII 型高速冷冻离心机 日本HITACHI 公司。
1.2 实验方法
1.2.1 标准溶液的配制 标准储备液(1 mg/mL)配制:分别称取14 种蛋白同化激素标准品10 mg(精确至0.1 mg)于10 mL 容量瓶中,用甲醇溶解并定容至刻度,4 ℃避光保存。
混合标准中间液(1 μg/mL)配制:准确吸取标准储备液各0.10 mL,置于100 mL 容量瓶中,用甲醇稀释至刻度,摇匀,配制成1 μg/mL 的混合标准中间液,4 ℃冷藏保存。
基质匹配混合标准工作溶液配制:准确量取适量混合标准中间液,用50%乙腈溶液稀释空白样品基质提取液,配制成浓度为0.1、0.2、0.5、1、5、10 ng/mL 的系列标准工作溶液,现用现配。
1.2.2 样品前处理 称取5.0 g 样品(精确至0.01 g)于50 mL 具塞塑料离心管中,加入10 mL 乙酸铵缓冲溶液(pH5.2),涡旋混匀,再加入-葡萄糖醛酸酶及芳香基硫酸酯酶溶液100 μL,于(37±1)℃振荡酶解12 h,取出冷却至室温,加入20 mL 乙腈、5 g 氯化钠,涡旋振荡2 min,4000 r/min 离心5 min。移取10 mL 乙腈层至另一离心管中,加入10 mL 乙腈饱和正己烷,涡旋振荡1 min 后弃去正己烷层,再加入10 mL 乙腈饱和正己烷重复操作一次。取上清液约5 mL 置于装有300 mg 无水硫酸镁、50 mg PSA、50 mg C和300 mg 中性氧化铝的另一10 mL 离心管中,涡旋振荡2 min,10000 r/min 高速离心5 min。准确移取4 mL 上清液于10 mL 离心管中,40 ℃氮吹至近干,用1 mL 50%乙腈溶液溶解残渣。经0.22 μm 滤膜过滤,用液相色谱-串联质谱仪测定。
1.2.3 仪器条件 色谱柱:Waters Acquity BEH C(100 mm×2.1 mm,1.7 μm);进样量:5 μL;柱温:40 ℃;流动相:A 相为0.1%甲酸水溶液,B 相为乙腈;流速:350 μL/min;梯度洗脱程序如下:0~1.0 min,20%B;1.0~5.0 min,20%B~90%B;5.0~6.0 min,90%B~100%B;6.0~6.5 min,100%B~20%B;6.5~8.0 min,20%B。
电离方式:电喷雾正离子源(ESI);检测模式:多反应监测(MRM)模式;毛细管电压:3.5 kV;离子源温度:150 ℃;去溶剂温度:450 ℃;脱溶剂气流量:1000 L/h;碰撞气流量:0.17 mL/min。待测物的母离子、子离子、保留时间及碰撞能等参数见表1。

表1 14 种待测物的多反应监测质谱参数Table 1 Multi-reaction monitoring mass spectrometry parameters of the target compounds
1.3 数据处理
在沃特世超高效液相色谱串联质谱仪上通过MassLynx 软件获取和分析数据,所有试验数据均应用SPSS 19.0 统计学软件进行处理,以平均数±标准差(X±S)表示。
2 结果与分析
2.1 提取溶剂的优化
外源性同化激素在动物体内的代谢情况比较复杂,目前没有文献明确指出14 种蛋白同化激素在动物体内的代谢过程和代谢途径。黄冬梅等报道蛋白同化激素多以葡萄糖醛酸结合形态存在,酶解可促进蛋白同化激素水解成游离态,从而提高样品中激素的提取效率。14 种蛋白同化激素属于脂溶性化合物,极性较弱,难溶于水,易溶于极性有机溶剂。蛋白同化激素常用的提取溶剂有叔丁基甲醚、乙酸乙酯、乙腈、甲醇等。通过待测物加标回收率,试验考察了猪肉中甲醇、乙腈、乙酸乙酯和叔丁基甲醚四种溶剂的提取效果。由图1 可知,同甲醇(回收率范围:63%~94%)、乙酸乙酯(回收率范围:52%~91%)、叔丁基甲醚(回收率范围:45%~88%)相比,乙腈(回收率范围:85%~108%)是最合适的提取溶剂。甲醇对勃地龙、诺龙、脱氢表雄酮、雄诺龙和丙酸诺龙的提取效果不理想,且甲醇提取样品杂质较多,基质干扰严重;乙酸乙酯和叔丁基甲醚的乳化现象严重,常需要进行破乳。甲醇极性较强但样品中的色素和脂肪等基质干扰物较多,增加了后续净化的难度;乙腈穿透力强具有较强的沉淀蛋白作用,提取效率高;考虑到动物源性食品中含有大量的蛋白质,采用乙腈提取,既可以盐析,又可以沉淀蛋白质,一定程度上能够减少基质效应,有利于后续的净化。
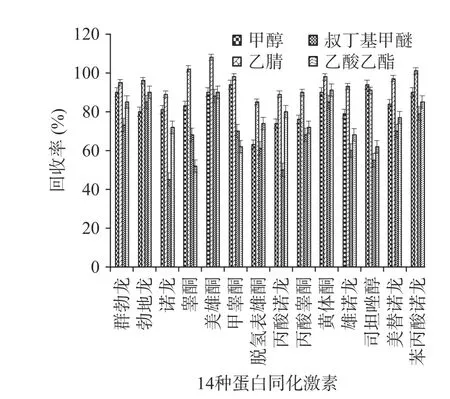
图1 提取溶剂的种类对蛋白同化激素回收率的影响Fig.1 Different extraction solvents on the extraction rate for anabolic androgenic steroids
对比了10、20 和50 mL 目标物浓度为50 ng/mL的提取溶剂对回收率的影响,结果如图2 显示,当提取溶剂体积为10 mL 时,除诺龙、甲睾酮、丙酸睾酮和丙酸诺龙外,其他10 种蛋白同化激素的提取率在45%~70%之间;当提取溶剂体积为20 mL 时,回收率均能达到80%以上,最终用20 mL 乙腈提取。动物源性食品中含有大量的脂肪和蛋白质,脂肪易被有机溶剂萃取,对分析造成严重的基质干扰,试验采用乙腈饱和的正己烷萃取可有效去除脂肪。

图2 提取体积对蛋白同化激素回收率的影响Fig.2 Different extraction volume on the extraction rate for anabolic androgenic steroids
2.2 净化剂的选择与优化
实验选取了C、HLB、通过式PRiME HLB 固相萃取柱和QuEChERS 四种净化方式进行了比较。结果发现,C柱净化效果较差,基质效应明显;HLB 和通过式PRiME HLB 固相萃取柱对目标物的保留性强,需要后续的乙腈进行洗脱,增加了基质效应的影响,二者虽然结果重现性好,但存在操作繁琐、处理时间长、成本高等问题。QuEChERS 方法常用的净化剂有N-丙基乙二胺(PSA)、十八烷基硅烷(C)、石墨化炭黑(GCB)、中性氧化铝等。PSA 可以去除乙腈提取液中的脂肪酸、糖类、酚类以及极性色素等成分;C能吸附基质中部分非极性脂肪和脂溶性杂质;中性氧化铝具有良好的除脂能力;GCB 能够去除色素和固醇类杂质,但对苯环类平面结构的药物有一定的吸附,实验最终选定PSA、C和中性氧化铝作为样品吸附剂。考察了不同配比的PSA、C和中性氧化铝的净化效果,结果如表2 所示。取5 mL 提取液,加入20 mg PSA 和100 mg 中性氧化铝,分别比较C添加量为10、30、50、70 mg 时,14 种蛋白同化激素的回收率,发现C添加量为50 mg 时14 种蛋白同化激素的回收率最高;加入50 mg C和100 mg 中性氧化铝,分别比较PSA 添加量为10、30、50、70 mg 时,14 种蛋白同化激素的回收率,发现PSA 添加量为50 mg时,14 种蛋白同化激素的回收率最高;中性氧化铝对大部分目标物的吸附较少,加入50 mg C和50 mg PSA,分别比较中性氧化铝添加量为100、200、300、400 mg 时,14 种蛋白同化激素的回收率,发现中性氧化铝在加入300 mg 时净化后的溶液较之前清澈透亮,基线较平整,当增加到400 mg 时,回收率会下降。因此,实验最终选择5 mL 提取液加入300 mg无水MgSO、50 mg C、50 mg PSA 和300 mg 中性氧化铝作为净化剂组合时,样品可以获得良好的净化效果,基质干扰小,且不会对目标物产生明显吸附。

表2 不同条件净化剂组合蛋白同化激素回收率Table 2 Recovery of anabolic hormones by combination of purifiers under different conditions
2.3 色谱条件的优化
试验选择了Agilent Eclipse Plus C(100 mm×2.1 mm,1.8 μm)、Waters Acquity BEH C(100 mm×2.1 mm,1.7 μm)和Agilent Zobrax SB-C(100 mm×3.0 mm,1.8 μm)三种色谱柱进行分离。试验发现,由于蛋白同化激素属于弱极性和中等极性化合物,普通的C柱均能保留目标物,但14 种物质在Waters Acquity BEH C(100 mm×2.1 mm,1.7 μm)柱上均能得到优异的色谱峰形,重现性好,对不同极性的化合物均有合适的保留且质谱检测本底低。因此,试验选择Waters Acquity BEH C(100 mm×2.1 mm,1.7 μm)柱。
2.4 质谱条件的优化
蛋白同化激素属于脂溶性化合物,弱极性或中等极性,以乙腈-水为基准流动相,采用“T”三通方式,对14 种目标物的质谱条件进行优化。在正离子和负离子模式下进行全扫描,以选择适当的分子离子峰和电离方式。结果表明,在离子源ESI电离方式下,可以获得较高丰度的[M+H]母离子。在确定目标物的母离子后,采用子离子扫描方式对子离子进行了选择,通过优化毛细管电压、一级锥孔电压、二级锥孔电压、射频透镜电压、碰撞能量以及质谱分辨率等参数,使每种激素的分子离子与特征碎片离子产生的离子强度达到最大。将液相色谱与三重四级杆质谱联机,对离子源温度、去溶剂气温度及流量、锥孔气流量进行优化,使每种目标物的离子化效率达到最佳,14 种蛋白同化激素的质谱分析参数见表1。图3 为蛋白同化激素混合标准溶液的MRM 色谱图。

图3 蛋白同化激素标准溶液多反应监测色谱图(0.5 ng/mL)Fig.3 MRM chromatograms of anabolic androgenic steroids (0.5 ng/mL)
2.5 基质效应
基质效应(Matrix effects,ME)是指色谱分离时共洗脱的物质改变了待测成分的离子化效应,所引起的信号的抑制或提高,是目标物和基质成分相互竞争导致的结果。消除和补偿基质效应主要包括优化色谱质谱条件,优化色谱分离条件,多步骤净化措施,使用内标物定量,采用基质匹配标准曲线定量等。基质效应(matrix effect,%)ME=(基质匹配标准曲线的斜率/纯溶剂标准曲线的斜率-1)×100。基质效应为负值表示存在基质抑制效应,为正值表示基质增强;基质效应在-15%~15%之间认为基质效应不明显;绝对值越大表示基质效应越强。试验比较了猪肉、猪肝、火腿、牛奶和鸡蛋的基质效应,图4 发现不同的样品基质存在不同程度的影响,为消除基质效应对待测物的定量准确度和精密度的影响,试验采用基质匹配标准曲线定量法基本减小或消除了基质干扰对结果的影响。

图4 14 种蛋白同化激素的空白样品基质效应结果Fig.4 Matrix effect of 14 anabolic androgenic steroids in different sample matrices
2.6 线性关系、检出限和定量限
配制浓度为0.1、0.2、0.5、1、5 和10 ng/mL 的基质匹配标准工作溶液进行测定,以定量离子的响应峰面积(Y 轴)对相应的质量浓度(X 轴,ng/mL)作标准曲线,得到线性回归方程,线性关系良好,其结果见表3。实验以空白添加法,并根据前处理过程提取净化过程以及进行测定时所受的干扰情况,确定14种蛋白同化激素的检出限为0.3 μg/kg,定量限为1.0 μg/kg。该方法检出限和定量限低,能够满足动物源性食品中蛋白同化激素残留检测的要求。
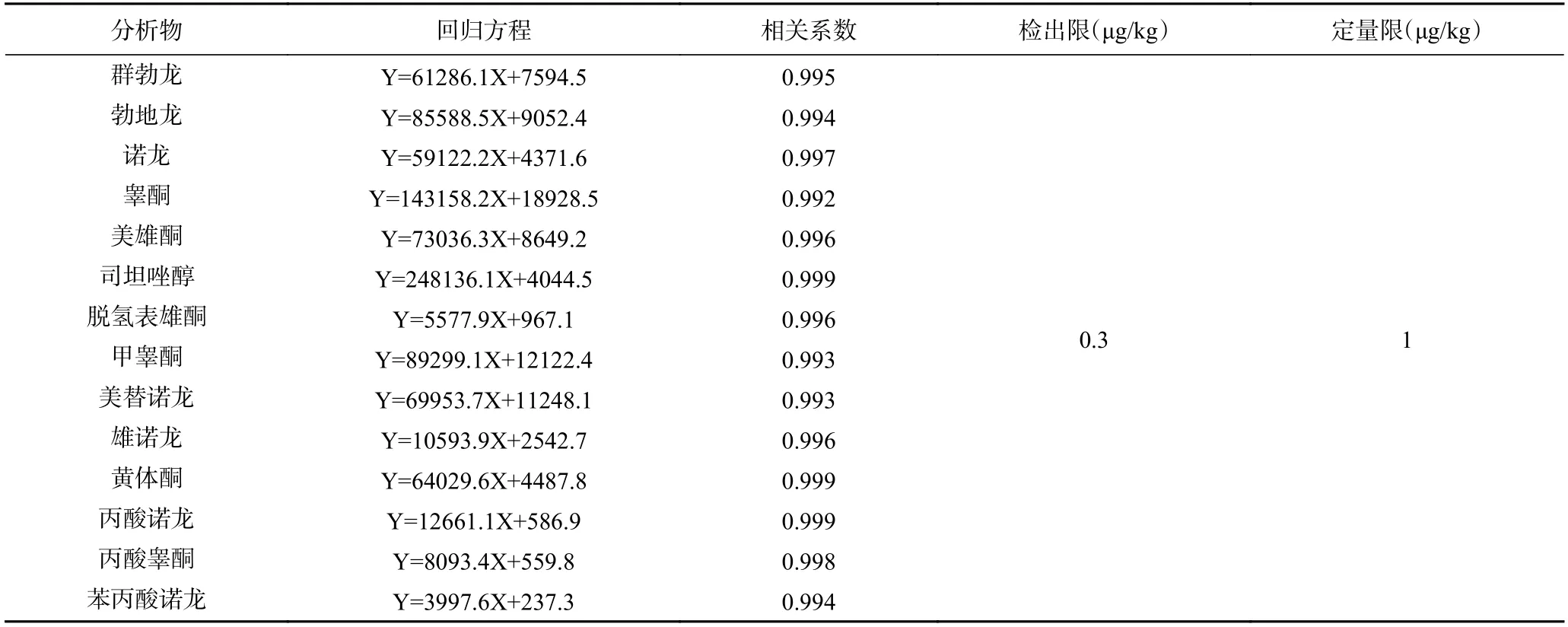
表3 14 种蛋白同化激素的线性关系及相关系数Table 3 Linear relationship and correlation coefficient of 14 anabolic androgenic steroids
试验考察了肌肉组织(猪肉、牛肉、羊肉)、调制肉(火腿、牛肉饼、咖喱肉、羊肉串)、肝脏组织(猪肝、猪肾)、牛奶和鸡蛋等动物源性食品,涉及的基质数目多数据量大,本文列举了复杂且具有代表性的猪肉、猪肝和火腿的加标回收率范围和精密度数据。试验分别选取不含14 种蛋白同化激素的猪肉、猪肝和火腿3 种不同类型样品为空白基质,在1.0、2.0和10 μg/kg 添加水平进行添加回收率试验,每个水平重复做六次,测得方法的平均回收率为75.7%~104.1%,精密度范围为3.60%~12.1%,符合规定的要求,其检测结果见表4。

表4 蛋白同化激素的回收率范围及精密度(n=6)Table 4 Average recovery ranges and RSDs (n=6) of anabolic androgenic steroids
2.7 实际样品的测定
分别对市售的16 批猪肉、10 批火腿、4 批牛肉饼、8 批羊肉串、7 批牛肉、5 批牛肝和24 批牛奶样品进行了14 种蛋白同化激素的检测,结果显示,74 批动物源性食品中除了黄体酮外均未检出其他13 种蛋白同化激素。牛奶中黄体酮的检出含量为1.1~3.6 μg/kg,检出率为10.2%。黄体酮是卵巢黄体分泌的一种天然内源性孕激素,在体内对雌激素激发过的子宫内膜有显著形态学影响,为维持妊娠所必须,因此在动物源性的食品中具有一定比例的检出率。在世界反兴奋剂机构《2021 年禁用清单国际标准》中未涉及黄体酮,因此目前国内外尚未有明确的限量规定。
3 结论
本实验建立了分散固相萃取-液相色谱-串联质谱法测定动物源性食品中14 种蛋白同化激素残留量。酶解后的样品经乙腈提取,乙腈饱和正己烷脱脂后,采用分散固相萃取净化结合基质外标法校正。结果表明,该方法前处理提取率高,条件易于控制,方法灵敏度高,重复性好,可为动物源性食品中该类物质的快速检测提供一定的技术支持。
