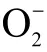荔枝草多糖的提取工艺优化及其体外抗氧化、降血糖活性分析
2022-10-11侯明明白美玉周丛丛张海燕
郭 畅,李 超,侯明明,白美玉,周丛丛,张海燕,
(1.河南大学生命科学学院,河南开封 475000;2.河南开封科技传媒学院理工学院,河南开封 475000)
荔枝草(R.Br)属于唇形科鼠尾草属,是一种可以食用的植物,广泛分布于各个国家和地区。民间通常用荔枝草来治疗感冒、流感、咳嗽、腹泻、哮喘以及各种炎症。近期的研究表明,荔枝草全草不仅含有黄酮、萜类、多酚、蛋白质等多种化合物,还包含微量元素、咖啡酸、芹菜素、脂质等其他多种活性成分。
多糖生物活性与其结构密切相关,研究如何从植物中高效的提取多糖,且避免破坏其结构是多糖研究的基础。时至今日,已经发展出了多种提取方式,如水提取法、酸碱提取法、超声辅助提取法、酶提取法和超临界流体萃取法等。水提取法的操作简单,绿色安全,多糖得率较高是最常见的多糖提取方法。碱提取法操作简单而且多糖得率高,是多糖提取较常用的方法之一,但碱液浓度不可过高,否则容易破坏多糖结构。酸提取法,相比于水提取法,多糖得率更高,提取次数较少,但酸对糖苷键的破坏作用较大,因此相比于其他方法酸提取法并不常见。此外,超声辅助提取法、酶提取法、超临界流体萃取法等方法也常出现在多糖提取的报道中,但是这些方法均具有设备要求高,提取成本高,能源消耗大等缺点。因此,本文在结合了成本、设备、操作等因素后选择使用水提取法和碱提取法来研究荔枝草多糖的提取工艺。
植物多糖类型繁多、来源广泛,具有抗氧化、抗肿瘤、抗凝血、抗炎等生物活性。但是,目前对于荔枝草的报道主要集中黄酮、萜类、多酚等方面,荔枝草多糖的研究却鲜见报道,因此,本文用水提取法和碱提取法探究了荔枝草粗多糖的提取工艺,将除过蛋白的两种粗多糖进行体外抗氧化和降血糖活性的比较和结构的初探,为后续开展荔枝草多糖的纯化、结构表征和生物活性研究奠定了一定的理论基础。
1 材料与方法
1.1 材料与仪器
荔枝草 采自南阳唐河,河南大学生命科学学院植物科学与技术系鉴定为唇形科鼠尾草属植物荔枝草(R.Br);葡萄糖 天津市德恩化学试剂有限公司;石油醚 上海麦克林生物化学公司;无水乙醇 天津市富宇精细化工有限公司;硫酸中平能化集团开封东大化工有限公司;苯酚 天津市大茂化学试剂厂;氢氧化钠 天津市科密欧化学试剂有限公司;盐酸 宿州化学试剂有限公司;DPPH 试剂 上海化成工业发展有限公司;ABTS 试剂 赛默飞世尔科技(中国)有限公司;邻苯三酚 上海麦克林生化科技有限公司;水杨酸、-淀粉酶 北京索莱宝科技有限公司;以上试剂 均为分析纯。
DHP-9162 电热鼓风干燥箱 上海—恒科学仪器有限公司;HH-4 数显恒温水浴锅 金坛市杰瑞尔电器有限公司;QE-100 克高速万能粉碎机 浙江屹立工贸有限公司;RE-52AA 旋转蒸发器 上海亚荣生化仪器厂;FA2004B 分析天平 上海天美天平仪器有限公司;SHB-Ⅲ循环水多用真空泵 郑州长城科工贸有限公司;KB3 匀浆器 海门市其林贝尔仪器制造有限公司;ZYROEU 双级反渗透型纯水机成都优普生物科技有限公司;EPOCH2 全波长酶标仪 美国伯腾仪器有限公司北京代表处;TU-1901全波段紫外分光光度计 北京谱析通用仪器有限责任公司;5810R 冷冻高速离心机 Eppendorf;Spectrum Two 型傅里叶红外光谱仪 珀金埃尔默仪器有限公司;QE-100 万能搅拌机 浙江屹立工贸有限公司。
1.2 实验方法
1.2.1 荔枝草粗多糖提取工艺
1.2.1.1 荔枝草药材的预处理 将鲜荔枝草用烘箱烘干后用粉碎机粉碎,然后将粉碎的药材过60 目筛,并将过筛后的药材粉末收集备用。称取100 g 处理好的药材与2 L 石油醚混合,室温搅拌处理12 h,并重复三次。抽滤,将石油醚挥干,即得除脂的荔枝草药材,收集备用。
1.2.1.2 水提取工艺 准确称取4 g 除脂的药材粉末,在一定的液料比、提取次数、提取时间和提取温度下提取粗多糖。然后离心(6000 r/min,10 min)收集上清液,负压浓缩后,向提取液中加入4 倍体积的无水乙醇,4 ℃过夜沉淀。离心(6000 r/min,10 min)收集沉淀,加入蒸馏水复溶,即得荔枝草粗多糖溶液,用苯酚-硫酸法检测粗多糖的浓度并计算得率。
1.2.1.3 碱提取工艺 准确称取4 g 除脂的药材粉末,在一定的液料比、提取次数、提取时间和提取温度、碱液浓度下提取粗多糖。然后离心(6000 r/min,10 min)收集上清液,将上清液的pH 调至中性,再次离心(6000 r/min,10 min),收集上清液后,负压浓缩,再向提取液中加入4 倍体积的无水乙醇,4 ℃过夜沉淀。离心(6000 r/min,10 min)收集沉淀,加入蒸馏水复溶,即得碱提粗多糖溶液,用苯酚-硫酸法检测粗多糖的浓度并计算得率。
1.2.1.4 蛋白去除工艺 参考王海茹等的方法。采用Sevag 法处理粗多糖溶液,至无明显蛋白质层,冷冻干燥即得到除蛋白的水提取荔枝草粗多糖(以下简称为水提粗多糖)和除蛋白的碱提取荔枝草粗多糖(以下简称为碱提粗多糖)。
1.2.2 单因素实验
1.2.2.1 水提取法 以粗多糖得率为指标,分析料液比、提取次数、提取时间和提取温度四个因素对粗多糖得率的影响。固定各因素水平,料液比1:25 g/mL,提取2 次,提取时间0.5 h,提取温度为80 ℃,改变各因素水平参数如下:料液比为1:10、1:15、1:20、1:25、1:30、1:35 g/mL 时,分析料液比对得率的影响;提取次数为1、2、3、4、5 次时,分析提取次数对得率的影响;提取时间为0.5、1、1.5、2、2.5、3、3.5 h时,分析提取时间对得率的影响;提取温度为60、70、80、90、100 ℃时,分析提取温度对得率的影响;根据单因素结果进行正交试验从而确定粗多糖的最佳提取工艺参数。
1.2.2.2 碱提取法 以粗多糖得率为指标,分析料液比、提取次数、提取时间、提取温度和碱液浓度五个因素对得率的影响。固定各因素水平,料液比1:25 g/mL,提取1 次,提取时间2 h,提取温度为80 ℃,碱液浓度0.3 mol/L,改变各因素水平参数如下:料液比为1:10、1:15、1:20、1:25、1:30、1:35 g/mL 时,分析料液比对得率的影响;提取次数为1、2、3、4、5 次时,分析提取次数对得率的影响;提取时间为0.5、1、1.5、2、2.5、3、3.5 h 时,分析提取时间对得率的影响;提取温度为60、70、80、90、100 ℃时,分析提取时间对得率的影响;碱液浓度为0.1、0.2、0.3、0.4、0.5、0.6 mol/L 时,分析碱液浓度对得率的影响。根据单因素结果进行正交试验从而确定粗多糖的最佳提取工艺参数。
1.2.3 正交试验
1.2.3.1 水提取法 在单因素实验的基础上,采用三因素三水平设计方案,选择料液比(A)、提取温度(B)和提取次数(C)三个因素,通过正交试验,优化荔枝草粗多糖提取工艺。试验因素与水平设计见表1。

表1 水提取法正交试验因素和水平Table 1 Factors and levels of orthogonal experiment of water extraction method
1.2.3.2 碱提取法 在单因素实验的基础上,采用三因素三水平设计方案,选择料液比(A)、提取温度(B)和碱液浓度(C)三个因素,通过正交试验,优化荔枝草粗多糖提取工艺。试验因素与水平设计见表2。

表2 碱提取法正交试验因素和水平Table 2 Factors and levels of orthogonal experiment of alkali extraction method
1.2.4 多糖含量的测定方法
1.2.4.1 标准曲线绘制 参考论文中的苯酚-硫酸法。以葡萄糖为标准品,绘制标准曲线,检测多糖含量。葡萄糖标准溶液:精确称取干燥葡萄糖20 mg,将浓度配制为0.2 mg/mL。标准曲线的绘制:吸取葡萄糖标准液0、0.1、0.3、0.5、0.7、0.9 mL 至于比色管中,用蒸馏水定容至1 mL,加入1 mL 5%苯酚溶液,用回旋振荡器充分混匀,迅速加入浓硫酸5 mL,室温反应30 min,用酶标仪在490 nm 处检测吸光值。以葡萄糖含量为x 轴,490 nm 处的吸光度为y 轴绘制葡萄糖标准曲线。得到葡萄糖标准曲线回归方程为:y=0.00569x+0.00786,R=0.998,可用于定量分析。
1.2.4.2 多糖得率的计算 用1.2.4.1 中的方法测定吸光度。并计算荔枝草粗多糖的得率,荔枝草多糖得率计算公式为:
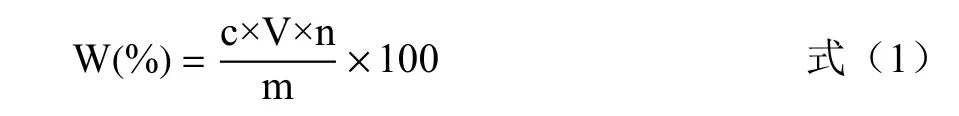
式中:W 表示多糖得率,%;c 表示根据回归方程计算出的粗多糖溶液质量浓度,mg/mL;V 表示粗多糖溶液体积,mL;n 表示溶液稀释倍数;m 表示荔枝草粉末取样量,g。
1.2.5 红外及紫外光谱解析
1.2.5.1 红外光谱 将冻干的两种粗多糖样品,使用红外光谱仪的通用衰减全反射(UATR )模式,在400~4000 cm的波数范围内测定。
1.2.5.2 紫外全波长扫描光谱 将冻干的两种粗多糖样品配制成1 mg/mL 的溶液,适当稀释后用全波段紫外分光光度计从200~400 nm 扫描。
1.2.6 抗氧化活性
1.2.6.1 DPPH 自由基清除率 参考王蔚新等中的方法。取不同浓度(0.05、0.1、0.2、0.4、0.8、1.6 mg/mL)的水提粗多糖和碱提粗多糖溶液进行实验,以相同浓度梯度下的抗坏血酸V为阳性对照,无水乙醇与DPPH 混合液为参比液,样品与无水乙醇混合液为背景对照,用酶标仪在517 nm 处测定两种粗多糖对DPPH 自由基的清除率,并参考姚佳等的方法计算两种粗多糖清除DPPH 自由基的IC,来评估多糖清除DPPH 自由基能力的高低。
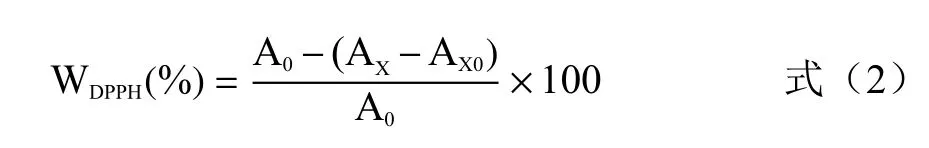
式中:W表示DPPH 自由基清除率,%;A表示参比液吸光度;A表示样品与DPPH 反应后吸光度;A表示背景对照吸光度。
1.2.6.2 ABTS自由基清除率 参考王蔚新等的方法。取与1.2.6.1 相同浓度梯度的多糖溶液进行实验,以抗坏血酸V为阳性对照,95%乙醇与ABTS工作液混合液为参比液,用酶标仪在734 nm 处测定两种粗多糖对ABTS自由基的清除率。并参考姚佳等的方法计算两种粗多糖清除ABTS自由基的IC,来评估多糖清除ABTS自由基能力的高低。
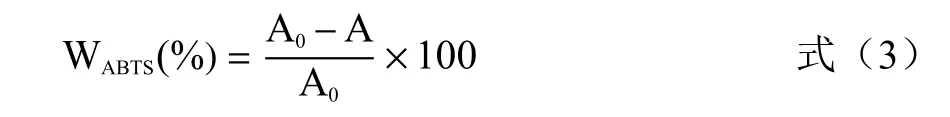
式中:W表示ABTS自由基清除率,%;A表示参比液吸光度;A 表示样品与ABTS 工作液反应后吸光度。


1.2.7 降血糖活性 参考严尚隆等的方法。探究不同浓度粗多糖对-淀粉酶的抑制率,阿卡波糖为阳性对照。取不同浓度(0.05、0.1、0.2、0.4、0.8、1.6、3.2、6.4、12.8 mg/mL)的粗多糖各1.2 mL,与1.2 mL 的-淀粉酶混匀,37 ℃水浴反应5 min 后,加入37 ℃水浴5 min 的1%淀粉1.2 mL,混匀置于37 ℃的水浴锅,反应15 min 后,立即加入2 mL DNS 溶液终止反应,沸水浴5 min 显色后,冰水浴15 min,适当稀释,测量540 nm 处的吸光度。

式中:W 表示-淀粉酶的抑制率,%;A表示样液替换为PBS 后重复实验的吸光度;A 表示样液和-淀粉酶都替换为PBS 后重复实验的吸光度;A表示样液反应后吸光度;A表示-淀粉酶替换为PBS后重复实验的吸光度。
1.3 数据处理
结果采用算术平均值和标准差表示(x ¯±s),数值统计采用SPSS 25 软件,通过单因素方差 One-way ANOVA 分析比较多组间的值以确定统计学上有无显著性差异。<0.05 表示具有统计学意义。
2 结果与分析
2.1 单因素实验
2.1.1 水提取法
2.1.1.1 料液比对粗多糖得率的影响 由图1A 结合多重比较可以看出,得率随着料液比的增大而增大,当料液比为1:20 g/mL 时得率达到最大为1.71%。这是由于干燥的药材吸水膨胀限制了多糖的溶出,当药材充分溶胀后,料液比的增加使植物细胞内外多糖浓度差增加,加速了多糖的溶出。考虑实际生产成本并结合多重比较的结果,选取1:10、1:20、1:25 g/mL 进行正交试验。
2.1.1.2 提取次数对粗多糖得率的影响 由图1B 可知,随着提取次数的增加,得率呈现显著增加(<0.05),从多重比较的结果来看,当达到4 次之后,得率变化不再显著(>0.05),因此,选取2、3、4 次进行正交试验。
2.1.1.3 提取时间对粗多糖得率的影响 由图1C 可知,提取时间对得率影响不显著(>0.05),这可能是因为药材粉末过细,多糖更易溶出。因此,将提取时间固定为0.5 h,对剩下其他进行正交试验。
2.1.1.4 提取温度对粗多糖得率的影响 图1D 可以看出,随着温度升高,得率显著增加(<0.05),提取温度为100 ℃时得率达到最大为2.49%。高温对植物细胞破坏明显,增加传质效率,使多糖加速溶出。故应选取80、90、100 ℃进行正交试验。
2.1.2 碱提取法
2.1.2.1 料液比对粗多糖得率的影响 由图1A 可以看出,随着料液比的增加,得率先增加再趋于稳定,料液比为1:15 时,得率最大为3.55%。因此,选取1:10、1:15、1:20 g/mL 进行正交试验。
2.1.2.2 提取次数对粗多糖得率的影响 由图1B 结合多重比较的结果可知,碱提取法中提取次数对得率几乎没有影响。原因可能是,碱液对植物细胞的破坏作用,极大的加速了多糖的溶出。实验结果与高宪军等的报道相似。综合考虑,将提取次数固定为1 次。
2.1.2.3 提取时间对粗多糖得率的影响 图1C 表明,得率随着提取时间增加显著(<0.05)上升,达到2.5 h 后得率不再有显著变化。结合实际生产成本后,将提取时间固定为2.5 h。
2.1.2.4 提取温度对粗多糖得率的影响 从图1D 中可以看到,与水提取法相似,随着提取温度升高,得率显著增加(<0.05)。在100 ℃下,得率高达6.16%。故应选取80、90、100 ℃进行正交试验。

图1 料液比(A)、提取次数(B)、提取时间(C)、提取温度(D)、碱液浓度(E)对粗多糖得率的影响Fig.1 Effects of solid-liquid ratio (A),number of extraction (B),extraction time (C),extraction temperature (D) and alkali concentration (E) on polysaccharide yield
2.1.2.5 碱液浓度对粗多糖得率的影响 碱液可以使多糖中的不溶性纤维素、半纤维素等与果胶多糖之间的键断裂,从而加速多糖的溶出提高得率。图1E 中,随着碱液浓度的增加,得率先显著(<0.05)上升,然后趋于稳定。从多重比较的结果来看,碱液浓度达到0.2 mol/L 后,得率不再有显著性变化(>0.05)。因此选取0.1、0.2、0.3 mol/L 进行正交试验。
2.2 正交试验结果
2.2.1 水提取法正交试验结果 设计三因素三水平正交试验表进行试验。正交实验表见表3,方差分析表见表4。
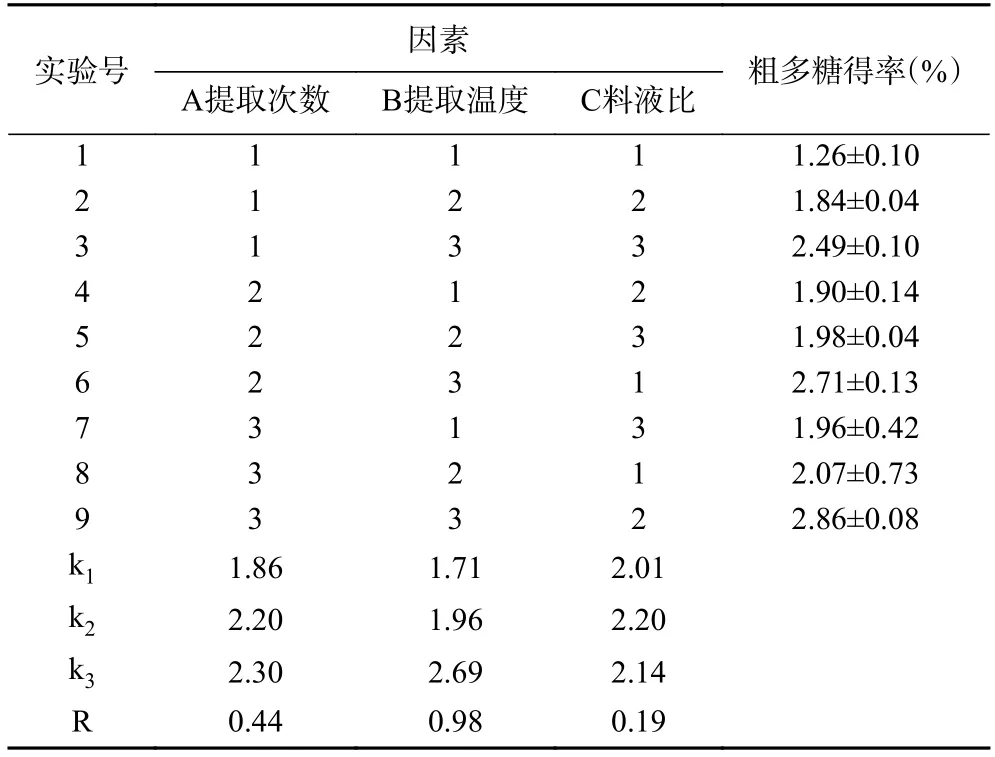
表3 水提取法正交试验结果Table 3 Orthogonal test results of water extraction method
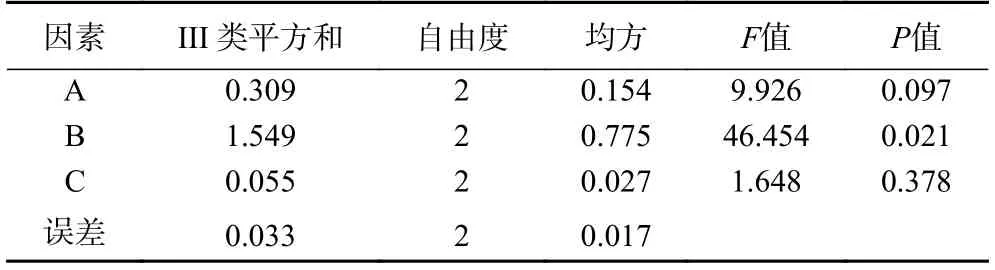
表4 水提取法方差分析结果Table 4 Analysis of variance of water extraction method
由直观分析表可知,对水提荔枝草粗多糖得率影响由大到小依次为:B>A>C,提取温度对水提荔枝草粗多糖得率影响最大,而提取次数和料液比影响较小。在综合极差R 值之后,水提荔枝草粗多糖最佳提取工艺为:ABC,即提取次数为4 次,提取温度为100 ℃,料液比为1:20 g/mL,得率为2.86%±0.08%。
2.2.2 碱提取法正交试验结果及分析 设计三因素三水平正交试验表进行试验。正交实验表见表5,方差分析表见表6。

表5 碱提取法正交试验结果Table 5 Orthogonal test results of alkali extraction method
由直观分析表6 可知,对碱提荔枝草粗多糖得率影响由大到小依次为:B>A>C,提取温度对碱提荔枝草粗多糖得率影响最大,而料液比影响最小。在综合极差R 值之后,碱提荔枝草粗多糖最佳提取工艺为:ABC,即碱液浓度为0.3 mol/L,提取温度为100 ℃,料液比为1:15 g/mL,得率为7.15%±0.11%。

表6 碱提取法方差分析结果Table 6 Analysis of variance of alkali extraction method
2.3 红外及紫外光谱解析
2.3.1 红外光谱 由图2 可知,水提粗多糖和碱提粗多糖具有相似的峰,说明二者含有部分一致的官能团。两种粗多糖分别在3299 和3283 cm处有宽而强的吸收峰,存在于O-H 和N-H 的伸缩振动区间内,因此判断,两种粗多糖中可能含有O-H 和N-H,又因为在1560~1508 cm区间内无吸收峰,因此多糖结构中不含有N-H,所以在3299 和3283 cm处的峰为O-H 的伸缩振动。两种粗多糖分别在2936 和2941 cm处的吸收峰是由多糖结构中饱和碳上的C-H 伸缩振动引起的,此处的吸收峰为多糖的特征吸收峰。此外,水提粗多糖在1739 cm处的较强的吸收峰,在羰基的伸缩振动在1900~1650 cm区间内,再结合尹艳中的报道,表明水提粗多糖结构中存在羰基。1599 和1584 cm处的吸收峰为羧基上O-C=O 的非对称伸缩振动,1414和1391 cm处的吸收峰为去质子化羧基-COOH 的伸缩振动,两种粗多糖分别在这两处有吸收峰,说明粗多糖结构中均存在糖醛酸结构。在1200~1000 cm范围内的强吸收带是由于多糖结构中CO-C 和C-O-H 基团的拉伸振动引起的。此外,在1020 cm处的吸收峰为吡喃糖的伸缩振动,同时在约890 和855 cm附近都观察到特征峰,这表明水提粗多糖中既含有构型又含有构型。在碱提粗多糖则没有吡喃糖的特征吸收峰,因此推测,碱液提取时造成了多糖结构中吡喃糖的破坏。

图2 两种粗多糖的红外光谱扫描图Fig.2 Infrared spectrum scanning diagram of two crude polysaccharides
2.3.2 紫外全波长扫描光谱 由于蛋白质和核酸在近紫外光区(220~300 nm)有紫外吸收峰,其含量的高低与峰高有关,因此全波段紫外分光光度计可以用来快速检测多糖样品中是否残留有游离的蛋白质和核酸。从图3 中可以看出,水提多糖和碱提多糖在近紫外光区(220~300 nm)均无明显吸收峰,说明两种多糖样品中不含有游离蛋白质和核酸。
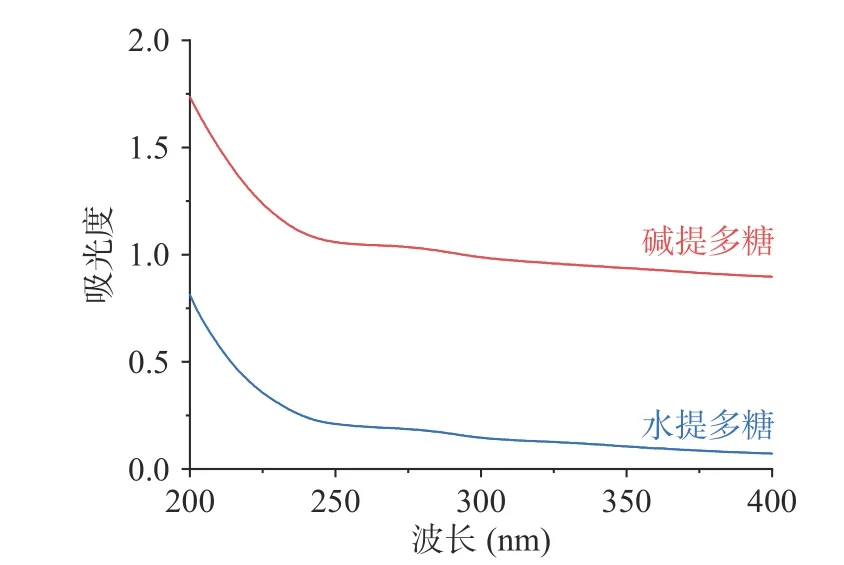
图3 两种粗多糖的紫外光谱扫描图Fig.3 UV spectra of two crude polysaccharides
2.4 抗氧化活性及降血糖活性
2.4.1 DPPH 自由基清除能力 由图4 可知,在0.05~0.4 mg/mL 的浓度范围内,随着粗多糖浓度的增加,对DPPH 自由基的清除率呈现依赖剂量的显著性增加(<0.05)。两种粗多糖的浓度达到0.4 mg/mL时,清除率达到最高,分别为81.23%和45.02%,此后水提粗多糖剂量增加清除率作用趋于平缓,而碱提粗多糖随着剂量继续增加清除率开始下降,下降的原因可能与碱提粗多糖含有的色素有关。水提粗多糖对清除DPPH 自由基的IC为0.1260 mg/mL,而碱提粗多糖的清除率未达到50%。水提粗多糖清除DPPH 自由基的能力远高于碱提粗多糖,这可能是因为碱液破坏了多糖的部分官能团造成的。

图4 两种粗多糖对DPPH 自由基的清除能力Fig.4 Scavenging ability of two crude polysaccharides to DPPH free radical
2.4.2 ABTS自由基清除能力 由图5 可知,在0.05~0.4 mg/mL 的浓度范围内,随着两种粗多糖浓度的增加,二者对ABTS自由基的清除率均呈现依赖剂量的显著性增加(<0.05)。当水提粗多糖浓度达到0.2 mg/mL、碱提粗多糖浓度达到0.4 mg/mL 时,二者清除率分别高达88.70%和88.07%,与V的清除能力持平,说明二者均有很高的ABTS自由基清除能力。两者对清除ABTS自由基的IC分别为0.0841 和0.1229 mg/mL。

图5 两种粗多糖对ABTS 自由基的清除能力Fig.5 Scavenging ability of two crude polysaccharides to ABTS+ free radical


图6 两种粗多糖对超氧阴离子自由基的清除能力Fig.6 Scavenging capacity of two crude polysaccharides to superoxide anion free radical
2.4.4 降血糖活性-淀粉酶等酶可以在餐后快速将碳水化合物降解为单糖,导致胰岛素和血糖的升高。因此,抑制-淀粉酶的活性,减缓碳水化合物的水解,降低餐后血糖的上升,是预防和治疗二型糖尿病的有效手段。在二型糖尿病的治疗中,阿卡波糖使用了数十年,具有十分显著的疗效。因此被本实验选为水提多糖和碱提多糖的阳性对照。
如图7 所示,在0.05~12.8 mg/mL 区间均呈现上升趋势。在浓度为12.8 mg/mL 时,两种粗多糖对-淀粉酶达到最大抑制率分别为20.15%和11.46%,但两种粗多糖对-淀粉酶具有一定的抑制作用。与水提粗多糖相比,碱提粗多糖的抑制活性更低。碱液对多糖的结构的破坏可能是造成这种差异的原因。
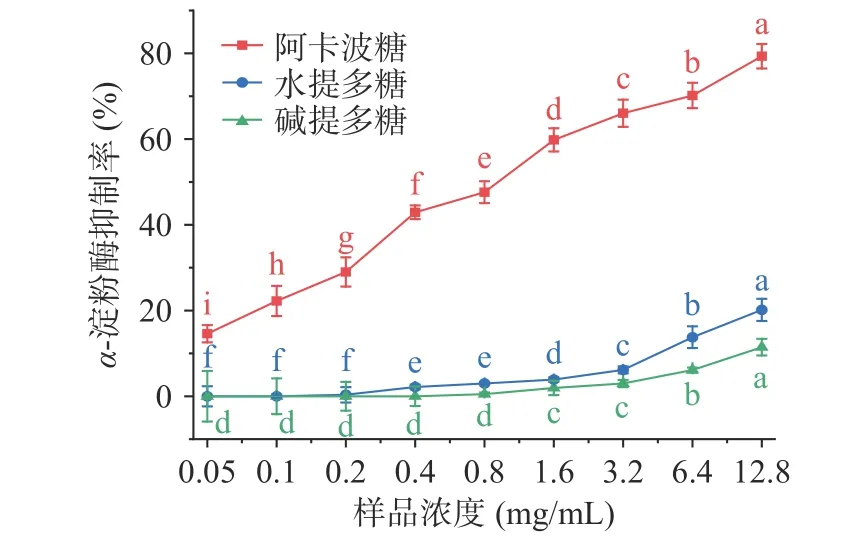
图7 两种粗多糖对α-淀粉酶的抑制能力Fig.7 Effects of two crude polysaccharides on inhibition of αamylase
3 讨论