蒲公英水提多酚的脲酶抑制作用及机理
2022-10-11李燕妮陈义伦
吴 萍,李燕妮,邹 辉,陈义伦
(山东农业大学食品科学与工程学院,山东泰安 271018)
脲酶(Urease,EC 3.5.1.5),又称尿素胺基水解酶,能够水解尿素生成氨和氨基甲酸酯。在人体胃部,幽门螺旋杆菌脲酶作为定植因子和毒力因子,催化尿素水解以提高胃部pH,导致一系列胃部病变,如胃溃疡、萎缩性胃炎、肠化生及异型增生,甚至发展为胃癌。天然及合成的脲酶抑制剂可干扰尿素与催化位点的结合,降低脲酶的催化活性,减少幽门螺旋杆菌的感染及对人体的危害。
研究表明尿素类似物、氧肟酸类、磷酰胺酯类、醌类、杂环化合物以及植物多酚等可以直接或间接地抑制幽门螺旋杆菌脲酶活性。直接作用于脲酶催化活性中心与尿素竞争结合位点的抑制剂属于竞争性抑制剂,包括尿素类似物和磷酰胺酯类;作用于非催化活性中心的抑制剂属于非竞争性抑制剂,包括巯基乙醇和氧肟酸类等。虽然上述多种物质均具有抑制脲酶活性的作用,但因副作用强、耐药性高和成本高等弊端而发展前景有限。来源于植物中的生物活性物质副作用小、耐药性差且成本低,如植物多酚,具有良好的抑制幽门螺旋杆菌脲酶的作用。黄芩苷能够与脲酶活性位点的巯基结合,属于竞争性-缓慢结合型脲酶抑制剂。槲皮素可通过羟基作用于脲酶的flap 区域,属于非竞争性抑制类型。此外,染料木素、芦丁、杨梅素、杨梅苷和木犀草素等多酚对幽门螺旋杆菌脲酶也有明显的抑制作用。
蒲公英()是一种药食两用的天然草本植物,其水提多酚可抑制幽门螺旋杆菌定植,预防胃部病变。但蒲公英水提物中的主要抑酶多酚成分尚未明确,且抑制作用机理仍不清晰。不同来源脲酶的单体具有高度保守的氨基酸序列,活性区域的结构大致相似,而植物来源的洋刀豆脲酶,因其易获得性而成为脲酶抑制剂前期研究中的模式酶。本实验选取洋刀豆脲酶为受体蛋白,以蒲公英全草为材料,通过液质联用法(High Performance Liquid Chromatography-Mass Spectrometry,HPLC-MS)和分子对接法筛选了蒲公英水提物中的主要抑酶多酚,研究了其抑酶效果和抑制类型,并采用荧光分析法结合分子对接分析了抑酶作用机制,以期为蒲公英多酚应用于脲酶抑制剂的开发提供理论依据。
1 材料与方法
1.1 材料与仪器
碱地蒲公英全草粉(3000 目) 含水量7.77%,产于河北保定,购于泰安药材市场;洋刀豆脲酶Sigma-Aldrich 贸易有限公司;菊苣酸(纯度≥98%)成都仪睿生物科技有限公司;咖啡酸(纯度≥98%)、XAD-7 大孔树脂 上海麦克林生化科技有限公司;尿素、乙二胺四乙酸、亚硝基铁氰化钠、无水乙醇(色谱纯)、甲醇(色谱纯)及其他有机溶剂 天津市凯通化学试剂有限公司;氯化锂 北京索莱宝科技有限公司;苯酚、磷酸氢二钾 国药集团化学试剂有限公司。
TGL16M 台式高速冷冻离心机 长沙英泰仪器有限公司;QL-901 涡旋机 海门市其林贝尔仪器制造有限公司;恒温恒湿培养箱 上海华邻实业有限公司;SpectraMax M5 酶标仪 上海美谷分子仪器;LTQ-Orbitrap Elite 组合型高分辨质谱仪 赛默飞世尔科技有限公司。
1.2 实验方法
1.2.1 蒲公英水提多酚制备及定性定量分析 称取30 g 蒲公英全粉溶于300 mL 的去离子水中,超声30 min 后,以8000 r/min 的离心速率离心10 min,取上清液过滤后,用XAD-7 大孔树脂纯化,旋蒸浓缩,冷冻干燥。制得蒲公英水提多酚。
HPLC 条件:C色谱柱(4.6 mm×250 mm,5 μm),流动相A:纯水(1‰甲酸),流动相B:甲醇(1‰甲酸)。紫外检测器的检测波长为280 nm,流速0.3 mL/min,进样体积5 μL。梯度洗脱程序:0~1 min,2%B;1~9 min,2%~98%B;9~12 min,98%B。
MS 条件:电喷雾电离离子源,负离子模式;毛细管电压3.5 kV;脱溶剂气温度325 ℃;质谱扫描范围m/z 100~1000。
根据一级质谱离子峰面积外标法(选择离子模式)进行定量分析,选取含量大于6%的多酚;再通过二级质谱碎片离子的m/z(子离子模式)结合文献报道进行定性分析,确定含量大于6%的多酚种类。
1.2.2 蒲公英多酚与洋刀豆脲酶的分子对接分析以洋刀豆脲酶(PDB ID:1E9Z)为受体蛋白,四种多酚为小分子配体,用Ledock 软件进行对接,每种配体的对接模型为50 个,根据模型的对接能量分析其抑酶作用。
1.2.3 菊苣酸、咖啡酸和蒲公英水提多酚对脲酶的抑制率的测定 用苯酚-次氯酸盐比色法(Berthelot Method)测定抑制率,溶剂为磷酸盐缓冲溶液(10 mmol/L磷酸氢二钾,1 mmol/L EDTA,10 mmol/L 氯化锂);按照1.2.1 测定的蒲公英水提多酚中菊苣酸和咖啡酸的含量配制相应质量浓度比例的样品溶液,即菊苣酸,咖啡酸和蒲公英水提多酚的质量浓度分别为0.2124、0.1478 和2 g/L,各100 μL;脲酶质量浓度为0.25 g/L,100 μL;显色剂A 液(0.005%亚硝基铁氰化钠,1%苯酚),100 μL;显色剂B 液(0.5%氢氧化钠,0.1%次氯酸钠),100 μL。
具体操作如下:取2 mL 的离心管,以溶剂为空白对照,将抑制剂加入到脲酶溶液中,用涡旋机混匀,于37 ℃条件下反应30 min,加入50 mmol/L 的尿素100 μL,于37 ℃孵育60 min 后加入显色剂(先加A液再加B 液)反应10 min,取200 μL 于96 孔酶标板,在625 nm 条件下测定吸光度。根据公式(1)计算抑制率。
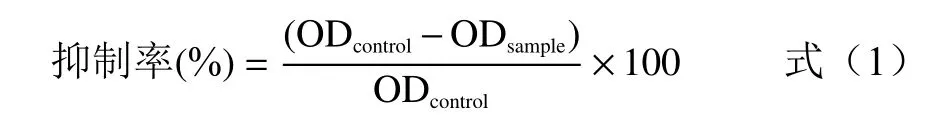
式中:OD为空白组的吸光度值;OD为添加抑制剂组的吸光度值。
1.2.4 菊苣酸和咖啡酸的脲酶半数抑制浓度(IC)的测定 以乙酰氧肟酸为对照,质量浓度为0.25 g/L的脲酶溶液各100 μL,抑制剂分别为菊苣酸溶液(0、0.125、0.25、0.375、0.5、0.625、0.75、0.875、1 mmol/L)/咖啡酸溶液(0、0.5、1、1.5、2、2.5、3、3.5、4 mmol/L)/乙酰氧肟酸溶液(0、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8 mmol/L),各100 μL。具体操作见1.2.3,并求得各抑制剂的IC。
1.2.5 菊苣酸和咖啡酸抑制脲酶的荧光猝灭分析将100 μL 的菊苣酸/咖啡酸(浓度均为0、6、12、18、24、30 μmol/L)分别与100 μL 质量浓度为0.25 g/L 的洋刀豆脲酶溶液于96 孔酶标板中混合。荧光测试条件为激发波长280 nm,发射波长范围290~360 nm,振动5 s,温度37 ℃。测得不同浓度菊苣酸/咖啡酸与洋刀豆脲酶溶液的荧光强度,并根据Stern-Volmer方程(2)计算猝灭常数。根据公式(3),确定结合位点数n 和结合常数K,并分析荧光猝灭规律及机制。

式中:F和F 分别是抑制剂不存在和存在的荧光强度;[Q]是抑制剂的浓度;K是荧光猝灭常数;K是荧光猝灭速率常数,反映了体系中分子的彼此扩散和相互碰撞对生物大分子荧光寿命衰减速率的影响;为猝灭剂不存在时荧光分子的平均寿命。

式中:K 为结合常数;n 为结合位点数。
1.2.6 菊苣酸和咖啡酸抑制脲酶活性的抑制类型的确定 用Lineweaver-Burk 双倒数作图法,根据方程(4)以尿素浓度的倒数为横坐标,相对吸光度值的倒数为纵坐标作图。计算动力学参数K(结合常数)和V(最大反应速度),确定菊苣酸/咖啡酸抑制洋刀豆脲酶的抑制类型。
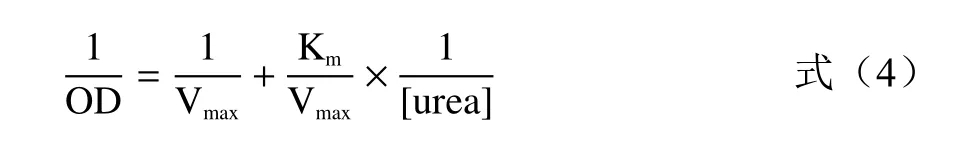
式中:OD 为空白组的吸光度值与添加抑制剂的吸光度的差值;[urea]为尿素浓度,mmol/L;K为米氏常数,其值为最大反应速度V一半时的底物浓度。
1.2.7 菊苣酸和咖啡酸抑制脲酶的关键氨基酸和相互作用力分析 以洋刀豆脲酶(PDB ID:1E9Z)为受体蛋白,菊苣酸和咖啡酸分别为小分子配体,用icm软件进行对接。分析菊苣酸和咖啡酸与洋刀豆脲酶作用位点的作用力和关键氨基酸。
1.3 数据处理
2 结果与分析
2.1 蒲公英水提多酚抑制脲酶的主要组分筛选
蒲公英水提多酚的特征含量与其抑制脲酶活性的强弱有关,采用质谱离子峰面积外标法确定多酚含量。据表1,蒲公英水提物中含量最高的四种多酚的峰面积占比均大于6%,且峰面积占比之和大于30%,除第五种多酚的峰面积占比约为4.33%外,其他多酚均低于4%。据其碎片离子的质荷比,可确定这四种多酚按含量从高到低依次为菊苣酸>咖啡酸>七叶内酯>没食子酸单水合物。其中,菊苣酸和咖啡酸的含量之和占蒲公英水提总多酚的18.10%,是含量最高的两种多酚,与Katrin 等的测定结果一致。

表1 蒲公英多酚的定性、定量分析Table 1 Qualitative and quantitative analysis of dandelion polyphenols
多酚结构中的羟基也可影响其抑酶效果,将四种多酚分别与洋刀豆脲酶进行对接,结合能量越高,对脲酶的亲和力越强。结果如图1(a),结合能量从高到低依次为菊苣酸>咖啡酸>没食子酸单水合物>七叶内酯。由图1(b)可知,菊苣酸结构中含有的羟基数目最多,共6 个,可推测多酚对脲酶的亲和力与羟基数目有关。没食子酸单水合物比咖啡酸含有的羟基多,结合能量却略低于咖啡酸,可能由于其苯环上的3 个邻位羟基产生的空间位阻效应,影响了没食子酸单水合物与洋刀豆脲酶的结合。七叶内酯含有的羟基数目最少,与脲酶的结合能量最低。

图1 四种蒲公英水提多酚作用于洋刀豆脲酶的结合能量和分子结构Fig.1 Binding energy against jack bean urease and structures of four dandelion water-extracted polyphenols
通过相对含量和对接能量两个方面筛选蒲公英中的主要抑酶多酚,结果表明菊苣酸和咖啡酸不仅是蒲公英水提多酚中含量最高的,而且是与洋刀豆脲酶亲和力最强的多酚。
采用苯酚-次氯酸盐比色法验证菊苣酸和咖啡酸的抑酶作用,结果如表2,菊苣酸和咖啡酸混合组对脲酶的抑制率占蒲公英水提总多酚的75.76%。由此可推断,蒲公英水提多酚中发挥抑制脲酶活性作用的主要多酚是菊苣酸和咖啡酸。

表2 菊苣酸和咖啡酸与蒲公英水提总多酚的抑酶活性Table 2 Anti-enzyme activity of cichoric acid,caffeic acid and dandelion water-extracted polyphenols
2.2 菊苣酸和咖啡酸的脲酶抑制效果
按照1.2.3 的方法,以乙酰氧肟酸为阳性对照,测定菊苣酸和咖啡酸对洋刀豆脲酶的抑制效果。结果如图2 所示,乙酰氧肟酸的抑制效果最强,IC值为0.14±0.08 mmol/L,菊苣酸和咖啡酸的IC值分别为0.34±0.07 和3.04±0.68 mmol/L。乙酰氧肟酸因抑制效果显著已用于临床,但持续使用有致畸、致突变作用。虽然菊苣酸和咖啡酸的抑制效果不及乙酰氧肟酸,但作为天然无毒副作用的脲酶抑制剂仍表现出低浓度高效性和浓度依赖性的抑酶作用。菊苣酸比咖啡酸的抑酶效果强,可能是由于菊苣酸可水解生成两个咖啡酸,比咖啡酸的羟基数目多,羟基数目的增多可能会增强抑酶效果。

图2 菊苣酸(a)、咖啡酸(b)和乙酰氧肟酸(c)与洋刀豆脲酶作用的IC50Fig.2 IC50 of cichoric acid (a),caffeic acid (b) and acetohydroxamic acid (c) against jack bean urease
2.3 菊苣酸和咖啡酸抑制脲酶的机理分析
2.3.1 荧光猝灭分析 洋刀豆脲酶内源荧光的主要供体是色氨酸,当激发波长为280 nm 时,色氨酸可产生荧光。在猝灭剂存在的情况下,荧光发射峰出现的蓝移和红移现象可表明菊苣酸和咖啡酸是否与洋刀豆脲酶存在相互作用。菊苣酸和咖啡酸与洋刀豆脲酶均在发射波长为318 nm 处有最大发射峰(λ)。如图3(a)所示,当反应体系中菊苣酸的浓度增大后,λ发生微弱偏移,从318 nm 移动到317 和316 nm。如图3(b)所示,咖啡酸浓度增大,从318 nm 移动到317 nm。表明菊苣酸和咖啡酸与洋刀豆脲酶发生了相互作用,改变了洋刀豆脲酶中色氨酸的微环境,且峰值随着抑制剂浓度的增大而减小,表明菊苣酸和咖啡酸对洋刀豆脲酶为浓度依赖性的猝灭作用。

图3 不同浓度菊苣酸(a)和咖啡酸(b)与洋刀豆脲酶作用的荧光强度Fig.3 Fluorescence intensity of different concentrations of cichoric acid (a) and caffeic acid (b) with jack bean urease
由图4 和表3 可知,菊苣酸和咖啡酸的荧光猝灭速率常数K为10数量级,远大于生物大分子的最大散射碰撞速率常数2.0×10L/mol/s,可推断猝灭机制均为静态猝灭。即菊苣酸和咖啡酸与色氨酸在基态时发生配合反应,生成了不发光的基态化合物。结合位点数n 约为2,表明菊苣酸和咖啡酸与洋刀豆脲酶均存在2 个结合位点。菊苣酸对洋刀豆脲酶的K值和K 值均大于咖啡酸,说明菊苣酸对洋刀豆脲酶的抑制能力更强。结果与半数抑制浓度测定的结果一致。

表3 菊苣酸和咖啡酸与洋刀豆脲酶相互作用的参数Table 3 Interaction parameters of cichoric acid and caffeic acid against jack bean urease

图4 菊苣酸和咖啡酸与洋刀豆脲酶作用的荧光分析Fig.4 Fluorescence analysis of different concentrations of cichoric acid and caffeic acid against jack bean urease
2.3.2 菊苣酸和咖啡酸对脲酶的抑制动力学分析通过动力学参数K和V随抑制剂浓度的变化规律可推断酶抑制剂的作用类型。据图5 和表4 可知,菊苣酸/咖啡酸的存在并未改变K的大小(无显著性差异);菊苣酸/咖啡酸浓度增大,V均逐渐减小。由此可知,菊苣酸和咖啡酸对脲酶的抑制作用为非竞争性抑制类型。菊苣酸和咖啡酸通过与洋刀豆脲酶催化活性中心外的必需基团结合,从而影响洋刀豆脲酶的活性,与尿素的浓度无关。其他植物多酚如黄芩苷和槲皮素作用于脲酶的抑制类型是非竞争性抑制类型,与本实验结论一致。
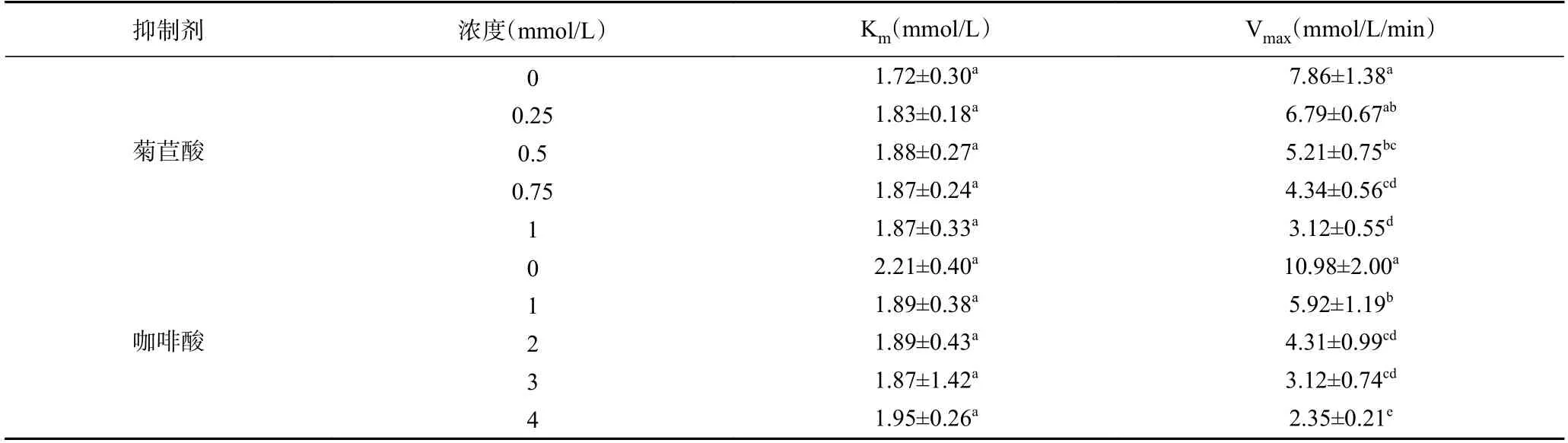
表4 不同浓度菊苣酸和咖啡酸对洋刀豆脲酶动力学参数的影响Table 4 Effect of different concentrations of cichoric acid and caffeic acid on the kinetic parameters of jack bean urease

图5 Lineweaver-Burk 双倒数作图法测定菊苣酸(a)和咖啡酸(b)的动力学参数Fig.5 Determination of kinetic parameters of cichoric acid(a) and caffeic acid (b) by Lineweaver-Burk
2.3.3 菊苣酸/咖啡酸与脲酶的相互作用力分析 洋刀豆脲酶被激活后,flap 区域的活动是影响其催化效果的关键。图6 的分子对接结果显示,菊苣酸和咖啡酸与洋刀豆脲酶的同一位点结合,即镍离子活性中心上的flap 区域,限制了flap 区域的闭合,导致脲酶活性降低。进一步分析相互作用的关键氨基酸和作用力,如图7(a)所示,与菊苣酸形成氢键的主要氨基酸残基包括Asp-730、Glu-718、Glu-742、Gln-82、Ala-80、Lys-716;形成碳氢键的主要氨基酸残基为Val-81;产生范德华力的主要氨基酸残基有Phe-712、Lys-709、Lys-745、Val-744、Val-36、Tyr-32、Ala-16、Ala-37、Met-746、Thr-33、Thr-740、Pro-743、Leu-13。如图7(b)所示,与咖啡酸形成氢键的主要氨基酸残基包括Glu-718、Val-744;形成范德华力的主要氨基酸残基有Lys-709、Phe-712、Lys-745、Met-746;形成Π 键的有Asp-730 和Lys-716。其中,菊苣酸和咖啡酸均与Glu-718 形成氢键,与Lys-709、Phe-712、Lys-745、Met-746 产生范德华力。与槲皮素抑制脲酶的作用方式相似,上述非共价相互作用力可能为抑制剂作用于脲酶提供稳定的空腔,以便flap 区域相关氨基酸残基的活动,降低了尿素与脲酶活性中心结合的概率。

图6 菊苣酸(a)和咖啡酸(b)与洋刀豆脲酶的复合物结构Fig.6 Docking structure of cichoric acid (a) and caffeic acid (b)with jack bean urease

图7 菊苣酸(a)和咖啡酸(b)与脲酶相互作用的关键氨基酸及相互作用力Fig.7 Key amino acids and interaction power of cichoric acid (a) and caffeic acid (b) against urease
3 结论
是蒲公英水提多酚中抑制洋刀豆脲酶活性的主要多酚,含量分别为10.62%和7.39%。半数抑制浓度分别为0.34±0.07 和3.04±0.68 mmol/L,均呈浓度依赖性抑制,菊苣酸的抑酶效果强于咖啡酸,抑制类型均为以氢键和范德华力为主的非竞争性抑制类型,且荧光猝灭机制为静态猝灭。本研究从蒲公英水提多酚的特征含量入手进行分析,其它多酚或多组分的抑酶作用及机理需进一步研究探讨,以更深入全面地阐明蒲公英多酚抑制脲酶活性的作用机制。
