建兰组织培养再生体系培养基优化
2022-10-10李文建韩宵林李芳菲李蕾蕾武振江刘瑞芳谢朝晖
李文建,韩宵林,李芳菲,李蕾蕾,武振江,刘瑞芳,谢朝晖
(河南城建学院 生命科学与工程学院,河南 平顶山 467036)
建兰的繁殖方式主要有3种,分别为种子繁殖、分株繁殖和组织培养。种子繁殖常败育,繁殖系数和培养效率均较低。分株繁殖需母株长至一定程度及大量前期芽体培育方可实现,不易实现规模化生产。传统杂交育种周期长,且成功率较低,不利于实现规模化生产。而组织培养能够有效应对以上难题,在园艺植物生产中应用越来越广泛[1-2]。
近年来,关于国兰组织培养再生快繁的研究报道很多。许申平等[3]以成熟墨兰种子诱导根状茎为材料,研究其根状茎增殖、芽分化及生根等不同阶段的诱导情况。付秀芹等[4]以蕙兰种子、根状茎及无菌苗为试材,对种子萌发、根状茎增殖及其分化等阶段的适宜培养基进行研究,并探讨了无菌苗的移栽基质,初步优化建立了蕙兰组培的快繁体系。孙玉芬等[5]以春兰与大花蕙兰杂交后代根状茎为材料进行培养,筛选适合根状茎增殖与分化的条件,研究比较不同基本培养基、植物生长调节物质和有机添加物等对根状茎增殖与分化的影响。李玉萍等[6]以春兰与大花蕙兰杂交种原球茎和无根幼苗为材料,研究激素对原球茎分化的影响以及激素与香蕉泥对诱导生根状况的影响。
而关于建兰组织培养再生快繁的研究报道较少。贾勇炯等[7]以建兰腋芽为外植体,用B5和MS为基本培养基,优化激素条件,成功地诱导了簇生原球茎、假根茎及其分化的营养芽和花芽;通过连续光照,花芽可在试管内开花;并探讨了椰乳对原球茎诱导的正向作用以及活性炭对防止褐化、促进根系生长等方面的影响。贾勇炯等[8]以彩心建兰花芽为材料,选取幼嫩花枝上部茎节切段,用MS为基本培养基,通过器官发生直接分化出了花芽和营养芽。叶秀仙等[9]以素心建兰种子为外植体,研究不同的培养基(1/2MS、花宝1号、改良MS)和激素(6-BA、TDZ、NAA)等关键因子对种子萌发、根状茎增殖、分化等阶段的影响,研探了素心建兰无菌播种快繁关键技术。李承秀等[10]用正交试验研究基本培养基、激素用量以及不同附加物对瓶苗诱导根分化生长的影响,通过无菌播种培养获得了原球茎,优化生根培养基,并以水苔为基质完成了炼苗试验。
本文从基本培养基和植物激素组合处理等方面,查阅相关研究文献,开展建兰再生体系培养基激素条件优化,筛选建兰不同培养阶段所需的最佳培养基配方,为建兰组织培养快繁技术应用提供参考。
1 材料与方法
1.1 试验材料
建兰植株品种为“龙福星蝶”,取材时正值盛花期,研究所需花芽、茎尖组织较为充足。本研究所用建兰植株均源于同一植株及其芽分化子代,减少生理活性差异引起的组织脱分化与再分化速率不同步效应。
基本培养基组成:MS培养基+蔗糖(30 g/L)+琼脂粉(6 g/L)。
1.2 外植体获取、预处理及消毒
本研究用建兰花茎和茎尖作为试验材料。
(1)花茎:取建兰幼嫩花茎,长度约为3~7 cm,用自来水冲洗,通过无菌操作剥去外层苞叶,将所取花茎切成多个小段,长度约1~3 cm,每个切段带一茎节。
(2)茎尖:取叶片未展开的健壮新芽,自来水下冲洗,通过无菌操作剥去外层叶片,切除茎尖基部伤口褐变部分,切取顶端新芽,长度约2~5 mm。
(3)材料消毒:以上2种材料经预处理,再依照设计用量放入无菌小烧杯,在超净工作台上进行如下操作:75 %酒精浸泡15 s,再用0.05%的升汞消毒7 min,最后用无菌水冲洗4~5次。
1.3 接种培养
(1)原球茎诱导:用2种材料进行起始培养,每处理外植体接种个数120个,每瓶接种6个,共接种20瓶,分别于30 d、40 d及50 d观察其诱导分化情况。
(2)不定芽诱导:上步获得的培养材料,每处理接种个数为12个,每瓶接种4个,共接种3瓶,分别于20 d、30 d及40 d观察其不定芽诱导情况。
(3)生根诱导:每处理接种12个,每瓶接种4个,共接种3瓶,分别于10 d、15 d及20 d观察其生根诱导情况。
1.4 不同培养基对建兰不同再生阶段诱导效果的影响
针对建兰组织培养不同再生阶段,并结合不同培养阶段处理数,进行培养基及激素条件的配比组合设计[1,2,7-10](表1)。
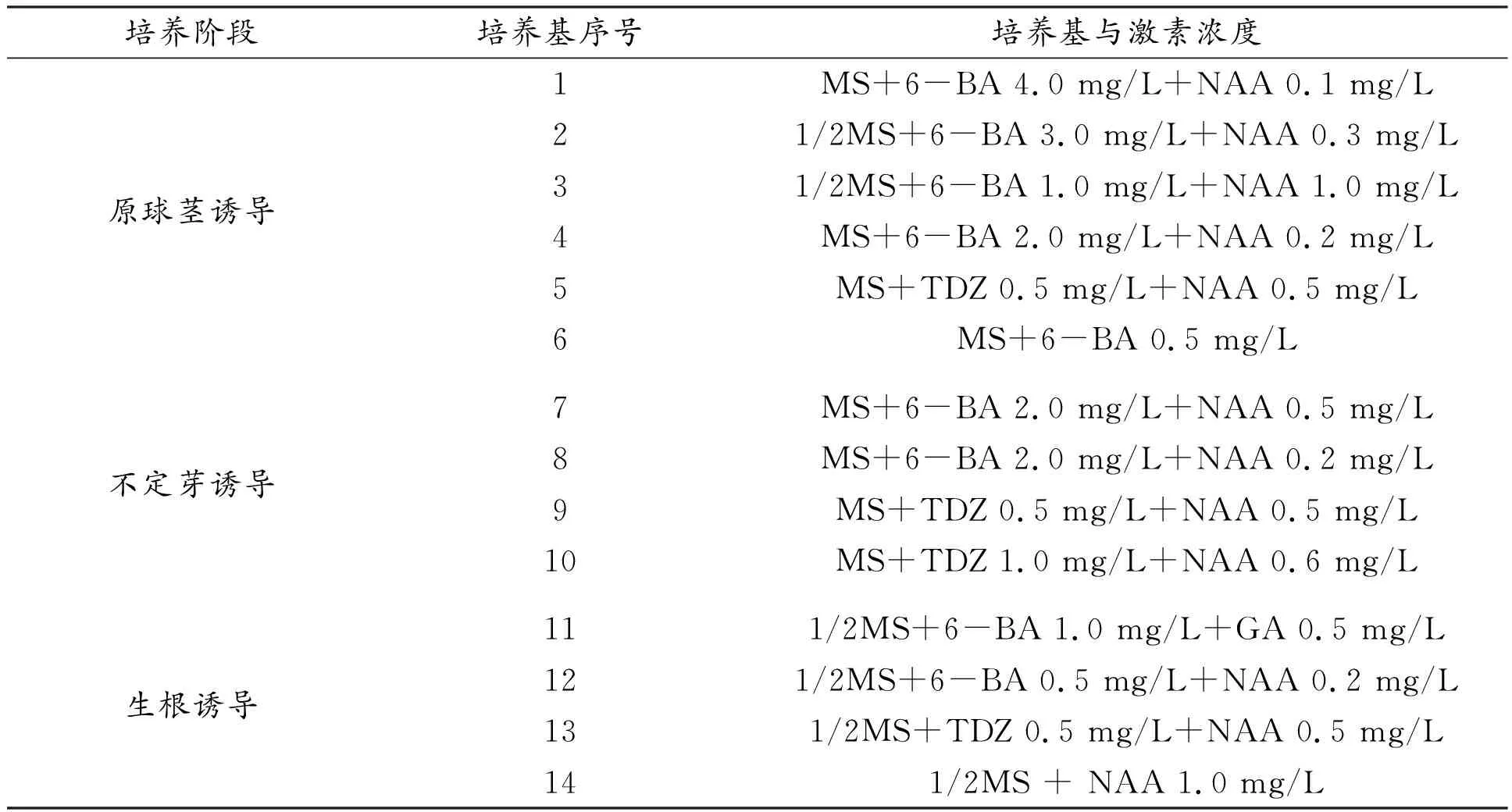
表1 建兰再生不同培养阶段不同激素浓度培养基组成
1.5 培养条件
培养条件主要是温度和光照控制。其中温度:白天(25±2) ℃,夜间(20±2) ℃;而光照条件为14 h/d。
2 结果与分析
2.1 原球茎诱导
分别将建兰茎尖和花茎(带节)外植体材料接种于1~6号培养基,筛选原球茎最佳诱导培养基,试验结果见表2。
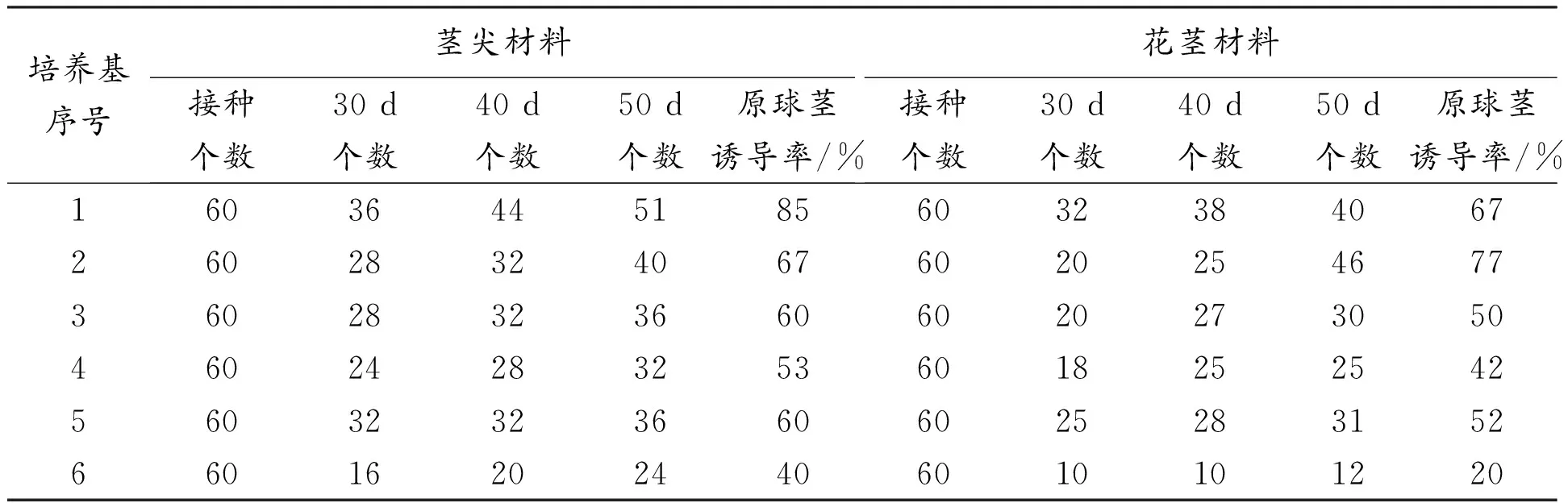
表2 建兰原球茎诱导
从表2可知,在6种培养基中,茎尖组织原球茎诱导率从高到低依次为1号、2号、3号、5号、4号、6号,而花茎组织诱导率从高到低依次为2号、1号、5号、3号、4号、6号。故1、2号培养基诱导2种组织的原球茎更为适宜,其中1号培养基来培养建兰茎尖组织获得了最高诱导率(85%),即1号培养基可作为建兰原球茎最佳诱导培养基。
在6种培养基中,茎尖组织原球茎诱导率平均为61%,而花茎组织诱导率平均为51%,故建兰茎尖比花茎更适合作为原球茎诱导的试验材料。
2.2 不定芽诱导
用1号培养基茎尖组织诱导获得的原球茎材料,开展不定芽诱导试验,筛选不定芽最佳诱导培养基,试验结果见表3。

表3 建兰不定芽诱导
由表3可知:随着培养时间的延长,4种培养基均能诱导出较多的茎芽,并展现出较好的生长诱导效果;40 d时,9号培养基增殖倍数(3.67)最低,不定芽诱导效率较低,而8号培养基增殖倍数为4.67,获得了最高的不定芽诱导效率;故8号培养基可作为建兰不定芽诱导的最佳培养基。
2.3 生根诱导
用8号培养基获得的建兰不定芽,进行建兰生根培养,筛选适宜的生根培养基,试验结果见表4。

表4 建兰生根诱导
由表4可知:4种培养基生根诱导率均高于90%,表明4种培养基均具有很好的出根诱导效率,其中11~13号3种培养基出根率均达到100%;在11~14号培养基中,12号培养基于第15 d即达100%诱导率,可作为最适宜用于建兰生根诱导的培养基。
3 结论与讨论
3.1 结论
(1)与花茎组织材料相比,建兰茎尖组织更适宜作为原球茎诱导的试验材料;
(2)针对不同培养阶段培养物诱导效果方面,原球茎诱导最佳培养基是1号培养基,不定芽诱导最佳培养基为8号培养基,而生根诱导最佳培养基为12号培养基。
本研究结果发现,相比于建兰花茎,茎尖更具发育活性,在提供的不同培养基上,原球茎诱导率及增殖效率均有相应提高[7-8]。不同激素种类及浓度的培养基对组织培养再生有重要的影响,适宜的激素种类组合及浓度比例能够有效地促进原球茎、不定芽与根的分化发育[9-11]。
3.2 讨论
建兰组培相关文献鲜有报道,精摘几篇结合本研究结果展开讨论。
刘翠华等[12]以建兰小桃红品种根状茎为外植体,研究激素对根状茎增殖、分化和生根的影响,结果表明:根状茎增殖最佳培养基是MS+6-BA 0.5 mg/L,根状茎分化最佳培养基MS+NAA 0.6 mg/L+TDA 1.0 mg/L,分化率为93.1%;生根最佳培养基1/2MS+NAA 1.0 mg/L+AC 0.05%。其根状茎分化率与本研究原球茎分化率均较高,显示两者虽然来源于不同品种及不同器官部位的外植体材料,均有很好的再分化能力,再生较为容易。其生根率为96.3%,表明生根容易,与本研究结果一致。
叶秀仙等[9]关于建兰无菌苗的快繁技术研究,王济红等[13]关于建兰新品种黄金小神童组培育苗的集成技术优化研究,均突显了TDZ激素在根状茎增殖等阶段的重要作用。而本研究结果显示,建兰组培再生过程各阶段的优化培养基可不必添加TDZ激素,仅使用6-BA和NAA 2个激素组合并优化其配比浓度即可达到较好的诱导效果。
李丽等[14]以线艺建兰茎尖、腋芽为外植体,研究得出原球茎诱导最佳培养基为1/2MS+6-BA 3.0mg/L+NAA 0.3 mg/L,并长成根状茎。根状茎分化培养基为MS+6-BA 2.0mg/L+PP333 1.0mg/L+NAA 0.5mg/L,分化率达46.3%。生根培养基为MS+IBA 1.0mg/L+GA 0.5mg/L+香蕉泥100 g/L,生根率达100%。其以上几个阶段优选培养基激素浓度与本研究结果较为接近,其中再分化效果不如本研究结果,而生根效果与本研究十分吻合。本研究未涉及植物生长调节剂PP333与GA的使用,也未设计添加香蕉泥、椰汁等天然的有机营养物质,各阶段培养物诱导与生长状态均较为良好,可作为以后进一步深化探索研究的参考内容。
