基于HPLC-MS代谢组学法对羊肚菌菌汤成分的分析
2022-10-10苏正娴邓立情宋煜欧吴凡鸽姬晓娜谢朝晖
鲁 铁,李 登,苏正娴,邓立情,宋煜欧,刘 静,吴凡鸽,姬晓娜,谢朝晖
(河南城建学院 生命科学与工程学院,河南 平顶山 467036)
羊肚菌(Morchellaspp.)又称麻子菌、狼肚、羊肚菜、羊肚蘑、羊蜂窝蛾子等,是世界公认的一种珍贵、稀有的食药用真菌,因其菌盖表面凹凸不平、状如羊肚而得名。羊肚菌分类上隶属于真菌界子囊菌门(Ascomycota)盘菌纲(Pezizomycetes)盘菌目(Pezizales)羊肚菌科(Morchellaceae)。羊肚菌[Morchellaesculenta(L.)Pers.]是羊肚菌属的模式种[1-3]。我国明代《本草纲目》中就有“甘寒无毒,益肠胃,化痰利气” 的记载[4]。近年来羊肚菌栽培技术得到迅速发展,羊肚菌菌汤深受消费者喜爱。羊肚菌菌汤富含丰富的营养成分,但由于采取的烹饪炊具、烹饪方式不同,导致羊肚菌菌汤的口感千差万别。
代谢组学作为新近发展起来的一门学科,通过高通量化学分析技术对生物样品进行检测,筛选出具有重要生物学意义和统计学显著差异的代谢物。李小琳等[5]使用顶空固相微萃取-气质联用分析包括羊肚菌在内的4种野生食用菌干品的挥发性香气成分;李翔等[6]使用HS /SPME-GC /MS 法比较分析野生与人工栽培羊肚菌挥发性成分,检测出野生和人工栽培羊肚菌挥发性成分的差异。但目前尚无使用HPLC-MS对羊肚菌菌汤进行研究的报道。
本研究基于高效液相色谱串联质谱技术对不同炊具烹饪的羊肚菌菌汤进行HPLC-MS代谢组学分析,同时对羊肚菌菌汤进行总糖及总蛋白的测定,以确定不同炊具烹饪羊肚菌菌汤对其化学成分的影响,为羊肚菌菌汤成分的质量控制提供科学依据,同时为羊肚菌菌汤的内在质量综合评价提供借鉴。
1 材料与方法
1.1 材料与试剂
1.1.1 实验材料
新鲜羊肚菌,采购于宝丰源泉生态农业开发有限公司。
1.1.2 试剂
考马斯亮蓝G250、氯化钠:天津市大茂化学试剂厂;无水乙醇、乙醚、石油醚、浓盐酸、浓硫酸、苯酚:洛阳市化学试剂厂;乙腈:Merck,1499230-935;乙酸铵:Honeywell,17836-50G;色谱纯正己烷、色谱纯甲醇:Fisher公司;色谱纯氯仿:沃凯公司;色谱纯吡啶:Aladdin公司;甲氧胺盐酸盐、L-2氯苯丙氨酸:Damas-beta公司;三氟乙酰胺,含1%三甲基氯硅烷:Regis公司;葡萄糖标准品(纯度≥98%):天津市优谱化学试剂有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
石墨锅:平顶山市信瑞达石墨制造有限公司;珐琅锅、不锈钢锅、铸铁锅:市售;AB Triple TOF 5600/6600质谱仪:AB SCIEX;Agilent 1290 Infinity LC超高压液相色谱仪、8890B-5977B单四极杆气质联用质谱仪、HP-5MS UI毛细管柱(30 m×0.25 mm×0.25 μm):美国Agilent公司;SBL-10DT型超声波清洗机:宁波新芝生物科技有限公司;低速离心机:安徽嘉文仪器装备有限责任公司;PE Eenspire型酶标仪:美国PE公司。
1.3 方法
1.3.1 原料预处理
选取新鲜的羊肚菌子实体,用清水将子实体表面污物冲洗干净,并用剪刀将子实体剪成2 cm×2 cm块状大小,将其放入冰箱中4 ℃冷藏备用。
1.3.2 菌汤制备
本实验中羊肚菌菌汤制备采用传统熬制工艺水煮法。参考王英、段丽丽等[7-8]研究食用菌菌汤制备的结果,高温和长时间熬制菌汤会降低其营养物质的含量。故采用熬制时间60 min、水煮熬制温度95 ℃及料液比140 (g:ml)进行羊肚菌菌汤的熬制。取出预处理好的冷藏鲜菌,分别放入石墨锅、珐琅锅、不锈钢锅、铸铁锅中;加入蒸馏水,进行熬制,蒸煮冷却,过滤除去残渣,得到滤液。随后每种滤液分别取30 mL放于4支50 mL离心管中;4种样液分别编号为1-I、2-I、3-I、4-I,置于-20 ℃冰箱保存待用。
1.3.3 LC-MS分析羊肚菌菌汤代谢组分
样液预处理:-20 ℃取出样液,称取60 mg,分别加入200 μL水匀浆,涡旋60 s,加入800 μL甲醇乙腈溶液(11),涡旋60 s;低温超声30 min,重复2次,-20 ℃放置1 h沉淀蛋白,过滤管过滤后14 000 rcf,4 ℃离心20 min,取上清液冷冻干燥,-80 ℃保存样液。
进样条件:样品采用Agilent 1290 Infinity LC超高效液相色谱系统(UHPLC) HILIC色谱柱进行分离;柱温25 ℃;流速0.3 mL/min;流动相组成A:水+25 mM乙酸铵+25 mM氨水,B:乙腈。
梯度洗脱程序如表1所示。
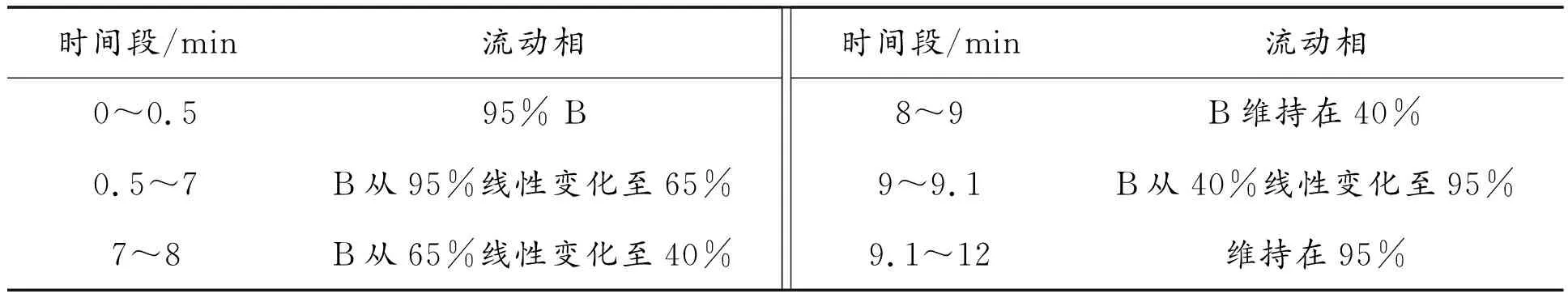
表1 梯度洗脱程序
质谱条件:分别采用电喷雾电离(ESI)正离子和负离子模式进行检测。样品经UHPLC分离后用Agilent 6550 质谱仪进行质谱分析。ESI源条件为:离子源温度250 ℃,干燥气体流速16 L/min,离子化电压3 300 V,质量扫描范围50~1 200,循环时间250 ms。
1.3.4 总糖的测定
羊肚菌菌汤中的固体物主要指羊肚菌多糖或其他可溶性物质,对其总多糖的含量进行测定,可以反映出其固体物的含量[9],以便对羊肚菌菌汤的成分进行深度剖析。总多糖含量的测定采用苯酚-硫酸法[10-12],在波长490 nm处测定吸光度值。以葡萄糖质量浓度(x)为横坐标,吸光度值(y)为纵坐标绘制葡萄糖标准曲线,得葡萄糖标准曲线回归方程y=0.692 7x+0.006 4,相关系数R2=0.990 8。按照葡萄糖标准曲线回归方程计算样液中多糖含量。将冰箱中保存待用的样液融化,4 500 r/min离心10 min,取上清液1 mL与0.1 mL 5%的苯酚溶液混合均匀,加入0.5 mL的浓硫酸,振摇5 min混匀,然后放置沸水浴中加热15 min。结束后放置于冷水中冷却30 min,在490 nm处测定其吸光度。
1.3.5 总蛋白的测定
总蛋白含量的测定采用考马斯亮蓝法[13],在波长595 nm处测定吸光度值。以蛋白质质量浓度(x)为横坐标,吸光度值(y)为纵坐标绘制蛋白质标准曲线,得到蛋白质标准曲线回归方程y=0.257 4x-0.004 4,相关系数R2=0.991 2。按照蛋白质标准曲线回归方程计算样液中总蛋白含量。将冰箱保存待用的样液融化,4 500 r/min离心10 min,取上清液1 mL于干净试管中,加入5 mL的考马斯亮蓝-G250混匀。取混匀液200 μL加入酶标板中,重复3次,酶标仪测595 nm处吸光值。将测得的样品液吸光值代入蛋白质标准曲线计算样品中蛋白质含量。
1.3.6 数据分析
数据分析采用SPSS软件和 Office Excel 2010,并使用软件Origin 9.0制图。
2 结果与分析
2.1 LC-MS分析羊肚菌菌汤代谢组分的结果
采用电喷雾电离(ESI)正离子和负离子模式进行检测,样本质谱峰的保留时间和峰强度均一致,曲线重叠性高,表明质谱仪对同一样品不同时间检测时,信号稳定性好,同时仪器的高稳定性为数据的重复性和可靠性提供了重要保障[14]。4种待测样液1-I、2-I、3-I和4-I经UHPLC分离后用Agilent 6550质谱仪进行质谱分析。获得的色谱图见图1,色谱分离后,质谱裂解得到每个色谱峰的质谱图。通过峰面积归一化法计算出各化合物的峰面积相对含量,筛选出代表性的化合物成分,结果见表2和表3。
(a)1-I阳离子色谱图 (b)2-I阳离子色谱图
(c)3-I阳离子色谱图 (d)4-I阳离子色谱图
(e)1-I阴离子色谱图 (f)2-I阴离子色谱图
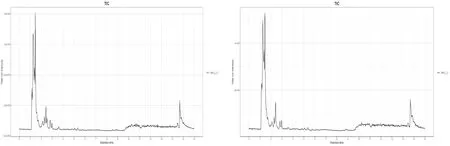
(g)3-I阴离子色谱图 (h)4-I阴离子色谱图图1 基于4种锅具烹饪羊肚菌菌汤的LC-MS色谱图(注:横坐标为代谢物检测的保留时间,纵坐标为离子检测的粒子流强度)
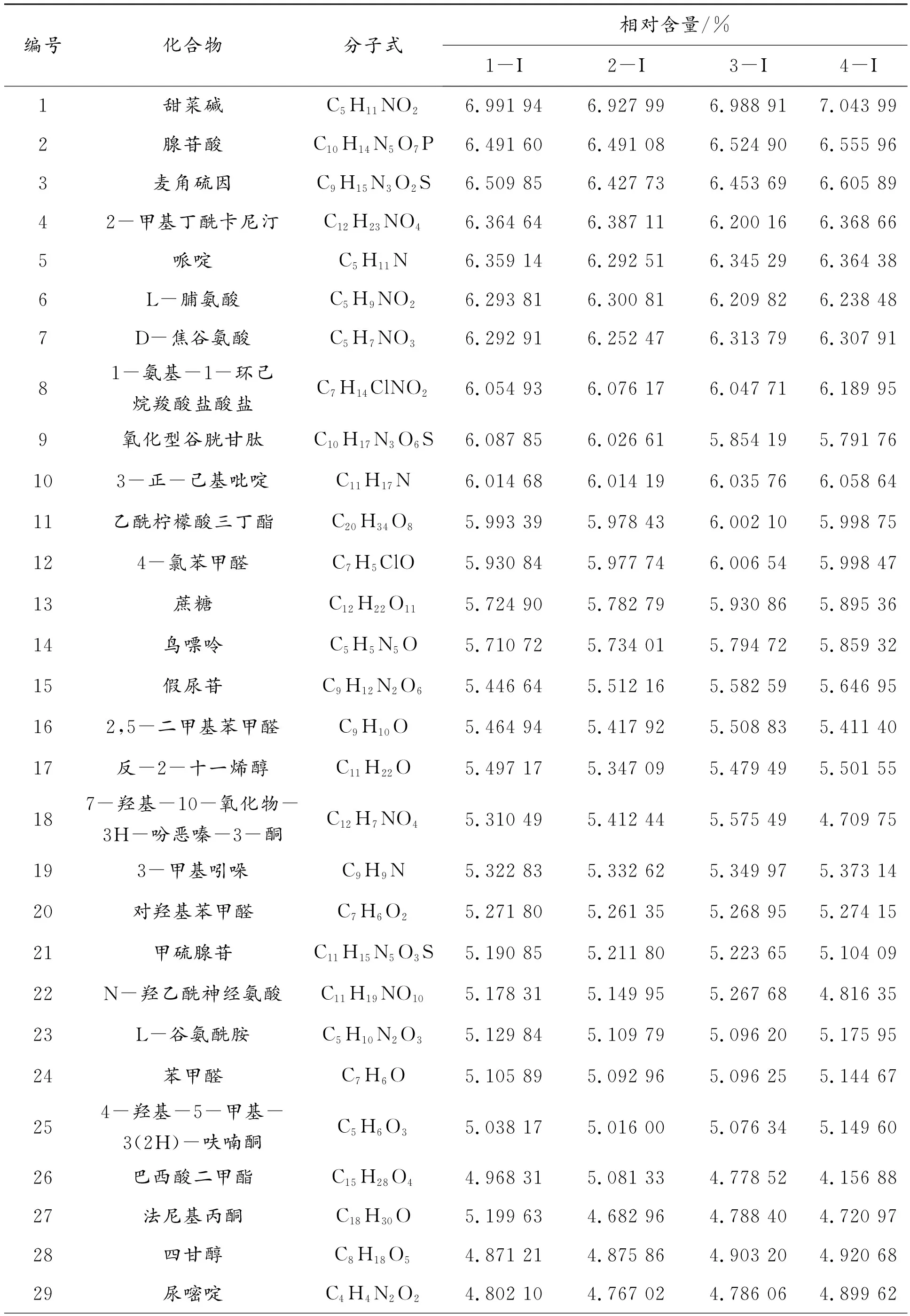
表2 羊肚菌样液阳离子化合物组分及相对含量
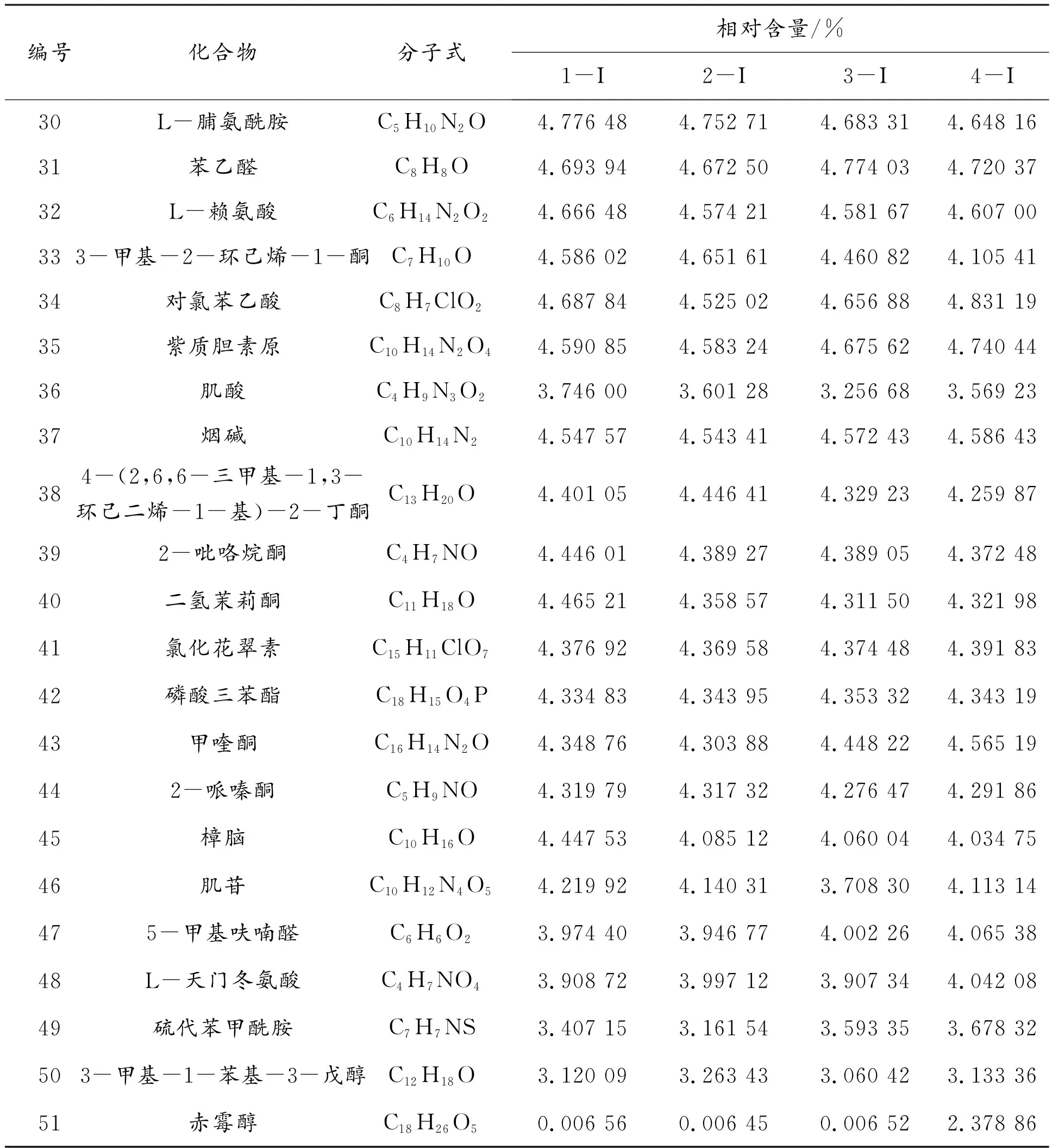
续表2
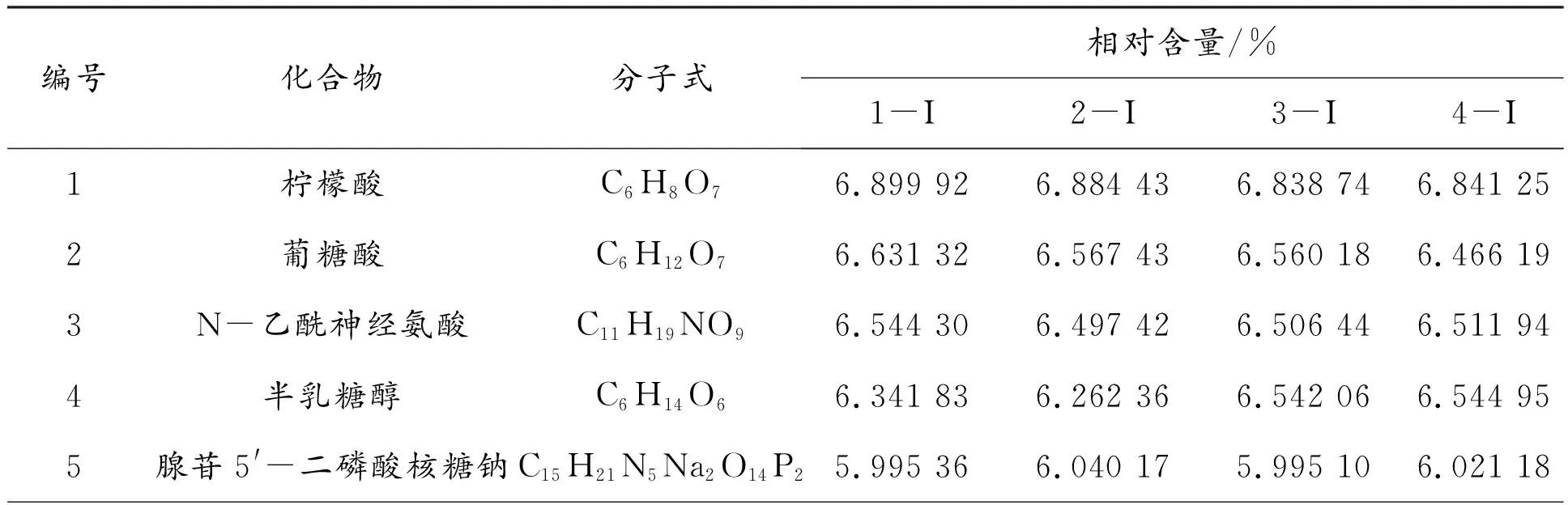
表3 羊肚菌样液阴离子化合物组分及相对含量
续表3
2.2 主成分分析
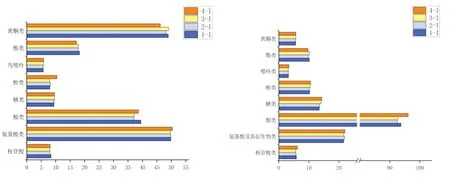
本研究共检测出442种化合物及挥发物成分,分为9个大类,以核苷酸及其衍生物(nucleotides and derivatives)、氨基酸及其衍生物(amino acids and derivatives)、酚酸类(phenolic acids)、糖及醇类(saccharides and Alcohols)、脂质(lipids)、萜类(terpenoids)、黄酮类(flavonoids)、酯类(esters)和其他类(others)为主(见图2)。选用不同的锅具,采用传统工艺熬煮法烹饪羊肚菌菌汤,检测发现其化合物高度相似,无明显的差异性。表明选用不同的锅具来熬制羊肚菌菌汤,其菌汤的风味及营养成分无明显差异。在阳离子物质含量对比中显示,在相同烹煮条件下,石墨锅(1-I)中嘌呤化合物含量、糖类化合物含量较少,酯类化合物、酸类化合物、核苷类化合物含量较高。核苷类化合物及酯类化合物是食用菌中的主要增鲜物质[15]。在阴离子物质含量对比中显示,酸类代谢物含量最多。总含量上糖类化合物含量、醇类化合物含量最少,酯类化合物、酮类化合物含量相对较高。
(a)阳离子物质含量对比 (b)阴离子物质含量对比图2 LC-MS阳、阴离子物质含量对比
2.3 4种锅具烹饪羊肚菌菌汤的组分分析及相对含量
根据质谱峰的保留时间和相对含量,共筛选出了76种具有代表性的化合物及其代谢产物,其中包括氨基酸及其衍生物10类、核苷酸类3类、酸类物质12类、糖及醇类5类、黄酮类13类以及炔烃类化合物33类。氨基酸类包括谷氨酸、天冬氨酸、麦角硫因和其他氨基酸衍生物。谷氨酸和天冬氨酸是具有活性的鲜味物质,也是重要的鲜甜味呈味氨基酸,可有效提高菌汤滋味,丰富营养成分。麦角硫因是一种天然抗氧化剂,在人体内可以对细胞起到保护作用,是机体内的重要活性物质,同时也能起到清除自由基的功效。核苷酸类中包括鸟苷酸和腺苷酸等,鸟苷酸可与谷氨酸钠或5′-肌苷酸二钠合用,有显著的协同作用,从而进一步地增加羊肚菌菌汤的口感。酸类物质中包括对氯苯乙酸、5-羟基吲哚-3-乙酸、3-羟基苯丙烯酸、肌酸、5,6,7,8-四羟基-2-萘甲酸2-萘羧酸、蓖麻油酸、3-吲哚丁酸、亚叶酸、3-(3-甲氧基苯基)丙酸以及牛磺酸等。糖及醇类中包括蔗糖、D-水苏糖、四甘醇、3-甲基-1-苯基-3-戊醇和赤霉醇。黄酮类中包括2-吡咯烷酮、二氢茉莉酮、甲喹酮、2-哌嗪酮、雄烯二酮、2-甲基-3-(2-戊烯基)-2-环戊烯酮、异丁基苯基酮、金雀异黄酮和3,3′,4′,5,7-五羟基黄酮等,其中:二氢茉莉酮[16]是一种天然的香料,能增加羊肚菌菌汤的香气,丰富口感;金雀异黄酮具有抗氧化作用,对多种肿瘤细胞株有抑制作用。
2.4 总糖和总蛋白的测定结果分析
选用石墨锅(1-I)、珐琅锅(2-I)、不锈钢锅(3-I)和铸铁锅(4-I)4种材质不同的锅具,采用传统熬制工艺水煮法,控制熬制条件:熬制时间60 min、水煮熬制温度95 ℃及料液比140 (g:mL)。探究不同锅具烹饪羊肚菌菌汤后,菌汤中总糖和蛋白含量的差异,结果见图3。在相同条件下烹煮羊肚菌,珐琅锅中总糖含量最少,为0.413 μg/mL;石墨锅次之,铸铁锅中羊肚菌菌汤总糖含量最高,为0.676 μg/mL。在对羊肚菌菌汤总蛋白的测定中,结果显示,选择石墨锅烹饪羊肚菌菌汤时,其总蛋白含量最高,为3.500 μg/mL;珐琅锅和不锈钢锅中的总蛋白含量与石墨锅中的总蛋白含量无明显差异;选用铸铁锅烹饪羊肚菌菌汤时,其总蛋白含量最低,为1.855 μg/mL,远小于石墨锅中的总蛋白含量。
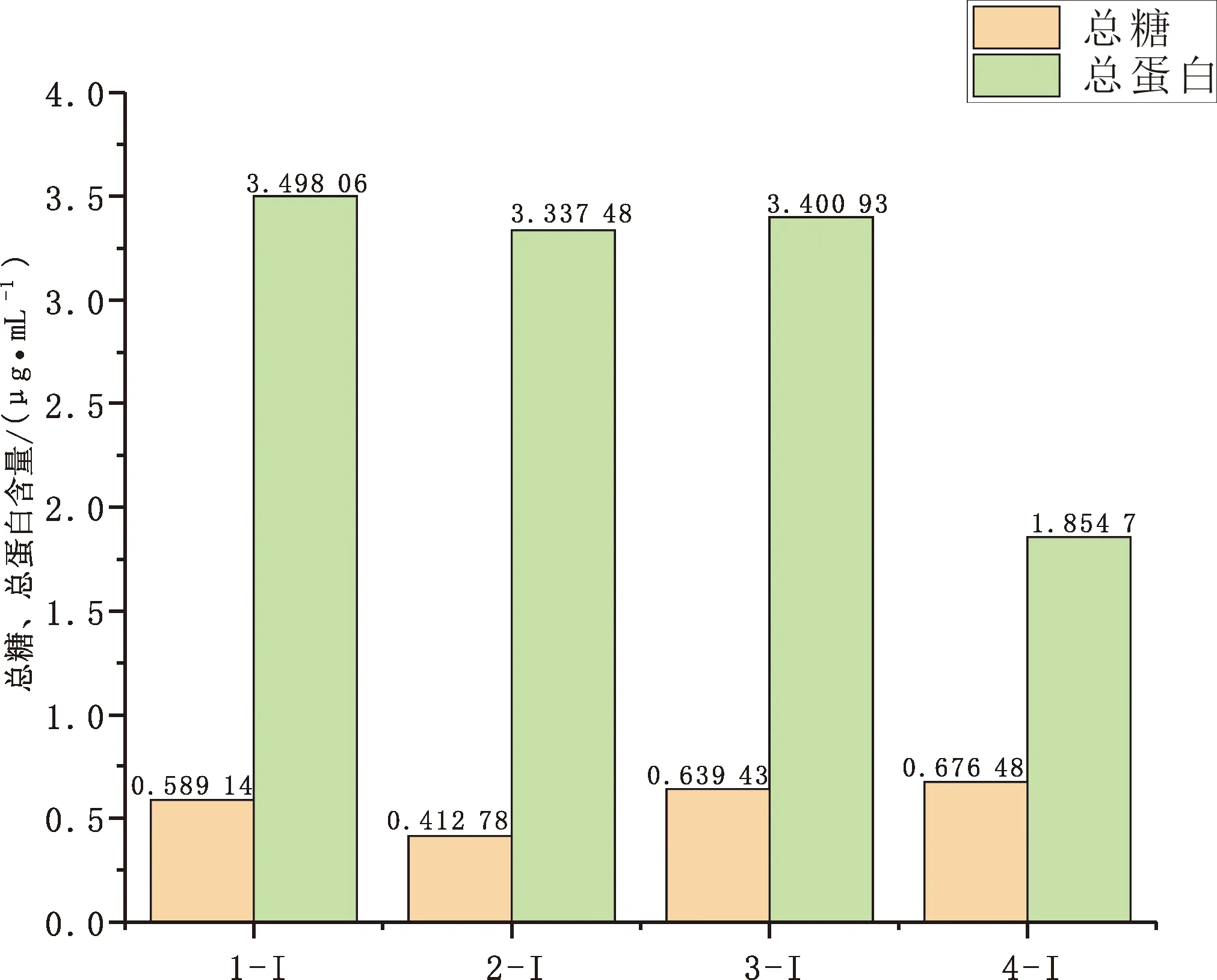
图3 羊肚菌菌汤总糖和总蛋白的含量
3 结论与讨论
通过HPLC-MS共检测出442种化合物及挥发物成分,分为9个大类,主要以氨基酸及其衍生物和核苷酸类化合物为主。LC-MS阳离子分析发现石墨锅中嘌呤类化合物、糖类化合物含量较少,酯类化合物、氨基酸类化合物、核苷类化合物含量较高;阴离子分析发现酯类含量最多。总含量上糖类化合物含量、醇类化合物含量最少,酯类化合物、酮类化合物含量相对较高。酯类化合物、酸类化合物、氨基酸类化合物、核苷酸类化合物对羊肚菌菌汤的风味物质有较大贡献。根据保留时间和相对含量筛选了76种化合物及其代谢产物,发现谷氨酸、麦角硫因、鸟苷酸和二氢茉莉酮等代表性的特征香味物质。在总糖和总蛋白的测定中,发现采用不同锅具熬制羊肚菌菌汤对其总糖和总蛋白的含量有一定影响,并检测了石墨锅的性能。石墨锅作为厨房用具,有一定的优势,能进一步应用于食材的烹饪。
