异质型乙酰辅酶A羧化酶及其生产3-羟基丙酸的研究进展
2022-10-09丁钟灵王肖娜程智怡李幸雨夏立志徐晓玲沈洁洁
张 鑫,丁钟灵,王肖娜,程智怡,李幸雨,夏立志,徐晓玲,沈洁洁
(杭州师范大学基础医学院,浙江 杭州 311121)
1957年,Wakil等从鸽子肝脏提取液中分馏纯化获得R1—R4 4种组分,其中R1在1958年被证明含有大量生物素,并参与了以乙酰辅酶A(acetyl-CoA,Ac-CoA)为底物的长链脂肪酸合成.由此乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACCase)被首次分离出来,并被证实参与生物体内脂肪酸的合成[1].随后越来越多的研究发现ACCase广泛分布于细菌、植物和动物等绝大多数生物中,以生物素为辅因子,催化Ac-CoA羧化转变为丙二酰辅酶A(malonyl-CoA,M-CoA),是脂肪酸从头合成的起始限速酶[2-4].反应底物Ac-CoA和产物M-CoA都是脂肪酸合成的原料,并且M-CoA所携带的丙二酰基团作为二碳单元,直接参与脂酰链的延伸过程[3].
ACCase在结构和来源上可分为同质型和异质型.同质型ACCase主要存在于真核生物中,在多肽链中依次形成3个功能结构域:生物素羧化酶(biotin carboxylase,BC)、生物素羧基载体蛋白(biotin carboxylase carrier protein,BCCP)和羧基转移酶(carboxyltransferase,CT)[3-5].同质型蛋白复合体以同型二聚体形式发挥活性[4],整体结构稳定、保守、不易解离.异质型ACCase主要存在于原核生物中,是由不同基因编码的多个亚基所组成的多酶复合酶.ACCase因其在脂肪酸合成中的关键作用及其在原核、真核生物中的结构差异而受到人们的广泛关注,在新型抗生素筛选、合成和油脂生产[3,5]中均开展了大量研究.
近年来,在一些嗜热古细菌、丝状不产氧光合细菌(filamentous anoxygenic phototrophs,FAPs)等中发现的异质型ACCase还参与一种新型固定二氧化碳的3-羟基丙酸循环[6].该循环的起始两步反应是异质型ACCase催化Ac-CoA羧化生成M-CoA,随后被丙二酰辅酶A还原酶(malonyl-CoA reductase,MCR)还原而生成标志性中间代谢产物3-羟基丙酸(3-hydroxypropionic acid,3-HP)[7].3-HP是一种重要的平台化合物,能进一步转化为丙烯酸、丙烯腈和1,3-丙二醇等有价值的化学物质[8-10].值得关注的是,3-HP的化学合成普遍存在能耗高、毒性大、副产品多等缺陷,利用代谢工程途径生产3-HP的生物法[7,10-12]逐渐成为热点研究方向.以葡萄糖为碳源合成3-HP的途径中,基于起始两步反应合成3-HP的生物法是力学上较有利的短合成途径.
本文回顾并总结近年来参与脂肪酸从头合成和3-羟基丙酸循环异质型ACCase的组成、亚基结构、催化及其表达调控特点,以扩展对ACCase结构与功能多样性、分子进化的理解.此外,本文介绍了以3-羟基丙酸循环的起始两步反应为基础,通过基因工程方法,由异质型ACCase合成3-HP的范例,以期为绿色、高效开发3-HP提供理论依据和策略.
1 异质型ACCase组成的多样性
1.1 异质型ACCase亚基数目的多样性
异质型ACCase在不同微生物中的亚基编码基因不同.例如,结核分枝杆菌(Mycobacteriumtuberculosis)中ACCase包含α亚基和β亚基,其中α亚基是由BC和BCCP组成的双结构域蛋白,其编码基因有3个,分别是accA1—A3.β亚基行使CT蛋白的功能,其编码基因有6个,分别是accD1—D6.这6个亚基为细胞膜脂质的合成提供不同酰基,如丙酰、乙酰或丁醛基团.这些产物为脂肪酸合成途径提供底物,催化产生细胞壁中的分枝菌酸和细胞包膜中的多甲基分支脂肪酸[13-15].天蓝色链霉菌(Streptomycescoelicolor)中编码ACCase亚基的基因种类丰富,转录翻译得到的产物发挥活性功能,为聚酮合成途径提供代谢产物[16].本实验室研究的光合绿丝菌(Chloroflexusaurantiacu)[17]和光合玫瑰菌(Roseiflexuscastenholzii)[18]是FAPs的两个典型菌株,这两个菌株基因组上编码ACCase亚基的基因众多,转录翻译后的蛋白质催化3-羟基丙酸循环的起始反应.
1.2 异质型ACCase亚基组成的多样性
不同原核生物中异质型ACCase的亚基组成具有多样性.按照亚基组成主要分为以下3类:第一类以大肠杆菌(Escherichiacoli)[19]、光合绿丝菌和光合玫瑰菌中的ACCase为例,都是由BC、BCCP、α-CT和β-CT亚基组成,是最常见的组合方式.第二类以天蓝色链霉菌[20]和结核分枝杆菌[14]中的ACCase为例,由α亚基、β亚基和特殊ε亚基组成,分别行使BC-BCCP、CT和辅助功能.其中,ε亚基特异性结合β亚基形成β-ε复合体,进一步促进β亚基与α亚基的结合,增强整体ACCase的活性.第三类以参与3-羟基丙酸循环的极性嗜热金属球菌(Metallosphaerasedula)[21]和嗜热耐酸古细菌(Acidianusbrierleyi)[22]中的ACCase为例,由α、β和γ共3个亚基组成,分别行使CT、BC和BCCP的催化作用,同时具有羧化Ac-CoA和丙酰辅酶A两种底物的功能(图1).
有趣的是,非禾本科单子叶植物和双子叶植物(如拟南芥)等真核生物质体中也存在异质型ACCase,由核基因组编码的BC、BCCP、α-CT亚基和质体基因组编码的β-CT亚基一起组装加工形成高分子量的复合体[23](图1).尽管这些植物ACCase是属于异质型,但其氨基酸序列更接近于真核同质型[24].
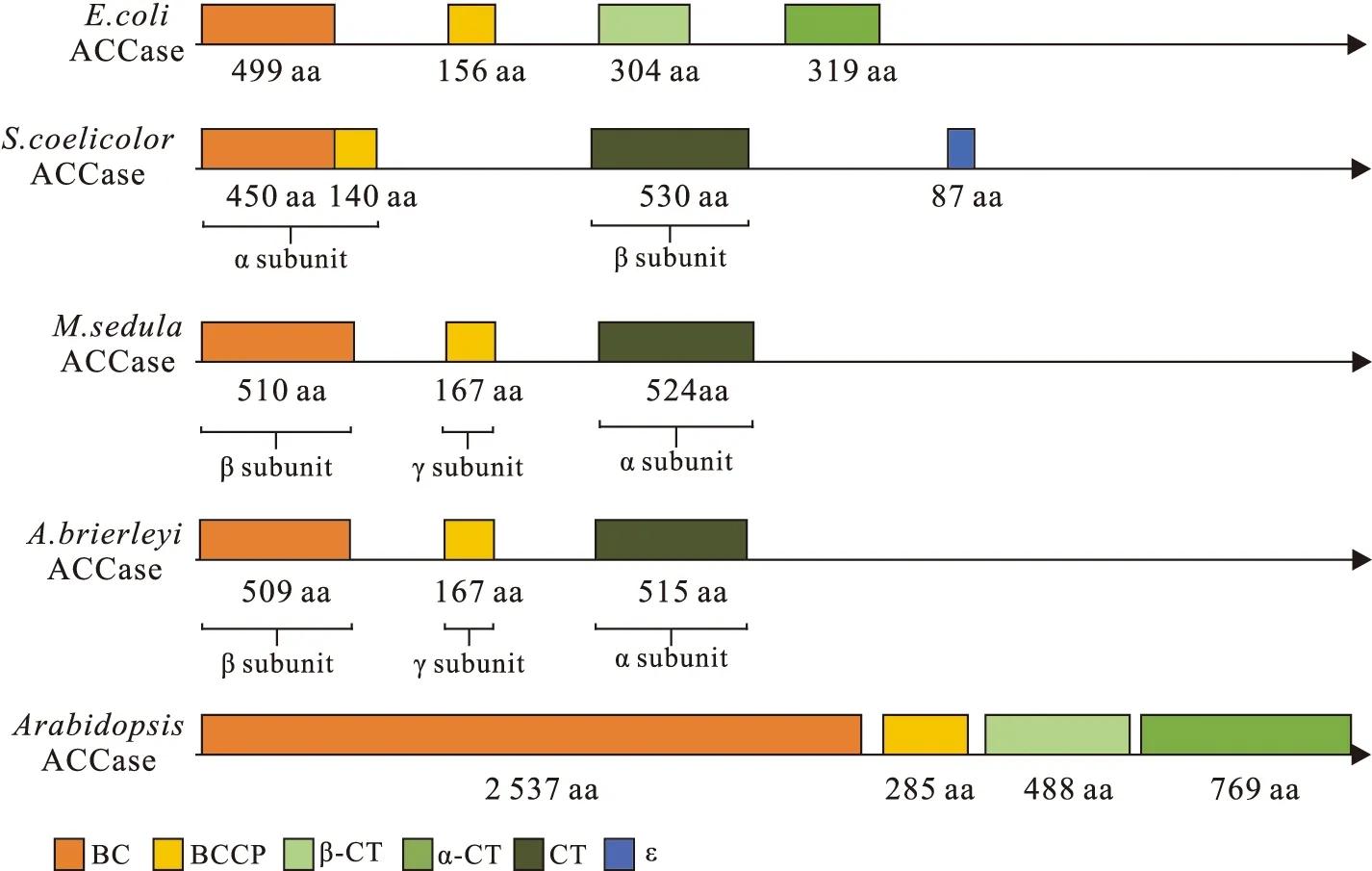
图1 不同物种中异质型ACCase的亚基组成特点Fig.1 Characteristics of subunits composition of heteromeric ACCase in different species
2 异质型ACCase的结构与功能
2.1 异质型ACCase的催化反应
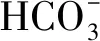
图2 ACCase的催化反应Fig.2 Catalytic reaction of ACCase
2.2 整体异质型ACCase及亚基复合体的蛋白大分子
体内异质型ACCase是由多个亚基组装形成的较大复合体.目前完整的异质型ACCase全酶复合物的结构还未解析,可能的原因是该复合物不稳定、易解离.但也有文献报道,在以3-羟基丙酸循环为唯一固碳进行自养生长的极性嗜热金属球菌M.sedula和嗜热耐酸古细菌A.brierleyi中,纯化得到完整的异质型ACCase.Hügler等[21]通过DEAE-Sepharose色谱法、苯基超糖色谱法、阴离子交换柱、凝胶过滤色谱法等纯化方法得到微量M.sedulaACCase复合体.该复合体是由57 kDa的α亚基、57 kDa的β亚基和18.6 kDa的γ亚基组成的α4β4γ4结构,分子量为(560±50)kDa.Chuakrut等[22]利用ACCase生物素化的特性,从A.brierleyi细胞破碎上清液中,通过链霉素亲和层析特异性纯化含有生物素的蛋白,再结合凝胶色谱进一步纯化得到ACCase复合体.该复合体是由分子量分别为62、59、20 kDa的α、β、γ亚基组成的α4β4γ4结构,分子量约为540 kDa.同样的,亚复合体BC-BCCP和CT的分子量也较大.Broussard等[25]通过凝胶排阻层析法(size-exclusion chromatography,SEC)观察到大肠杆菌BC-BCCP亚复合物约为640 kDa.Lin等[14]观察到结核分枝杆菌的CT(AccD5)是一个六聚体,分子量约为360 kDa.
2.3 BC-BCCP亚复合物及其单个亚基结构
BC和BCCP负责完成生物素的羧化.目前只在大肠杆菌中报道了异质型BC-BCCP亚复合体的结构[40].该亚复合物由4个BCCP单体作为分子夹,将2个BC同二聚体连接,从而形成一个(BC)4(BCCP)4异八聚体(图3).BC亚基由N端结构域(N-terminal domain)、ATP结合区域(ATP-binding domain)和C端结构域(C-terminal domain)组成.每个BC单体都有一个完整且独立的活性催化中心[25].BCCP大约由80个氨基酸组成,具有保守的AMKM序列,其中K是生物素结合位点[4,25].该位点突变为Cys或Arg,可部分回补ACCase的活性丧失[26].上述复合体中的BCCP是富含β折叠的独立结构,其C端结构域上还存在一个由约10个残基组成、形状类似于“拇指(thumb)”结构(图3),可盖住BC活性中心,以起到封闭底物的作用[25-26].BCCP的N端结构域高度灵活,与CT亚基结合,起到转录抑制剂的作用.BC-BCCP亚复合物中,BC∶BCCP=1∶1,这与其他文献中通过生化分析观察到大肠杆菌中BC∶BCCP=1∶2的结果不一致[24].可能的原因是在该复合体的表达质粒构建中,BC和BCCP编码基因之间添加了非天然的核糖体结合位点(ribosome binding site,RBS),从而引起亚基的异常表达.
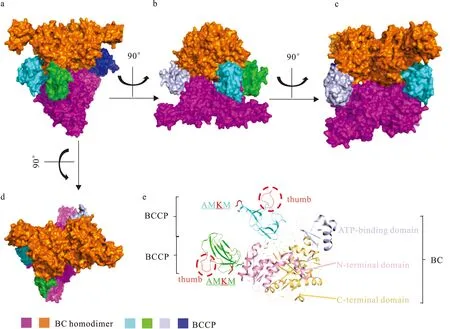
a—d: BCCP-BC复合物的表面图,BC表示为紫色和橙色,BCCP表示为青色、绿色、淡蓝色和蓝色,b是向右旋转90°的侧视图、c是b向右旋转90°的侧视图、d是a逆时针旋转90°的俯视图;e:BC单体和两个BCCP(青色和绿色)卡通图,BC单体的ATP结合结构域、C端结构域和N端结构域分别表示为浅蓝色、浅橙色和浅粉色,每个BCCP中AMKM中的K表示为红色,每个BCCP中的拇指结构用红色虚线圈出.
2.4 CT亚复合物结构
CT负责将生物素上的羧基转移到受体,使之羧化,从而完成ACCase后半部分的催化反应.受体通常是带有有机酸的辅酶A酯,主要是Ac-CoA[3];小部分细菌中还以丙酰辅酶A[21]和丁酰辅酶A[14]为受体.因此CT在ACCase中具有选择酰基单元的功能,也是ACCase亚基中最不保守的组分.由于其较差的保守性,目前CT对酰基底物的选择还未有详细了解.
革兰氏阴性菌株大肠杆菌和革兰氏阳性菌株金色葡萄球菌(Staphylococcusaureus)中异质型CT的晶体结构都观察到以α-CT和β-CT组成的异质四聚体(α-CT)2(β-CT)2结构[41].α-CT和β-CT形成的二聚体组成CT亚单位的一个活性中心,其中α-CT结合羧化的生物素,β-CT结合Ac-CoA[24,36].β-CT的N端有一个特殊的锌指结构域,该结构域是由4个Cys排列形成四面体硫,包裹Zn2+离子,形成一条“锌带”(图4),起着封闭底物结合活性位点盖子的功能[36].Kozaki等[37]发现将锌指结构域中的关键残基Cys突变为Ala,可显著降低CT活性,说明异质型CT-Zn结构域对其酶活的发挥具有重要作用.同时锌指结构域还起着结合DNA的作用.Benson等[38]发现CT结合DNA后,可阻止与羧化的生物素、Ac-CoA的结合,反之亦然,说明羧化的生物素、Ac-CoA、DNA结合CT是存在竞争性的.此外,有的细菌中CT并不是以异质四聚体形式存在,如结核分枝杆菌AccD5是一个六聚体,催化丙酰辅酶A和Ac-CoA的羧化;AccD6是一种同二聚体,催化Ac-CoA的羧化,并且无锌指结构域[13-15].

a—c:α-CT和β-CT复合物的表面图,α-CT和β-CT分别表示为粉红色和绿色,b是a向右旋转180°后的侧视图,c是a逆时针旋转90°后的俯视图;d:α-CT和β-CT复合物的卡通图,黑色方框代表复合物的催化口袋,位于α-CT和β-CT复合物催化口袋中的关键氨基酸Gly表示为青色,β-CT中的4个Cys排列成四面体并包裹着Zn2+离子,Cys和Zn2+离子分别表示为红色和灰色.
在催化过程中,α-CT和β-CT活性位点中的关键氨基酸Gly,构成氧阴离子空穴稳定底物,形成催化中间态.金黄色葡萄球菌的CT结构中,α亚基Gly199、Gly200和β亚基Gly207、Gly208的相邻酰胺质子作为氢键供体,构成氧阴离子空穴,分别稳定生物素、Ac-CoA中的咪唑阴离子、烯酸部分[36,39].在催化底物Ac-CoA羧化后,产物从CT活性口袋中游离出去.CT仍保持活性,对游离的生物素具有催化作用[39].
3 异质型ACCase的遗传和生化调控
异质型ACCase催化Ac-CoA羧化是脂肪酸从头合成和3-羟基丙酸循环的关键步骤,是微生物正常存活、生长和繁殖必需的生化反应之一.为了维持细胞内异质型ACCase及其亚基的表达水平和活性处于适宜状态,微生物通常利用遗传和生化方式对其进行调控.
3.1 异质型ACCase的遗传调控
由于异质型ACCase参与不同微生物中的不同生理代谢,其亚基的表达机制差异大.在脂肪酸从头合成中,E.coliBC和BCCP的编码基因相邻,位于同一操纵子内,可在同一启动子下协调表达[25];而α-CT和β-CT在不同操纵子中,二者的表达依赖于其他机制.在3-羟基丙酸循环中,C.aurantiacu的α-CT和β-CT反而位于同一操纵子内,可在同一启动子下协同表达;2个BC和1个BCCP的编码基因相距较远,其表达遵循不同机制.R.castenholzii基因组中存在2个α-CT和2个β-CT的编码基因,其中1个α-CT(WP_012119678.1)和1个β-CT(WP_012119679.1)紧密排列,可进行共表达;而另1个α-CT(WP_012121414.1)和β-CT(WP_041330882.1)相距太远而依赖于其他的表达机制.A.brierleyiACCase的β亚基(WP_110270072.1)、γ亚基(WP_110270071.1)和α亚基(WP_110270070.1)依次排列在基因组上,其中β亚基终止密码子的最后一个碱基是γ亚基起始密码子的第1个碱基[22].三者位于同一操纵子内,协调表达.
异质型ACCase的活性受自身亚基的正调控.E.coliACCase亚基基因过表达,整体活性增加,提高了产物水平和脂肪酸合成的速率[40].Miyahisa等[41]异源表达谷氨酸棒状杆菌(Corynebacteriumglutamicum)异质型ACCase的2个亚基,可提高大肠杆菌M-CoA的水平,促进下游产物的生成速率.Madoka等[42]过表达单个亚基β-CT,发现能促进其他亚基的表达.尽管上述文献报道过表达单个或多个亚基可促进整体酶活,但也有研究表明过表达单一亚基对异质型ACCase的表达无影响或是起负调控作用.Shintani等[43]单独过表达BC亚基,发现并没有引起BCCP蛋白水平的提高,也没有导致脂肪酸合成速率的显著增加.Cheng等[44]发现单独过表达E.coliBCCP,反而降低了胞内异质型ACCase的水平.此外,异质型ACCase亚基的表达也受自身的调控,如E.coliCT通过结合编码α-CT和β-CT亚单位的mRNA,以抑制自身的翻译.这种蛋白质与RNA之间的相互作用是由β-CT的锌指结构域介导的[45-46].
3.2 异质型ACCase的生化调控
生物体内存在不同的生化反应,以调控异质型ACCase及其亚基的表达.首先,在脂肪酸从头合成过程中,ACCase催化的底物和产物都是脂肪酸合成的原料,并且产物M-CoA直接参与酰基载体蛋白(acyl carrier protein,ACP)共价连接的脂酰链的延伸,而含有较长脂酰链的ACP对异质型ACCase的活性具有别构调节作用.Davis等[47]发现大肠杆菌中异质型ACCase的活性被含有C6—C20酰基衍生物的ACP别构抑制,而不会被缺乏酰基部分的ACP抑制.其次,BCCP的调节蛋白,如生物素-蛋白连接酶(如BirA)、信号转导蛋白PⅡ家族等,对异质型ACCase的表达存在调控.apo-BCCP(不结合生物素、无活性的BCCP)在生物素-蛋白连接酶的催化作用下,催化生物素与之共价连接,生成holo-BCCP(结合生物素、有活性的BCCP),因此增强该酶活性可提高多酶复合体的表达.过表达E.coliBCCP导致胞内ACCase水平降低[44].而过表达生物素-蛋白连接酶,增强了holo-BCCP的丰度,上调了复合酶的表达[48],说明生物素合成途径和BCCP的生物素化在整个异质型ACCase功能中的重要性和必要性.holo-BCCP的另一个调节蛋白P家族是2-酮戊二酸的信号转导蛋白,参与氮代谢的调控.PⅡ在ATP的供能下,直接与holo-BCCP相互结合起作用[49],从而导致ACCase整体组装效率和酶活的降低[50].再次,底物的反馈作用对ACCase亚基表达也有影响.E.coliCT结合自身亚基的mRNA而抑制自身翻译的作用,可被充足的底物Ac-CoA消除[45].此外,亚基的磷酸化和去磷酸化也会影响异质型ACCase的表达水平[51].
4 异质型ACCase在3-HP生产中的工程应用
在一些嗜热古细菌、FAPs中发现的ACCase参与一种新型的3-羟基丙酸循环,其标志中间物3-HP由ACCase和MCR催化合成.3-HP是合成多种药物和化工产品的重要前体,具有广泛的市场前景和应用价值.研究者期望通过异源重构上述两步反应,以绿色生物合成方式生产3-HP.因合成3-HP的直接底物为M-CoA,故将3-羟基丙酸循环起始两步生化反应称为丙二酰辅酶A途径.很多底盘生物(如大肠杆菌、酵母)中已重构该途径,以生产3-HP[7,52-53].Rathnasingh等[52]过表达大肠杆菌K-12异质型ACCase的编码基因accABCD、生物素连接酶bira与C.aurantiacumcr,发酵产生的3-HP达到1.6 mmol/L.Kildegaard等[54]在酿酒酵母(Saccharomycescerevisiae)体内重构丙二酰辅酶A途径,发酵产生3-HP.
3-HP的重要性和丙二酰辅酶A途径短、力学上有利的优势受到越来越多研究者的关注,因此目前已明确底盘生物体内产生3-HP的代谢过程:内源性葡萄糖(glucose)通过糖酵解转化为丙酮酸(pyruvic acid),丙酮酸通过丙酮酸脱氢酶复合物(pyruvate dehydrogenase complex,PDHC)生成Ac-CoA,Ac-CoA经ACCase羧化而转化为M-CoA,后者被MCR催化产生最终的产物3-HP[55](图5).
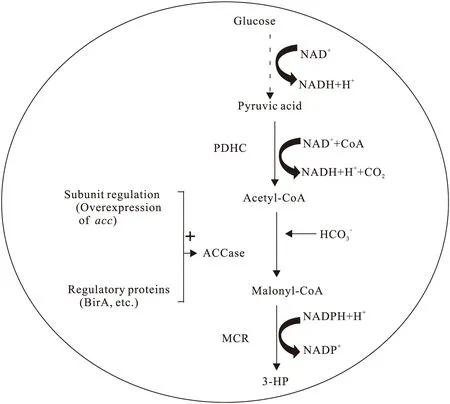
图5 宿主体内丙二酰辅酶A途径合成3-HP的代谢支路及ACCase的调控Fig.5 M-CoA pathway and regulation of ACCase in the host cell
尽管已有很多文献报道底盘生物体内重构丙二酰辅酶A途径可生产3-HP,但生物法合成3-HP的产量较低.底物M-CoA在该途径中的供给量不足,M-CoA是通用的中间代谢产物,存在多条竞争代谢途径,如脂肪酸的合成、聚酮化合物的合成、黄酮的合成等[56].而ACCase是体内催化生成M-CoA的关键酶,因此增强异质型ACCase活性对提高M-CoA的供应具有重要意义.基于异质型ACCase的催化机制和调控机理,增强其活性的方法如下:
第一,过表达异质型ACCase所有亚基基因,提高整体复合酶的表达水平和酶活.Rathnasingh等[52]在大肠杆菌中过表达C.aurantiacuDSM 635的mcr基因,以葡萄糖为唯一碳源摇瓶发酵产生0.71 mmol/L的3-HP;基于此,过表达大肠杆菌K-12异质型ACCase的编码基因accABCD和生物素连接酶bira,增强底盘生物体内ACCase表达水平及其整体活性,摇瓶发酵产生3-HP的产量提高约2倍,为1.6 mmol/L.Nguyen等[53]以Ⅱ型甲烷诺菌作为生物反应器,过表达内源ACCase基因,增强了整体ACCase活性,促使其反应速率加快,提高了M-CoA前体的供应,显著增加了3-HP的产率.
第二,过表达部分亚基,增强多酶复合体的酶活.Cheng等[57]通过构建含有2个C.glutamicumACCase亚基基因的表达质粒于大肠杆菌BL21(DE3)中,在25℃和0.25 mmol/L IPTG条件下进行诱导表达,产生大量亚基蛋白;随后添加NaHCO3和生物素,摇瓶发酵产生3-HP的最高水平为1.8 g/L;5L发酵罐补料发酵,产生3-HP的最高水平可达10.08 g/L.
第三,过表达异质型ACCase的正调节蛋白,提高其活性.Lian等[48]在极端嗜热菌Pyrococcusfuriosus中过表达M.sedula异质型ACCase、MCR和丙二酰半醛还原酶(malonic semialdehyde reductase)的编码基因,以麦芽糖和二氧化碳为碳源,发酵产生40 mg/L 3-HP;基于此,过表达M.sedula的生物素-蛋白连接酶BPL,促进BCCP亚基的生物素化,提高P.furiosus体内生物素化ACCase水平,增强整体酶活,使得发酵产生的3-HP水平提高为原来的8.2倍.
5 结论与展望
异质型ACCase是脂肪酸合成和3-羟基丙酸循环的限速酶,是微生物体内重要的多酶复合体.尽管本文介绍了异质型ACCase催化、调控和工业应用的一些背景,但异质型ACCase复合体的组装、底物和中间产物传递、产物产生的细节、不稳定易解聚的原因尚不明确,异质型ACCase的结构信息亟需完整.目前已有报道可提取极性嗜热金属球菌M.sedula[21]和嗜热耐酸古细菌A.brierleyi[22]中的稳定异质型ACCase复合物,但未有关于其三维空间结构的报道.
市售的3-HP主要由化工合成而来,但仍然不能满足工业化应用的要求;化工合成长期以来造成的资源损耗和环境污染非常严重,亟需开发绿色新型可持续性生物合成3-HP的工艺.目前,生物合成3-HP的原料主要是以廉价的葡萄糖和甘油为碳源,其中以葡萄糖为碳源合成3-HP的丙二酰辅酶A途径是最具潜力和前景的生物法合成途径.作为该途径的关键酶之一,异质型ACCase的催化机制和调控机理的深入研究将有助于以结构为基础,结合调控机理,合理定向地改造ACCase,解决生物合成3-HP产量低的问题,为生物合成3-HP的工业市场提供新思路和新方法.
