采用体内碱性彗星试验检测两种聚醚醚酮材料的遗传毒性
2022-10-09孙令骁刘香东刘增祥王鸾鸾朱福余孙晓霞刘成虎
孙令骁,刘香东,刘增祥,王鸾鸾,朱福余,孙晓霞,刘成虎*
(山东省医疗器械和药品包装检验研究院,国家药品监督管理局生物材料器械安全性评价重点实验室,山东省医疗器械生物学评价重点实验室,山东 济南250101)
体内碱性彗星试验是一项直接检测核DNA损伤的敏感试验方法,可以在强碱性条件下(pH≥13)检测DNA单链和双链的断裂。由于体内碱性彗星试验可以检测单细胞水平的DNA损伤,因此具有很高的灵敏度,而且该方法所需的样本量少、操作简便,在食品、药品和化学品的遗传毒性检测中均有广泛的应用,2014年经济合作与发展组织(Organization for Economic Co-operation and Development,OECD)发表了针对化学品进行体内碱性彗星试验的指导原则,但是目前国内尚无针对医疗器械及其材料进行体内碱性彗星试验的标准方法。
本研究结合医疗器械临床使用的特性,采用0.9%氯化钠注射液(0.9% sodium chloride injection,SC)和棉籽油(cottonseed oil,CSO)两种介质制备聚醚醚酮(polyether ether ketone,PEEK)材料的极性和非极性试验液,分别采用静脉和腹腔注射对受试动物进行染毒,参考《OECD化学品测试指南489:体内碱性彗星试验》对两种PEEK材料试验液的遗传毒性进行初步评价,为医疗器械及其材料遗传毒性体内碱性彗星试验标准化的建立提供可靠的依据。
1 材料与方法
1.1 动物
SPF级健康SD大鼠70只,购自北京维通利华实验动物技术有限公司,实验动物生产许可证号:SCXK(京)2016-00060。大鼠10~13周龄,雌雄各半,在20~26℃,湿度40%~70%,控制循环灯光(12 h亮,12 h暗)的屏障环境[许可证号:SYXK(鲁)20190013]下采用大鼠饲料[购自北京科澳协力饲料有限公司,许可证号:SCXK(京)2019-0003]按性别分笼群饲,每笼5只,自由饮水和摄食。
1.2 主要试剂和仪器
PEEK材料A(适用于加工齿科种植体等医疗器械,批号R202001),PEEK材料B(适用于加工椎间融合器等医疗器械,批号21060202);0.9%氯化钠注射液(辰欣药业股份有限公司);棉籽油(河北百灵威超精细材料有限公司);甲基磺酸甲酯(methyl methanesulfonate,MMS,Sigma);彗星试验试剂盒(英国Abcam公司,型号ab238544);PBS(不含Ca2+、Mg2+和酚红,Sigma);无水乙醇(分析纯,国药集团化学试剂有限公司);10%磷酸盐缓冲中性福尔马林固定液(济南百博生物技术股份有限公司);Labtub真空采血管(0.109 mol/L柠檬酸钠溶液,力因精准医疗产品有限公司)。
压力蒸汽灭菌器(德国Systec公司,型号VE-75);电子天平(瑞士梅特勒-托利多公司,型号XPE105);水平电泳槽、电泳仪(美国Bio-Rad公司,型号Power Pac);倒置荧光显微镜(日本Olympus公司,型号IX73);离心机(德国Sigma公司,型号1-14);恒温水浴锅(常州国华电器有限公司,型号HH-1);制冰机(日本Sanyo公司,型号SIM-F140AY65)。
1.3 实验方法
1.3.1 试验液和对照溶液制备[1]参考GB/T 16886.12规定,基于0.2 g/mL的比例,将两种PEEK材料分别置于SC和CSO中,于(121±2)℃浸提(1.0±0.1)h,取浸提液作为试验液。阴性对照为不含试验样品的SC和CSO,同法制备。试验液在制备后立即使用,以防止吸附在浸提容器上或成分发生其他变化。阳性对照为MMS,将MMS(1.3 g/mL)用SC稀释至1 mg/mL,配制完成后在2 h内使用。
1.3.2 动物分组及处理将70只SD大鼠随机分为7组,分别为:①SC阴性对照组;②CSO阴性对照组;③PEEK材料A生理盐水试验组(PEEK SCA试验组);④PEEK材料A棉籽油试验组(PEEK CSOA试验组);⑤PEEK材料B生理盐水试验组(PEEK SCB试验组);⑥PEEK材料B棉籽油试验组(PEEK CSOB试验组);⑦阳性对照MMS组,每组10只,雌雄各半。SC阴性对照组、PEEK SC试验组和MMS组分别按照10 mL/kg的剂量由静脉途径染毒,CSO阴性对照组和PEEK CSO试验组分别按照5 mL/kg的剂量由腹腔途径染毒。第1次染毒24 h后进行第2次染毒,末次染毒3 h后取材。
动物一般观察:分别在第1次染毒前一天、第1次染毒和第2次染毒后对所有动物称体质量,并在染毒期间每天对所有动物进行两次观察,包括动物是否死亡、皮肤与被毛、眼与黏膜的改变,以及呼吸、循环、自主和中枢神经系统、躯体运动神经活动性和行为模式等状况[2]。
1.3.3标本制备将动物处死后从腹主动脉采血1 mL,转移入采血管内反转振摇数次,迅速摘取大鼠肝脏和肾脏,称取质量后分别剪下肝脏和肾脏的一小块组织,每只动物剪下的组织块大小应尽量一致,将剪下的组织块放入提前预冷的PBS(不含Ca2+、Mg2+和酚红)中充分清洗以清除残留的血液。清洗干净的肝脏和肾脏组织块放入5 mL预冷的PBS中,使用眼科剪将组织块尽量剪碎以释放细胞,放置5 min后去掉组织碎片进行离心,离心后收集细胞。制备肝脏、肾脏和外周血的单细胞悬液,调整细胞浓度为1×105个/mL,将单细胞悬液置于冰上保存待用[3-4]。
另取一部分肝脏和肾脏组织置于固定液中用于组织病理学分析。
1.3.4 制片、裂解、解旋与电泳单细胞悬液制备后在低温条件下1 h内完成制片。取洁净载玻片,在磨砂面一侧滴加75 μL琼脂糖,常规涂片,在4℃环境下放置15 min凝固后备用。将单细胞悬液与琼脂糖按1∶10(V/V)比例混匀,在制备好的琼脂糖凝胶层上滴加75 μL细胞与琼脂糖的混合液,在4℃环境下避光放置15 min,每个样本制备3张玻片备用。
根据彗星试验试剂盒的操作说明,将玻片浸没于预冷的裂解液,在4℃环境下避光作用至少1 h后使用PBS漂洗玻片2次,每次2 min,除去残留的洗涤剂和盐类物质。漂洗后将玻片浸没于预冷的电泳缓冲液(pH≥13),置于冰上避光解旋30 min,将玻片转移到置于冰上的水平电泳槽中,缓缓加入预冷的新鲜配制的电泳缓冲液,采用电势1 V/cm、启动电流300 mA、电泳时间为20 min的电泳条件进行避光电泳。电泳结束后用预冷的纯水漂洗玻片2次,每次2 min,将玻片放入预冷的70%乙醇中固定5 min,空气中自然干燥。
1.3.5 染色、阅片与数据处理每张玻片加入试剂盒提供的DNA链荧光染料100 μL,室温孵育15 min,在倒置荧光显微镜下用适当的放大倍数(100倍或200倍)观察玻片。DNA结合荧光染料后受到激发产生绿色荧光,未受损的DNA电泳时无法迁移太远从而留在细胞核中,而损伤的DNA片段会在电场作用下从细胞核中迁出形成可视的彗星尾形状。在荧光显微镜下可以观察到DNA片段从细胞的“彗头”移到“彗尾”,“彗头”为圆形光斑,边缘整齐,“彗尾”呈散点状拖尾。彗星显微图像中的细胞可分为3类,可评分细胞(细胞的“彗头”、“彗尾”轮廓清晰,且未受邻近细胞干扰)、不可评分细胞(细胞的“彗头”、“彗尾”不清晰或重叠的细胞等)和“刺猬”状细胞(显微图像下由小或不存在的头部以及大的弥漫性尾部组成的细胞)[5]。选择玻片中间位置且密度适中的区域进行阅片,确保细胞无重叠,避免在玻片的边缘进行阅片。
采用OpenComet软件分析细胞图像[6],以尾部DNA百分比、尾矩和Olive尾矩作为分析指标衡量DNA的损伤程度,每个样本对150个可评分细胞进行分析,计算每个样本每张玻片可评分细胞尾部DNA百分比、尾矩和Olive尾矩中位数的平均数,得出每个样本可评分细胞的尾部DNA百分比、尾矩和Olive尾矩,每个样本计数150个细胞来单独记录“刺猬”状细胞的发生频率。计算每只大鼠肝脏和肾脏的质量与体质量之比作为肝脏系数和肾脏系数。
1.4 统计学方法
采用SPSS 17.0软件进行统计分析,试验结果用xˉ±s表示,对每个样本可评分细胞的尾部DNA百分比、尾矩、Olive尾矩和“刺猬”状细胞发生频率进行独立样本t检验,如果P<0.05则认为两组之间差异有统计学意义。
2 结果
2.1 PEEK的全身毒性
2.1.1 大鼠的临床观察和体质量变化在研究过程中,各试验组和对照组的大鼠均未见死亡和明显的异常症状,所有动物体质量均有增加。各试验组、阳性对照组大鼠的平均体质量分别和SC、CSO阴性对照组相比差异均无统计学意义(P>0.05)。
2.1.2 大鼠肝脏系数、肾脏系数和病理学检查各试验组和阳性对照组的大鼠肝脏系数、肾脏系数与SC和CSO阴性对照组相比差异均无统计学意义(P>0.05),结果见表1。所有大鼠的肝脏和肾脏均未见肉眼可见的大体病理学改变,组织病理学检查发现各组大鼠的肝细胞形态结构正常,未见肝细胞肿胀,肝细胞间界线清晰,肝细胞核未见固缩、溶解、消失,未见肝细胞变性坏死,肝锁排列整齐呈条索状,间质未见炎性细胞浸润,未见肝血窦扩张,肝被膜未见增厚,各组大鼠的肾小球形态结构正常,系膜细胞未见增生,未见基底膜增厚,肾小管上皮细胞未见变性、坏死,肾小管未见扩张,管腔内未见蛋白管型等病变,间质未见炎性细胞浸润和纤维组织增生,肾脏被膜未见增厚,各组大鼠的肝脏和肾脏未见明显的组织病理学改变,结果见图1和图2。
表1 连续染毒2 d后各组大鼠肝脏系数和肾脏系数(%,±s,n=5)
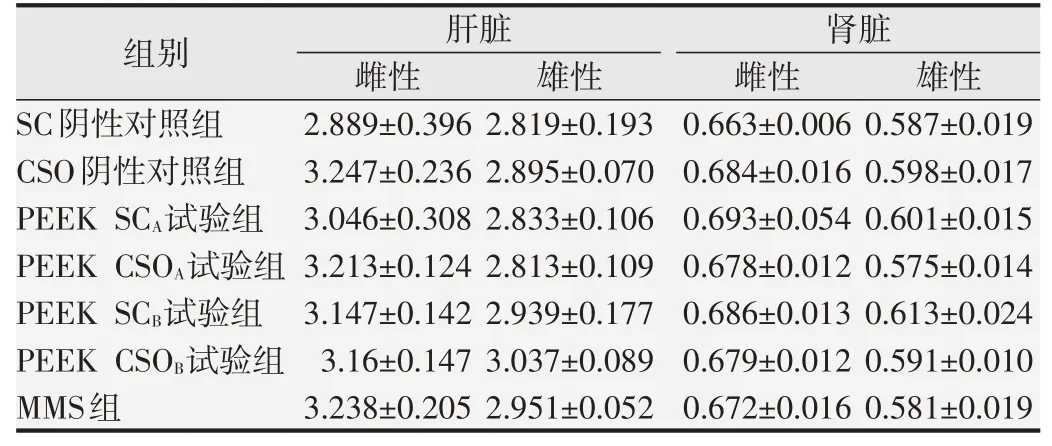
表1 连续染毒2 d后各组大鼠肝脏系数和肾脏系数(%,±s,n=5)
?
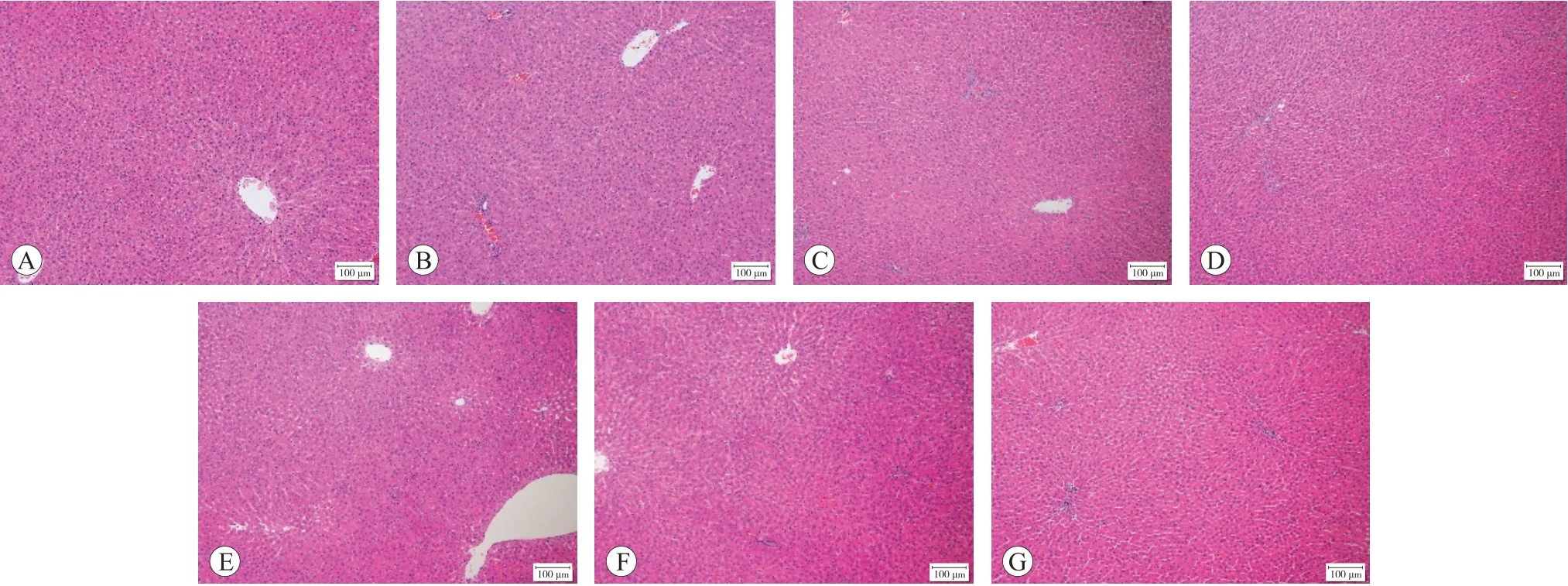
图1 各组大鼠肝脏组织病理检查结果(HE染色)
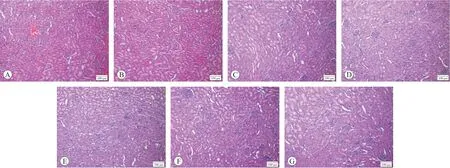
图2 各组大鼠肾脏组织病理检查结果(HE染色)
2.2 体内碱性彗星试验结果
2.2.1 彗星显微图像观察结果图3~图5是大鼠肝细胞、肾细胞和外周血淋巴细胞的彗星显微图像,分别从SC阴性对照组、PEEK SCA试验组、PEEK SCB试验组和MMS阳性对照组的肝细胞、肾细胞和外周血淋巴细胞中各选择一张图片进行比较。与SC阴性对照组相比,MMS阳性对照组细胞出现明显的拖尾现象,表明细胞产生较多的受损DNA片段,“刺猬”状细胞数量明显增多,各试验组肝细胞、肾细胞和外周血淋巴细胞未出现明显的拖尾现象。
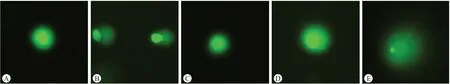
图3 大鼠肝细胞彗星显微图像观察结果
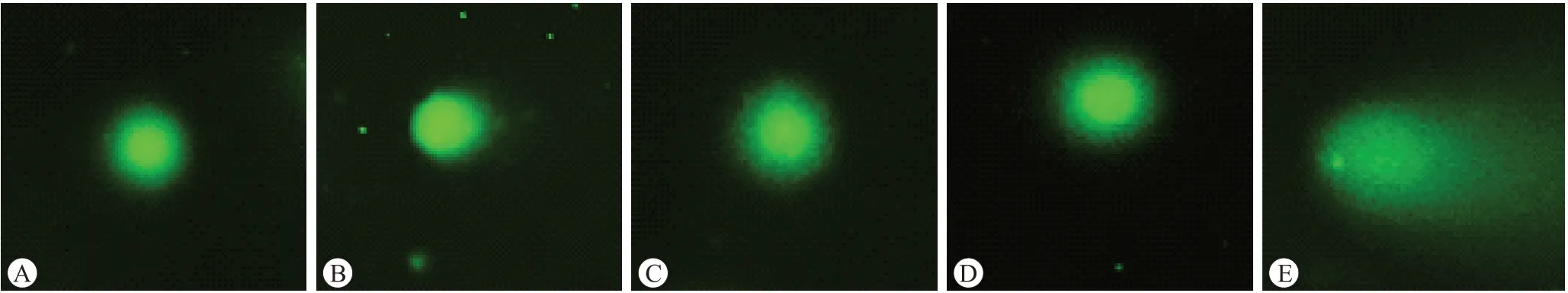
图4 大鼠肾细胞彗星显微图像观察结果

图5 大鼠外周血淋巴细胞彗星显微图像观察结果
2.2.2 细胞尾部DNA百分比、尾矩和Olive尾矩分析结果与SC阴性对照组相比,MMS阳性对照组大鼠的肝、肾和外周血的细胞尾部DNA百分比值、尾矩和Olive尾矩明显升高,与SC阴性对照组间的差异具有统计学意义(P<0.01)。两种PEEK试验组大鼠的肝、肾、外周血的尾部DNA含量百分比值、尾矩、Olive尾矩和“刺猬”状细胞发生频率分别与SC和CSO阴性对照组相比,差异均无统计学意义(P>0.05),见表2~表4。结果表明在本研究体系中两种PEEK材料的试验液未诱导SD大鼠肝脏组织细胞DNA链断裂。
表2 各组大鼠肝细胞体内碱性彗星试验分析结果(±s,n=10)
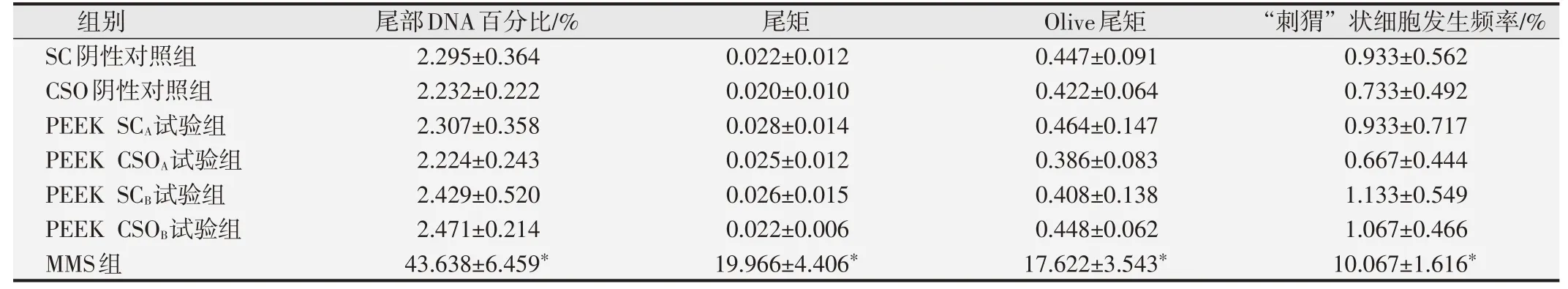
表2 各组大鼠肝细胞体内碱性彗星试验分析结果(±s,n=10)
与阴性对照组比较,*P<0.05.
?
表3 各组大鼠肾细胞体内碱性彗星试验分析结果(±s,n=10)
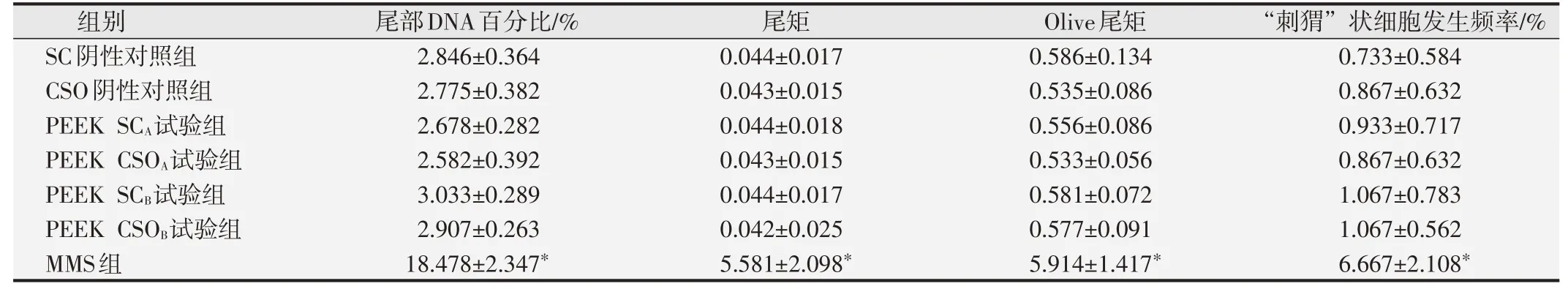
表3 各组大鼠肾细胞体内碱性彗星试验分析结果(±s,n=10)
与阴性对照组比较,*P<0.05.
?
表4 各组大鼠外周血淋巴细胞体内碱性彗星试验分析结果(±s,n=10)
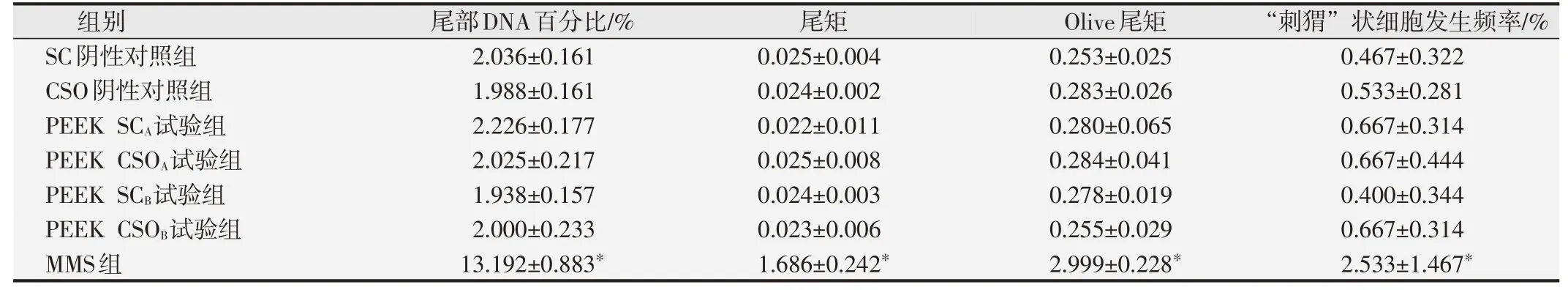
表4 各组大鼠外周血淋巴细胞体内碱性彗星试验分析结果(±s,n=10)
与阴性对照组比较,*P<0.05.
?
3 讨论
截至2021年,我国已有八万八千多个国产医疗器械取得注册证,其中大部分医疗器械使用时直接或间接与患者接触并带来一定的风险,为保证医疗器械不对患者造成生物学毒害,上市前必须开展生物学评价。遗传毒性是生物材料和医疗器械生物学评价的重要内容,对评价生物材料和器械的生物安全性尤其是潜在的致癌可能性有重要意义。根据相关规定,具体的遗传毒性试验方法建议按照GB/T 16886.3进行[7-8]。
哺乳动物体内碱性彗星试验是一种体内遗传毒性试验方法,目前大部分研究均按照OECD发布的体内碱性彗星试验的指导原则进行,该指导原则是针对化学品特性制定的,试验介质为极性溶剂,而医疗器械在发挥治疗/辅助治疗疾病的过程中,可通过多种途径(如肠道、血液、吸入、植入、生殖器官、皮肤等)与人体接触,单一介质并不能反映医疗器械的临床使用特性,同时该指导原则并未给出医疗器械及其材料试验液制备的方法,在染毒剂量等方面与医疗器械及其材料也有较大的差异,因此该指导原则不适宜直接用于医疗器械/材料的检测。但是适用于医疗器械及其材料进行遗传毒性试验的GB/T 16886.3标准并未给出哺乳动物体内碱性彗星试验的详细试验方法,目前国内也没有关于医疗器械及其材料进行哺乳动物体内碱性彗星试验的相关文献可以参考,因此本研究依据医疗器械临床使用的特点,对常用的体内碱性彗星试验方法进行了改良,给出了样品制备、试验液和阳性对照物的染毒剂量等详细的试验步骤,建立了适用于医疗器械及其材料的哺乳动物体内碱性彗星试验的关键检测技术并获得了相关的数据,填补了该方法在医疗器械及其材料检测应用中的空缺,为其他医疗器械及其材料进行哺乳动物体内碱性彗星试验提供了参考依据。
聚醚醚酮(PEEK)是一种聚芳香族半结晶热塑性高分子材料,其弹性模量与人皮质骨的弹性模量接近,可有效降低应力遮挡引起的骨吸收风险,是生物假体植入物的理想材料之一,被广泛地应用于脊柱外科、矫形外科、颌面外科等领域[9]。GB/T 16886.1规定对医疗器械进行生物学评价时,与组织/骨接触的植入类医疗器械均需要进行遗传毒性评价。本研究参考GB/T 16886.12的规定,选择0.2 g/mL的浸提比例,采用极性溶剂SC和非极性溶剂CSO两种介质在(121±2)℃下浸提(1.0±0.1)h,取浸提液作为PEEK的试验液,对PEEK中是否含有潜在遗传毒性物质进行了研究。
目前彗星试验大多采用定性分析和定量分析两种方法进行结果评价,本研究认为定性分析人为干扰影响较大,可能导致试验结果不准确。尾部DNA百分比、尾矩和Olive尾矩是目前比较常用的彗星试验的分析指标,有研究表明这3个指标具有良好的相关性且无显著差异,尾矩和Olive尾矩可以将DNA损伤量和遗传物质在尾部的迁移距离用一个数字来表示,而同一个细胞的尾部DNA百分比在不同的彗星图像分析软件中的值基本相同,因此本研究决定采用定量分析的方法,以尾部DNA百分比、尾矩和Olive尾矩作为分析指标[10-12]。由表2~表4可以看出,本研究中各组的尾部DNA百分比、尾矩和Olive尾矩均具有良好的相关性。本研究对医疗器械及其材料试验液的制备、阳性对照物、染毒剂量、取材时间等关键变量作了明确,将SD大鼠的体质量变化、脏器的相对质量、临床观察、病理学检查等指标与体内碱性彗星试验结果相结合,对PEEK的全身毒性和遗传毒性进行综合分析,建立了适用于医疗器械及其材料哺乳动物体内碱性彗星试验的研究体系。
从彗星显微图像观察结果图3~图5中可以看出,MMS阳性对照组的肝脏、肾脏和外周血中均出现较多的“刺猬”状细胞,大鼠肝细胞、肾细胞和外周血淋巴细胞的体内碱性彗星试验分析结果也显示MMS阳性对照组和SC阴性对照组相比“刺猬”状细胞的发生频率存在显著性差异(如表2~表4所示)。“刺猬”状细胞被认为是严重受损的细胞,但其成因目前尚不明确,有研究表明“刺猬”状细胞是由可修复的DNA损伤造成的[13],也有研究认为“刺猬”状细胞是由样品相关的细胞毒性或样品制备过程中开始的机械/酶诱导损伤导致的[14]。考虑到细胞毒性也可能导致DNA迁移程度增加,而且已知的遗传毒性物质也大都存在低等或中等的细胞毒性,因此本研究对所有动物的肝脏和肾脏进行了组织病理学检查[15],图1和图2的结果显示阳性对照组的肝脏和肾脏未观察到明显的组织病理学改变,阳性对照组和阴性对照组相比未见明显异常。本研究结果显示所有试验动物未见明显的全身毒性,阳性对照组和阴性对照组间的差异有统计学意义,表明试验体系成立。
彗星试验可分为中性彗星试验和碱性彗星试验,一般认为中性彗星试验能够检测DNA双链的断裂,而碱性彗星试验能够检测DNA单链和双链的断裂以及大部分的脱嘌呤嘧啶(apurinic/apyrimidinic,AP)位点,因而具有更高的灵敏度。由于肝脏和肾脏是物质在体内代谢、吸收和排泄的主要器官,同时也是高频致癌靶组织,而本研究采用静脉和腹腔途径染毒,因此将肝脏、肾脏和外周血作为靶组织。除此之外,体内碱性彗星试验还可根据医疗器械/材料预期的临床用途选择胃、十二指肠、空肠、皮肤或膀胱等作为合适的靶器官[16-18]。
由于未检索到两种PEEK材料的毒代动力学数据,本研究采用了连续两次染毒(间隔24 h)的染毒方法。根据OECD发布的体内碱性彗星试验的指导原则,体内碱性彗星试验的染毒时间应根据血药浓度达到峰值的时间来确定,因此不同医疗器械/材料的染毒时间可能会有差异,从而对试验结果产生影响。为满足动物福利要求,减少动物使用量,体现“3R”原则(减少、优化、替代),体内碱性彗星试验可与体内微核试验、重复接触全身毒性试验等研究进行结合,实现多终点的检测[19-20]。但是在与其他毒性研究结合时应特别注意体内彗星试验的取材时间,取材时间应选在DNA链被诱导断裂之后,且在断裂被去除/修复之前,有研究表明一些导致DNA链断裂的损伤持续时间可能非常短[21-23],但大部分毒性研究的取材时间为末次染毒后24 h取材,这就导致体内彗星试验与其他毒性研究结合时可能会漏检此类DNA损伤,因此应根据试验样品和靶器官仔细设计体内彗星试验的染毒时间和取材时间。下一步,我们将研究不同医疗器械及其材料的染毒时间对DNA损伤的影响,并通过将体内彗星试验与体内微核试验、重复接触全身毒性试验相结合来更加科学合理地进行医疗器械及其材料的遗传毒性评价。
随着“后疫情时代”的到来,生物技术与多学科交叉汇聚融合发展的态势越来越明显,前沿生物技术引领医疗器械领域的创新突破加速演进,大批新型的生物材料和医疗器械例如动物源性材料、可吸收/可降解材料、复合材料、3D打印生物材料、纳米材料等层出不穷。某些传统的生物学评价方法对这些新型材料已经不再适用,例如由于纳米材料的摄取和DNA接触的不确定性,常用的细菌回复突变试验就不适用于纳米材料的致突变性检测。因此迫切需要更全面、准确的检测方法来科学合理的评价医疗器械及其材料的临床前安全性。本研究为体内碱性彗星试验在医疗器械及其材料遗传毒性评价中的应用提供了基础数据,提升了医疗器械及其材料遗传毒性评价的研究水平,具有重要的参考价值。
