复方皂刺汤对顺铂联合吉西他滨抑制非小细胞肺癌生长的作用及其机制研究
2022-10-09齐建考孙世辉寇艳方崔志勤
齐建考,汤 肖,孙世辉,寇艳方,崔志勤*
(宁晋县中西医结合医院,河北 邢台055550)
肺癌是癌症相关死亡的第一大原因,在肺癌病例中,非 小 细 胞 肺 癌(non-small-cell lung cancer,NSCLC)占总发病率的80%~85%[1]。NSCLC的体征和症状通常出现在晚期,表现为无法治愈的局部病灶或转移性疾病,尽管NSCLC的治疗取得了较大的进展,但NSCLC仍无法根治,总体5年存活率为14%[2]。因此,寻找高效低毒的抗肿瘤新药势在必行。中医药在预防和治疗疾病方面有着悠久的历史,包括肺癌[3-4]。复方皂刺汤是在肺积方的基础上化裁增减并结合中西医药理论拟成的方药,本方由皂角刺、鸡血藤、当归、山茱萸等组成,方中选择用平和而补气益阴之上品,结合能攻癌而无毒之皂角刺,已被证明对肺癌疗效显著[5]。然而其抗NSCLC的作用机制尚未清晰。血管生成是肿瘤生长和转移扩散的关键组成部分,血管生成的介质血管内皮生长因子(vascular endothelial growth factor,VEGF)在许多恶性肿瘤中高表达,包括NSCLC,肿瘤或血清中VEGF的表达与不良的生存结果和治疗反应有关[6]。在晚期不可治愈的NSCLC患者中,以顺铂为基础的联合治疗可提高存活率,此外,顺铂联合抗癌药物,如吉西他滨、紫杉醇、多西他赛、长春瑞滨或培美曲塞,被推荐为大多数患者的一线治疗选择[7]。此外,中医结合化疗可改善患者生活质量、延长生存时间、增加化疗的敏感性和减轻化疗的副作用[8]。然而,关于复方皂刺汤联合化疗对NSCLC血管生成的作用尚不清晰,因此,本研究旨在阐明复方皂刺汤方剂在顺铂联合吉西他滨基础上治疗NSCLC的分子作用机制,为复方皂刺汤联合化疗在NSCLC治疗中的作用提供科学证据。
1 材料与方法
1.1 材料
1.1.1 细胞株及实验动物人非小细胞肺癌A549细胞株购自Procell Life Science &Technology Co.,Ltd.(中国武汉)。4周龄SPF级BALB/c裸鼠50只,体质量14~16 g,购自河北医科大学生物医学工程中心,生产许可证号SCXK(冀)2019-001,饲养于河北医科大学实验动物公共服务平台,使用许可证号SYXK(冀)020-002,适应性饲养一周后用于实验。
1.1.2 主要试剂及仪器皂角刺、鸡血藤、川芎、威灵仙、当归、红花、山茱萸由江苏省中医院发配以及代为煎煮;顺铂购自齐鲁制药有限公司;吉西他滨购自浙江海正药业股份有限公司;DMEM培养基购自Gibco公 司(上 海);TUNEL凋 亡 试 剂 盒 购 自 武 汉Elabscience;一 抗Bax、Bcl-2、Caspase-3、Ki67、CD31、α-SMA和VEGF购自Cell Signaling Technology,Inc.(上海);二抗购自英国Abcam公司;白介素-4(interleukin-4,IL-4)、白介素-6(interleukin-6,IL-6)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)试 剂 盒 购 自ZCIBIO Technology Co.,Ltd.(上海);BA210Digital数码三目摄像显微镜购自麦克奥迪实业集团;JY200C电泳仪购自北京君意东方电泳设备有限公司。
1.2 实验方法
1.2.1 细胞培养将A549细胞置于DMEM培养液中(含10%胎牛血清、1%青霉素和链霉素)在37℃、CO2体积分数为5%的培养箱中培养,待细胞生长至汇合度为70%~80%时,0.25%胰酶消化后按1∶2进行传代。
1.2.2 复方皂刺汤的制备复方皂刺汤由皂角刺50 g,鸡血藤30 g,川芎15 g,威灵仙12 g,当归、红花、山茱萸各10 g组成,取中药饮片置于电动煎药壶内,加入1 000 mL的蒸馏水浸泡1 h,大火煮沸30 min,纱布过滤,药渣再加入800 mL蒸馏水继续煎煮20 min,过滤。合并两次滤液,经旋转蒸发仪真空减压浓缩,浓缩至约生药含量7.6 g/mL的溶液,分装,-80℃冻存备用。
1.2.3 裸鼠A549移植瘤模型制备及分组给药取对数生长期的A549细胞,采用PBS缓冲液重悬细胞(浓度为1×107/mL),裸鼠固定并酒精消毒后,在裸鼠右前肢腋窝靠背部0.3~0.5 cm处接种A549细胞悬液200 μL,常规饲养并观察裸鼠状态,当裸鼠瘤体直径>5 mm时,将裸鼠随机分为5组(n=10):模型组每天灌胃生理盐水(0.01 mL/g);复方皂刺汤组每天灌胃复方皂刺汤(1 mL/只);吉西他滨联合铂类(GP)方案化疗组每3天腹腔注射1次顺铂(2 mg/kg)和吉西他滨(50 mg/kg);顺铂组每3天腹腔注射1次顺铂(2 mg/kg);复方皂刺汤联合GP方案化疗组每天灌胃复方皂刺汤(1 mL/只),并且每3天腹腔注射1次顺铂(2 mg/kg)和吉西他滨(50 mg/kg)。各组共给药治疗21 d,分别于给药第3、7、14、21天用游标卡尺测量肿瘤长、短径,计算肿瘤体积:V=(肿瘤长径×肿瘤短径2)/2。给药结束后,采用戊巴比妥钠(35 mg/kg)麻醉裸鼠,腹主动脉采集血样,完整剥离肿瘤组织,测量瘤质量,计算抑瘤率,抑瘤率=(1-用药组平均瘤质量/模型组平均瘤质量)×100%。随后取部分肿瘤组织于4%多聚甲醛中固定,部分放入-80℃保存,用于后续检测。
1.2.4 TUNEL染色观察肿瘤细胞凋亡取4%多聚甲醛固定的肿瘤组织,石蜡包埋,制作厚5 μm的切片,胃蛋白酶消化30 min,滴加50 μL的TUNEL反应混合物孵育1 h,滴加DAPI显色10 min,PBS清洗3次,甘油封片,荧光显微镜观察并分析。
1.2.5 免疫组织化学法检测肿瘤组织Ki67、CD31、α-SMA和VEGF表达取4%多聚甲醛固定的肿瘤组织,石蜡包埋,制作厚5 μm的切片,3%甲醇双氧水室 温10 min,分 别 与Ki67(1∶100稀 释)、CD31(1∶100稀释)、α-SMA(1:100稀释)和VEGF(1∶200稀释)一抗在4℃孵育过夜,应用二氨基联苯胺(DAB)和苏木精染色,中性树胶封片,采用BA210Digital数码三目摄像显微镜对切片进行图像采集,采用Image-Pro Plus 6.0图像分析系统测定图像的光密度,确定Ki67、CD31、α-SMA、VEGF阳性染色的强度。
1.2.6 ELISA检测血清IL-4、IL-6和TNF-α浓度血液样品3 500 r/min离心15 min,收集上清液,采用试剂盒分别检测裸鼠血清IL-4、IL-6、TNF-α浓度,实验步骤严格按照试剂盒说明操作。
1.2.7 Western blot法检测肿瘤组织Bax、Bcl-2、Caspase-3蛋白表达取-80℃下保存的肿瘤组织,使用RIPA裂解缓冲液从肿瘤组织样本中提取总蛋白,BCA法进行蛋白质定量,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白质,后转移到聚偏氟乙烯膜(PVDF)上。转移后用5%脱脂牛奶在室温下封闭膜2 h,然后在4℃下分别与一抗(Bax、Bcl-2、Caspase-3、β-actin)孵育过夜,一抗的稀释比均为1∶1 000。接着,将膜用含有0.1% Tween-20的Tris缓冲盐水(TBST)浸泡,并与辣根过氧化物酶标记的二抗在室温下孵育1 h,免疫反应条带由ECL试剂盒和成像系统确定,以β-actin为内参,采用ImageJ软件进行定量分析。
1.3 统计学分析
采用SPSS 20.0软件进行统计处理,试验数据均以xˉ±s表示,组间比较采用单因素方差分析统计,P<0.05为差异具有统计学意义。
2 结果
2.1 复方皂刺汤联合化疗对非小细胞肺癌裸鼠移植瘤体积和质量的影响
裸鼠接种A549细胞悬液,7~10 d可见瘤体出现,成瘤率100%,裸鼠在接种后精神、活动、饮食等行为未出现明显不适,模型构建成功图及瘤体图如图1所示。给药第3和7天时各组裸鼠移植瘤体积差异无统计学意义(P>0.05);给药第14和21天时,与模型组比较,其他4组裸鼠肿瘤体积均明显减小(P<0.05),与复方皂刺汤组比较,复方皂刺汤联合GP方案化疗组裸鼠肿瘤体积明显减小(P<0.05);给药第21天时,与GP方案化疗组比较,复方皂刺汤联合GP方案化疗组裸鼠肿瘤体积明显减小(P<0.05);给药第21天时,与顺铂组比较,复方皂刺汤联合GP方案化疗组裸鼠肿瘤体积明显减小(P<0.05)(表1)。给药第21天,与模型组比较,其他4组裸鼠瘤质量明显降低,抑瘤率明显升高(P<0.05),与复方皂刺汤组、GP方案化疗组、顺铂组比较,复方皂刺汤联合GP方案化疗组裸鼠瘤质量明显降低,抑瘤率明显升高(P<0.05),见表2。与模型组比较,*P<0.05;与复方皂刺汤组比较,#P<0.05;与GP方案化疗组比较,ΔP<0.05;与顺铂组比较,▲P<0.05.

表1 各组裸鼠移植瘤体积的变化(mm3,n=10)
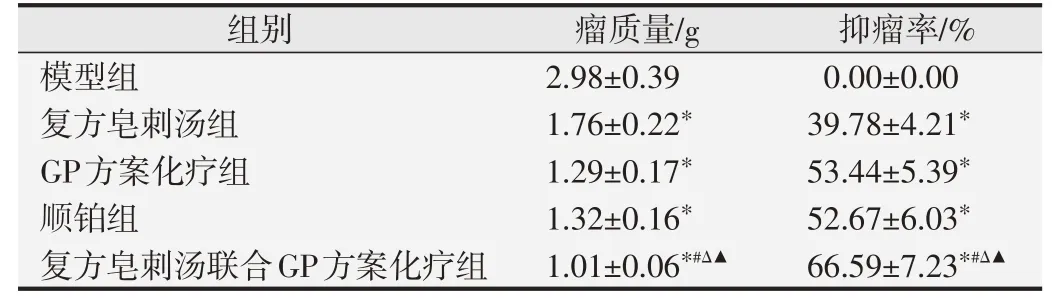
表2 各组裸鼠移植瘤第21天瘤质量及抑瘤率(n=10)

图1 模型构建成功图及不同组处理后肿瘤图
2.2 复方皂刺汤联合化疗对非小细胞肺癌裸鼠移植瘤生长能力的影响
TUNEL染色结果如图2A和C所示,与模型组比较,其他4组细胞凋亡率均明显升高(P<0.05);与复方皂刺汤组比较,GP方案化疗组、顺铂组、复方皂刺汤联合GP方案化疗组细胞凋亡率明显升高(P<0.05);与GP方案化疗组比较,复方皂刺汤联合GP方案化疗组细胞凋亡率明显升高(P<0.05);与顺铂组比较,复方皂刺汤联合GP方案化疗组细胞凋亡率明显升高(P<0.01)。免疫组化结果显示如图2B和D所示,与模型组比较,GP方案化疗组、顺铂组、复方皂刺汤联合GP方案化疗组Ki67表达明显降低(P<0.05);与复方皂刺汤组比较,GP方案化疗组、复方皂刺汤联合GP方案化疗组Ki67表达明显降低(P<0.05);与GP方案化疗组、顺铂组比较,复方皂刺汤联合GP方案化疗组Ki67表达明显降低(P<0.05)。

图2 各组裸鼠移植瘤细胞凋亡情况
Western blot分析结果如图3所示,与模型组比较,GP方案化疗组、顺铂组、复方皂刺汤联合GP方案化疗组Bax、Caspase-3蛋白表达明显升高,Bcl-2蛋白表达明显降低(P<0.05);与GP方案化疗组、顺铂组比较,复方皂刺汤联合GP方案化疗组Bax、Caspase-3蛋白表达明显升高,Bcl-2蛋白表达明显降低(P<0.05)。

图3 各组裸鼠肿瘤组织Bax、Bcl-2、Caspase-3蛋白表达情况
2.3 复方皂刺汤联合化疗对非小细胞肺癌裸鼠血清炎症因子的影响
ELISA检测结果如表3所示,与模型组比较,其他4组小鼠血清IL-6、TNF-α浓度明显降低,IL-4浓度明显升高(P<0.05);与复方皂刺汤组比较,GP方案化疗组、顺铂组、复方皂刺汤联合GP方案化疗组IL-6、TNF-α浓度明显降低,顺铂组、复方皂刺汤联合GP方案化疗组IL-4浓度明显升高(P<0.05);与GP方案化疗组比较,复方皂刺汤联合GP方案化疗组IL-6、TNF-α浓度明显降低,IL-4浓度明显升高(P<0.05);与顺铂组比较,复方皂刺汤联合GP方案化疗组IL-6浓度明显降低(P<0.05),IL-4、TNF-α浓度差异无明显统计学含量(P>0.05)。

表3 各组裸鼠血清IL-4、IL-6、TNF-α浓度(n=10)
2.4 复方皂刺汤联合化疗对非小细胞肺癌裸鼠移植瘤血管生成相关细胞因子的影响
免疫组化结果如图4所示,与模型组比较,其他4组CD31、VEGF蛋白表达明显降低,GP方案化疗组、顺铂组、复方皂刺汤联合GP方案化疗组α-SMA蛋白表达明显降低(P<0.05);与复方皂刺汤组比较,顺铂组、复方皂刺汤联合GP方案化疗组CD31蛋白表达降低,GP方案化疗组、复方皂刺汤联合GP方案化疗组α-SMA蛋白表达明显降低,GP方案化疗组、顺铂组、复方皂刺汤联合GP方案化疗组VEGF蛋白表达明显降低(P<0.05);与GP方案化疗组、顺铂组比较,复方皂刺汤联合GP方案化疗组CD31、α-SMA、VEGF蛋白表达明显降低(P<0.05)。
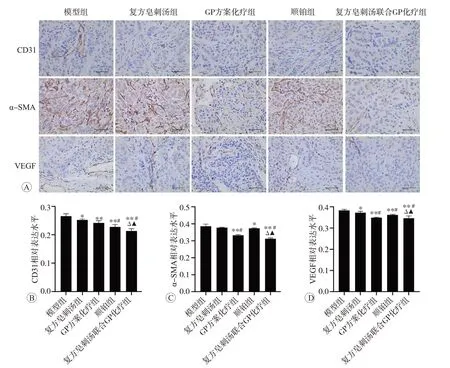
图4 各组裸鼠肿瘤组织CD31、α-SMA、VEGF蛋白相对表达水平
3 讨论
当前NSCLC化疗方案引发的不良临床反应推动着研究者寻找新的治疗策略,开发有效的、副作用少的中药联合化疗将有助于改善肺癌患者的临床结局[9]。复方皂刺汤已显示出体内对NSCLC的抗肿瘤活性[10]。然而,关于复方皂刺汤对提高GP方案化疗抑制NSCLC生长的机制尚未见报道。因此,本研究评估了复方皂刺汤在GP方案化疗基础上抗NSCLC的机制,以期为抗NSCLC治疗提供基础依据。
诱导细胞凋亡是抗癌药物的关键机制[11],为了研究复方皂刺汤对提高GP方案化疗的细胞毒性,本研究分析了肿瘤组织细胞的凋亡。与单一药物比较,在复方皂刺汤联合GP方案化疗中,TUNEL阳性染色和染色质凝集明显。与我们的结果相似,中药制剂华蟾素联合吉西他滨治疗NSCLC可以进一步降低HCC827细胞活力,提高细胞生存抑制率[12]。此外,评估复方皂刺汤联合GP方案化疗对裸鼠A549细胞移植瘤的抗肿瘤效果,结果表明复方皂刺汤联合GP方案化疗组裸鼠的平均肿瘤体积和瘤质量明显低于模型组、复方皂刺汤组、顺铂组、GP方案化疗。这表明复方皂刺汤联合GP方案化疗具有良好的毒性,复方皂刺汤联合GP方案化疗比GP方案化疗疗法更具优势。多项研究提供的证据表明,与单一药物治疗比较,吉西他滨与其他药物如双氢青蒿素[13]、紫杉醇[14]、拓扑替康[15]联合使用可以增强对肿瘤生长的抑制,我们的结果与其报道具有相似性。以往研究表明,GP方案化疗可诱导多种促凋亡反应,从而诱导多种肿瘤的细胞凋亡[16]。P53蛋白的激活在肿瘤细胞对药物的反应中起着至关重要的作用,而Bax是其下游的效应蛋白[17],在复方皂刺汤联合GP方案化疗作用下,Bax蛋白被激活,提示复方皂刺汤联合GP方案化疗可能导致NSCLC发生细胞凋亡。Caspase-3是由不同刺激引发的细胞凋亡关键的蛋白水解酶介体,Bcl-2则为细胞存活率蛋白[18]。复方皂刺汤联合GP方案化疗处理激活了Caspase-3蛋白,抑制Bcl-2蛋白表达,与我们的结果一致的是,大黄素和吉西他滨联合治疗导致胰腺癌耐药细胞株Bxpc-3/Gem细胞增殖减少,细胞凋亡增加[19]。表明复方皂刺汤联合GP方案化疗可能通过下调抗凋亡基因Bcl-2和上调促凋亡基因Bax来实现促NSCLC发生细胞凋亡。
基于体外抗血管生成和细胞凋亡活性,本研究评估了复方皂刺汤联合GP方案化疗对NSCLC血管生成的影响。VEGF在体内和体外均是一种有效的血管生成诱导剂,VEGF在多种人类肿瘤中表达上调,包括肺癌,而实体肿瘤的发展似乎需要VEGF刺激的血管生成[6]。抑制VEGF的表达反过来又能抑制体内的肿瘤血管生成和缩小裸鼠的肿瘤体积,VEGF也经常在血管生成抑制剂的临床试验中被评估,并被接受为药物活性的标志[20]。CD31是跨膜糖蛋白,在血管内皮细胞的连接处高表达,是内皮细胞标志物,CD31是特异性的新生血管标记物[21]。α-SMA阳性表达于血管周围,在淀粉样血管病变中发现α-SMA表达减少,可能会影响血管的功能[22]。在本研究中,我们发现复方皂刺汤联合GP方案化疗抑制了NSCLC裸鼠肿瘤组织CD31、α-SMA、VEGF的产生。这表明复方皂刺汤联合GP方案化疗抑制血管生成可能是减少毒性化疗的机制之一。Hou等[23]研究显示在EPIC1敲除的荷瘤小鼠中,肿瘤组织中CD31的表达减少,抑制了血管生成,我们的结果与其相似。此外,TNF-α是广泛分布于内皮细胞表面的细胞因子,与内皮细胞的增殖、血管新生密切相关。IL-6在肿瘤患者中呈现高表达状态,可作为诊断标志物,而IL-4、VEGF可参与机体免疫耐受,在肿瘤复发中发挥重要作用[24-25]。本研究结果显示复方皂刺汤联合GP方案化疗抑制了NSCLC裸鼠血清中IL-6、TNF-α含量,促进了IL-4含量升高。这表明复方皂刺汤联合GP方案化疗抑制了血清促炎症因子的释放。
综上所述,本研究结果表明复方皂刺汤联合GP方案化疗在抑制NSCLC裸鼠移植瘤模型中的肿瘤生长方面具有积极效果。复方皂刺汤联合GP方案化疗抑制血管生成、诱导细胞凋亡,复方皂刺汤增强了GP方案化疗的抗肿瘤活性。复方皂刺汤联合化疗的使用可能是NSCLC治疗的一种有前途的治疗策略。
