嘌呤能受体X1与肺腺癌预后及免疫细胞浸润的相关性研究
2022-10-09于运亮王莉莉封建凯
于运亮,王莉莉,李 婷,封建凯,*
(1.滨州医学院烟台附属医院检验科,山东烟台 264100;2.烟台市烟台山医院病理科,山东 烟台264000)
ATP受体在肿瘤微环境(tumor microenvironment,TME)中广泛表达于免疫细胞表面,细胞外ATP可与受体结合直接影响癌症进展[1]。嘌呤能受体X1(purinergic receptor,P2RX1)作为ATP门控离子通道受体家族成员,与免疫细胞激活、肿瘤进展及炎症因子的释放等有关[2-4]。P2RX1作用于酸性核磷蛋白32A可影响乙酰化调控分子H3的富集进而促进白血病的发生[5]。胰腺癌肝转移TME中ATP受体P2RX1阴性的中性粒细胞亚群浸润增多,该中性粒细胞通过表达PDL1等免疫抑制分子介导胰腺癌肝转移[6-7]。目前,关于P2RX1是否参与非小细胞肺癌(non-small cell lung carcinoma,NSCLC)的发生、发展的研究鲜有报道。NSCLC包 括 肺 鳞 癌(lung squamous cell carcinoma,LUSC)和肺腺癌(lung adenocarcinoma,LUAD)两种组织类型,本研究综合分析发现P2RX1的表达与LUAD患者预后及TME中免疫细胞的浸润有关,为NSCLC的免疫治疗提供了新的分子靶标。
1 材料与方法
1.1 研究流程图
本研究从UCSC(http://xenabrowser.net)数据库中下载经统一标准化的癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据集,随后提取P2RX1基因在各个样本中的表达数据,对数据集进行转换后,剔除单个肿瘤小于10个样本的数据进行预后分析,并利用R软件包对数据集进行筛选分析,具体分析流程图如图1。

图1 分析流程图
1.2 NSCLC中P2RX1的表达水平
TIMER在线数据库(https://cistrome.shinyapps.io/timer/)可用于检测肿瘤组织中免疫细胞(B细胞、CD4+T细胞、CD8+T细胞、中性粒细胞、巨噬细胞和树突状细胞)的浸润情况,可量化分析免疫细胞浸润比例。利用TIMER 2.0数据库“Diff Exp”模块分析TCGA数据库来源的32种癌症中正常组织和肿瘤组织P2RX1的表达差异。基于TCGA和GTEx数据库,利用GEPIA 2.0数据库“Expression DIY”模块进一步验证P2RX1在NSCLC及其亚型中的表达。
1.3 预后分析
LinkedOmics数据库(http://www.linkedomics.org/)包含了多种癌症的数据和临床信息,集成了针对TCGA数据库的蛋白质组学样本。GEPIA数据库(http://gepia.cancer-pku.cn)同样是基于TCGA数据库开发而来的癌症在线研究数据库。在TCGA数据库中,根据病人的ID信息查找临床随访信息。本研究利用GEPIA 2.0数据库对477例LUAD患者和480例LUSC患者进行预后分析,利用LinkedOmics数据库进一步验证,并分析P2RX1的表达与LUAD患者肿瘤纯度(指肿瘤组织中肿瘤细胞所占的比例)、分期等临床病理因素之间的关系。利用MethSurv数据库(https://biit.cs.ut.ee/methsurv/)对不同甲基化CpG位点进行分析,将P2RX1甲基化模式与LUAD患者的不同临床病理特征(民族、种族、年龄、生存等)和基因亚区域相关联,以热图的形式对P2RX1中单个CpG进行聚类分析。随后,进一步分析TCGA来源的每个CpG位点的P2RX1的甲基化水平与患者预后的关系。
1.4 富集分析
利用LinkedOmics数据库(http://www.linkedomics.org)下载包含P2RX1表达水平的基因芯片数据集,筛选LUAD中与P2RX1正相关的前100个共表达基因。筛选UALCAN数据库(http://ualcan.path.uab.edu)中与P2RX1正相关基因的前100个,与上述LinkedOmics数据库筛选的基因取交集,共得到79个共表达基因在两组数据集中均存在。对此79个共表达基因进行基因本体(gene ontology,GO)功能注释和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路分析。利用R软件包“clusterProfiler”“ggplot2”“circlize”“enrichplot”等工具进行分析并绘图。
1.5 核心基因的筛选与预后分析
STRING数据库(https://cn.string-db.org)是分析目的基因与蛋白相互作用的在线检索数据库,包含已证实的和可以预测的蛋白质-蛋白质相互作用的生物数据库和网络资源。本研究将筛选的79个基因导入STRING在线数据库,物种选择类型为“Homo sapiens”,置信度选择“Medium 0.400”,相互作用最大数选择10,得到基因的相互作用网络后将数据导入至Cytoscape软件。利用Cytoscape插件“CytoHubba”挑选出与周围基因具有高度连通性的前10个基因作为核心基因,随后根据互相作用节点的数量进行降序排序。利用GEPIA 2.0分析核心基因在LUAD和正常肺组织中的表达差异,并分析核心基因的表达与LUAD患者总生存期(overall survival,OS)之间的关系。
1.6 P2RX1的表达与免疫浸润的相关性
本研究利用TIMER 2.0数据库分析P2RX1与肿瘤纯度及浸润在TME中的B细胞、CD4+T细胞、CD8+T细胞、巨噬细胞、中性粒细胞和树突状细胞的相关性,分析经肿瘤纯度校准后P2RX1与B细胞标记基因CD19、CD79A和CD79B的相关性。下载TIMER 2.0中32种癌症的免疫细胞浸润得分数据,利用R软件包“estimate”、“circlize”等工具分析并可视化P2RX1与32种肿瘤中47种常见免疫检查点、免疫和基质综合评分(ESTIMATE Score)、免疫细胞评分(Immune Score)和基质评分(Stromal Score)之间的相关性。
1.7 统计学方法
所有统计分析均通过R3.6.3软件进行。正常肺组织和NSCLC组织之间P2RX1的表达差异采用t检验。生存分析用Kaplan-Meier和Log-rank检验分析。使用Spearman相关性检验分析P2RX1与免疫细胞浸润、免疫细胞/基质评分、免疫检查点的相关性。以P<0.05表示差异有统计学意义。
2 结果
2.1 P2RX1在NSCLC中低表达
TIMER 2.0数据库显示P2RX1在正常肺组织中的表达明显高于LUAD和LUSC患者(图2A)。GEPIA 2.0数据库显示与正常肺组织比较,P2RX1在LUAD和LUSC患者中表达下调(图2B)。另外,与正常肺组织比较,P2RX1在近端炎症型、近端增殖型和终末呼吸单位型3种不同LUAD亚型中的表达显著下调(图2C);在基底型、经典型、原生型和分泌型4种LUSC亚型中的表达亦显著下调(图2D)。

图2 P2RX1在NSCLC中的表达水平
2.2 P2RX1低表达的LUAD患者预后不良
GEPIA 2.0数据库及LinkedOmics结果均显示P2RX1高表达的LUAD患者OS较长(图3A和B),而P2RX1的表达与LUSC患者OS无明显相关关系(P=0.099)。P2RX1的表达与LUAD患者肿瘤纯度呈负相关关系(图3C,r=-0.5402,P=1.299×10-38),与LUAD患者的T分期(图3D,P=3.856×10-4)、病理分期(图3E,P=9.66×10-3)、N分期(图3F,P=0.154×10-2)有关。

图3 P2RX1的表达与LUAD患者预后关系
2.3 P2RX1甲基化与LUAD患者预后有关
MethSurv数 据库显示P2RX1中cg12709970位 点甲 基 化 水 平 较 低,而cg06475633、cg22506042、cg14116792等CpG位点甲基化水平较高(图4A)。在这些CpG位点中,cg06475633(图4B)和cg03368358(图4C)甲基化水平高的患者总生存期较短,预后较差。

图4 P2RX1中CpG位点甲基化水平
2.4 P2RX1共表达基因参与免疫调控
对LinkedOmics和UALCAN数据库筛选的79个基因(相关系数r>0.5,P<0.01)进行富集分析,结果显示这些基因主要参与B细胞受体信号通路、原发性免疫缺陷信号通路等(图5A);参与白细胞分化、淋巴细胞分化、T细胞激活、白细胞激活等多种生物学进程(图5B和E);参与构成足小体等(图5C);主要富集于磷脂结合、核苷三磷酸酶调控、GTP酶激活等多种分子功能(图5D和F)。

图5 LUAD中P2RX1共表达基因的富集分析
2.5 核心基因与LUAD患者预后有关
根据前文的筛选条件得到10个核心基因的顺序依次为BTK、IKZF1、SASH3、CD79B、CD19、ZAP70、IL10RA、CD79A、WAS和CYTIP(图6A)。利用GEPIA 2.0分析上述核心基因在LUAD中的表达,结果显示除CD79B、CD19和CD79A外,其余7个核心基因在LUAD中的表达均显著下调(P<0.05,图6B)。对核心基因进行预后分析,结果显示除IL10RA和WAS(图6I和K)外,其余8个核心基因低表达的患者OS均明显缩短(图6C~L)。

图6 核心基因的筛选与预后分析
2.6 P2RX1与多种免疫细胞浸润及免疫检查点相关
TIMER 2.0数据库显示在LUAD中P2RX1与肿瘤纯度呈显著负相关关系,而与B细胞、CD8+T细胞、CD4+T细胞、巨噬细胞、中性粒细胞和树突状细胞呈显著正相关关系(P均<0.05,图7A)。经肿瘤纯度校准后,P2RX1的表达与B细胞标记基因CD19、CD79A和CD79B呈正相关关系(P均<0.05,图7B~D)。
另外,本研究还发现在LUAD中P2RX1的表达与ADORA2A、BTLA、BTNL2、CD160、CD200、CD200R1、CD244、CD27、CD276、CD40等 呈 正 相 关 关 系(图7E,P<0.05)。

图7 P2RX1的表达与免疫细胞浸润及免疫检查点的相关性分析
2.7 P2RX1与免疫/基质评分正相关
利用TIMER 2.0数据库和R3.6.3软件为免疫细胞/基质比例等评分并作图,结果显示除弥漫性大B细胞淋巴瘤(DLBC)、多形成性胶质细胞瘤(GBM)、急性髓细胞样白血病(LAML)等外,其他20多种肿瘤TME中P2RX1的表达与免疫/基质评分均相关(图8)。在LUAD中,P2RX1的表达分别与免疫和基质综合评分(r=0.592)、免疫细胞评分(r=0.582)和基质细胞评分(r=0.513)均呈正相关(均为P<0.05)。
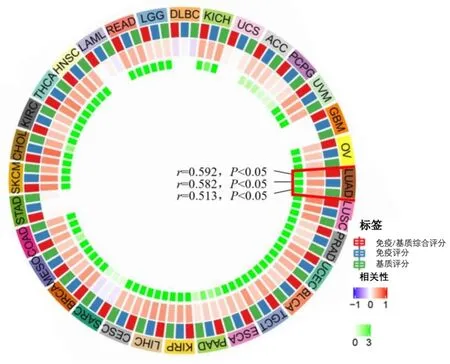
图8 32种肿瘤中P2RX1的表达与免疫基质综合评分、免疫细胞评分及基质评分之间的关系
3 讨论
嘌呤能受体X1是门控膜离子通道重要的组成部分,广泛参与机体ATP传递、免疫应答、细胞增殖等生物学过程[8]。研究证实,P2RX1在人体内发挥重要的调控作用,与血小板聚集、免疫应答、细胞因子释放以及ATP介导的细胞凋亡等过程有关[7]。本研究发现P2RX1在NSCLC不同亚型(LUAD和LUSC)中的表达显著下调,但LUAD和LUSC两组之间P2RX1的表达无明显差异。高表达P2RX1的LUAD患者OS较长,预后较好,而P2RX1与LUSC患者总生存期无关。P2RX1与LUAD患者肿瘤纯度呈负相关,与患者的TNM分期等有关,提示P2RX1可能在LUAD中扮演重要的抑癌因子的角色。DNA甲基化作为真核细胞正常的修饰方式,其异常在NSCLC的进展中至关重要[9]。本研究发现P2RX1多个CpG位点显示了较高的甲基化水平,其中cg06475633和cg03368358这两个CpG位点甲基化水平较高的患者预后较差,这一发现为后期P2RX1用于临床诊断和治疗奠定了基础。
为了探索P2RX1在LUAD中的潜在机制和生物学功能,本研究对P2RX1共表达基因进行了富集分析。结果发现P2RX1共表达基因在免疫细胞尤其是B细胞活化、分化等生物学进程和功能中明显富集,与机体NTP酶和GTP酶等能量代谢的调控密切相关,提示P2RX1可能通过调控TMR中的能量代谢进而影响LUAD的进展,这一发现与之前P2RX1在胰腺癌中调控免疫细胞能量代谢的作用相似[7]。P2RX1共表达基因调控网络中的核心基因主要有BTK、IKZF1、SASH3等,它们在LUAD表达显著下调且与LUAD预后有关,进一步提示P2RX1可能参与肿瘤微环境重塑、淋巴细胞的分化和发育等过程。
利用TIMER 2.0数据库深入分析显示P2RX1不仅与LUAD肿瘤纯度呈负相关,而且还与不同免疫细胞尤其是与B细胞浸润相关,与其标记基因CD19、CD79A、CD79B显著正相关。这3个基因作为P2RX1共表达基因的蛋白互作网路中的核心基因,其低表达的LUAD患者预后不良。上述结果提示P2RX1可能参与B细胞从原细胞期分化增殖到浆细胞期的整个过程以及B细胞活化信号传导、细胞因子释放等过程。针对LUAD患者使用程序性死亡受体1(programmed death 1,PD-1/PD-L1)免疫检查点抑制剂可诱导或增强机体抗肿瘤反应[10]。PD-1通过与其配体PD-L1和PD-L2结合进而调控T细胞增殖和免疫反应[11-13]。通过联合使用细胞毒性T淋巴细胞抗原4(cytotoxic T lymphocyte-associated antigen-4,CTLA-4)抗体和PD-1抗体可增强肿瘤浸润淋巴细胞的增殖能力进而抑制肿瘤细胞增殖[14]。本研究发现P2RX1与CTLA-4及PD-1呈正相关,提示P2RX1可直接或间接调控CTLA-4、PD-L1等的表达进而抑制T细胞的活化,诱发抗肿瘤免疫反应。另外,P2RX1还与BTLA、LAIR、CD27等31种常见免疫检查点显著相关,说明P2RX1可能在TME中发挥广泛而又复杂的免疫调控作用。在TME中,免疫细胞和基质成分是两种主要的非肿瘤组分,对于肿瘤的诊断和预后评估具有很高的价值[15-16]。本研究发现P2RX1不仅与免疫细胞浸润高度相关,还与肿瘤免疫/基质细胞评分呈正相关,提示P2RX1可能在免疫细胞和基质成分的动态调控过程中发挥正向调控作用。本研究不仅探索了P2RX1的表达及甲基化与LUAD患者预后的相关关系,还初步揭示了P2RX1在LUAD肿瘤微环境中参与的免疫调控作用,但本研究针对P2RX1转录组水平的分析尚不能解释该分子参与的具体调控机制,关于P2RX1是否对LUAD肿瘤细胞具有调控作用也需要进一步研究证实,因此本研究需要更多的生物学实验来验证结论。
综上所述,本研究发现P2RX1在LUAD中低表达与患者预后不良有关,P2RX1可能在LUAD中发挥重要的免疫调控作用,与B细胞增殖、分化等多种过程有关。对P2RX1基因进行更深层次的研究,不仅可以揭示该基因的功能,还可以进一步探索P2RX1与肿瘤发生、发展之间的关系,可为进一步探索P2RX1在LUAD中的免疫调控机制奠定基础。
