影响结直肠癌PDX模型建模结果的临床病理因素探讨*
2022-10-09李文鑫张子函陈中阳林益镕王玉龙陈大为张森
李文鑫,张子函,陈中阳,林益镕,王玉龙,陈大为,张森△
1 广西医科大学第一附属医院结直肠肛门外科 广西南宁 530021
2 广西消化道肿瘤加速康复外科基础研究重点实验室 广西南宁 530021
3 创模生物科技(北京)有限公司 北京 102200
尽管随着临床诊疗技术的发展,结直肠癌患者的5年生存率有所提高,但总体治疗效果仍有待进一步改善。其中,肿瘤异质性是值得关注的影响治疗预后的因素[1]。因此,开展肿瘤特异性敏感药物的相关研究应能给临床治疗带来获益。不同患者对药物的敏感性不同,若要筛选出能使患者个体受益更大化的药物,需要获得患者的“个体化信息”,由此认为,建立肿瘤模型可有助于解决该问题。
近年来,人源肿瘤异种移植(patient-derived xenografts,PDX)模型受到了学者们的关注[2-3]。建立PDX模型需要直接将患者的肿瘤组织移植至免疫缺陷小鼠体内[4],除肿瘤组织结构和细胞形态外,PDX模型还保留了肿瘤的分子生物学和遗传学特征[5-7],能够更加准确地反映肿瘤的病理状态及其微环境,有助于为临床治疗提供更为个体化的治疗依据[8]。此外,PDX模型也可为抗癌药物的研究提供一定的实验基础[9]。但是,基于现有的文献报道,PDX模型的建模成功率较低,其中结直肠癌PDX模型的建模成功率为30%~63.5%[10-12]。影响PDX模型建模结果的因素有多种,包括患者临床病理因素、移植动物种类和移植部位等[11]。在本研究中,我们重点探讨影响结直肠癌PDX模型建模结果的患者临床病理因素,以期为后续研究的开展提供一定参考。
1 资料与方法
1.1 一般资料
肿瘤组织标本来自广西医科大学第一附属医院结直肠肛门外科2021年4月至2021年8月所收治的119例手术患者。纳入患者为初诊患者,并非多原发癌,术前未接受新辅助放化疗,临床病理资料完整。本研究经广西医科大学第一附属医院伦理委员会批准(2022-KY-E-028)。
1.2 实验动物
实验动物选用6~8周龄NPSG小鼠,体重18~20g,购买自上海吉辉实验动物饲养有限公司(批号0013889、0014255、0014986),饲养于创模生物科技(北京)有限公司。饲养环境相对湿度约为50%,温度控制在20~26℃,给予充足饲料和饮水,12 h/12 h固定灯光周期。动物实验方案通过创模生物IACUC委员会审批(IM-PDX-WGYL-20210101)。
1.3 实验方法
1.3.1 标本处理 结直肠癌肿瘤组织标本离体30min内用组织保存液置于4℃保存,首先观察标本大小,并明确标本是否完全浸没在保存液中,标本温度是否为2~8℃,保存液是否有异味、渗漏或污染。将肿瘤组织标本倒入一次性平皿,用镊子将肿瘤组织标本转移至磷酸盐缓冲液(phosphate buffered saline,PBS)中,用手术刀切割成直径1 mm的细条或直径不超过1 mm的小块。保留绿豆大小标本用于短片段重复序列(short tandem repeat,STR)检测质控后,将肿瘤组织标本转移至15 mL离心管中,加入5 mL消化酶。根据标本情况,于4℃条件下放置合宜时长。用一次性巴氏吸管吹打3~5 min,若瘤块堵住吸管口,可将吸管在离心管底部戳动几下。吹打至消化液混浊,可吸出10 μL消化液简单计数,预估细胞量,并观察细胞是否成团,成团应继续吹打。若已经分散为单细胞,加入5 mL PBS稀释后继续吹打10次,静置1 min待剩余残渣沉降至管底,吸取上清过筛。用100 μM细胞过滤器过滤细胞,过滤后再用10~20 mL PBS清洗细胞过滤器,在4℃、300 g条件下离心10 min后收集细胞,小心吸取底部沉淀或倒掉上清。吸取的肿瘤细胞直接加入5倍体积的1×红细胞裂解液,于室温放置5 min后在4℃、300 g条件下离心5 min后收集细胞。
1.3.2 肿瘤移植 将肿瘤组织标本消化成单细胞后,在单细胞悬液中添加血管内皮生长因子(vascular endothelial growth factor,VEGF)、表皮生长因子(epidermal growth factor,EGF)、成纤维细胞生长因子(basic fibroblast growth factor,bFGF)、ROCK-1抑制剂、胰岛素及氢化可的松,并按1:1比例添加Matrigel,接种于NPSG小鼠侧肩部皮下。待肿瘤生长至800~1 000 mm3,采用过量二氧化碳吸入方式处死小鼠,收集肿瘤,建立PDX模型种子库P0代,保存于-80℃超低温冰箱。收取少量速冻标本,用于基因组学分析、STR质控及病原微生物检测。将标本消化为单细胞,用于体内实验P1代接种。
1.3.3 肿瘤移植成功与失败的判断标准 肿瘤移植成功与失败的判断标准参照参考文献[5]与参考文献[13]制定。成功标准:肿瘤移植后小鼠成瘤,且小鼠肿瘤能正常传代。失败标准:小鼠接种成瘤后小鼠死亡、肿瘤回缩,或接种5个月后未成瘤。
1.4 患者临床病理资料收集
收集患者年龄,性别,合并慢性病(如高血压病、糖尿病、心血管疾病),肿瘤部位,肿瘤占据肠腔周径,肿瘤最大径,术前CEA,术前CA199,术前CA125,术前其他器官转移(根据术前胸腹盆CT检查结果判断),肿瘤大体分型,肿瘤组织学分类,肠壁浸润程度,淋巴结转移,神经侵犯,脉管侵犯,肿瘤Ki-67等指标信息。其中,Ki-67分级参照参考文献[13],根据二氨基联苯胺(diaminobenzidine,DAB)免疫染色结果定义等级:“N”为阴性,>0~25%为(+),>25%~50%为(++),>50%~75%为(+++),>75%为(++++)。
1.5 研究分组
在剔除PDX模型建模结果的非正常数据后,根据建模结果分为两组(成功组或失败组),再分别对相应的结肠癌患者及直肠癌患者临床病理资料进行分析。
1.6 统计学方法
采用SPSS 26.0软件进行数据分析。计数资料用(n)表示,两组间比较采用χ2检验、校正χ2检验或Fisher确切概率法。以P<0.05为差异有统计学意义。
2 结果
2.1 纳入患者情况及PDX模型建模结果总体情况
共纳入结肠癌患者81例,直肠癌患者38例。有44例PDX模型建模成功,其中结肠癌31例、直肠癌13例,中位建模成功时间为47.5(24.5,83.0)d。各建模成功模型小鼠的成瘤时间见表1。建模成功的模型小鼠荷瘤情况、肿瘤外观及肿瘤镜下病理如图1、图2。
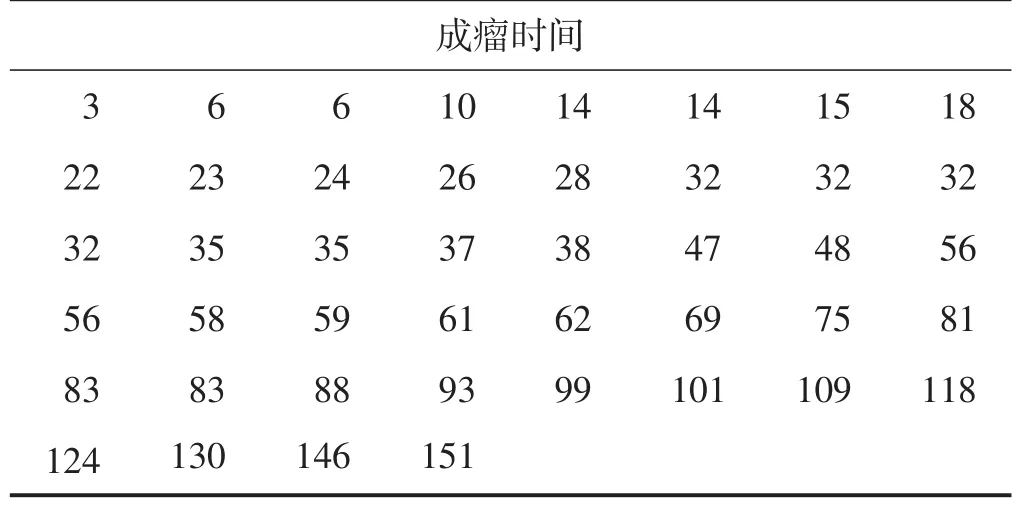
表1 44例建模成功模型小鼠的成瘤时间d
2.2 两组对应的结肠癌患者临床病理资料比较
两组对应的结肠癌患者肿瘤最大径和术前是否存在其他器官转移情况比较差异均有统计学意义(均P<0.05);两组对应的结肠癌患者年龄、性别、合并慢性病情况、肿瘤部位、肿瘤占据肠腔周径、术前CEA水平、术前CA199水平、术前CA125水平、肿瘤大体分型、肿瘤组织学分类、肠壁浸润程度、淋巴结转移情况、神经侵犯情况、脉管侵犯情况、肿瘤Ki-67表达情况比较差异均无统计学意义(均P>0.05)。见表2。

表2 两组对应的结肠癌患者临床病理资料比较n

表2(续)

表2(续)
2.3 两组对应的直肠癌患者临床病理资料比较
两组对应的直肠癌患者神经侵犯情况和术前是否存在其他器官转移情况比较差异均有统计学意义(均P<0.05);两组对应的直肠癌患者年龄、性别、合并慢性病情况、肿瘤占据肠腔周径、肿瘤最大径、术前CEA水平、术前CA199水平、术前CA125水平、肿瘤大体分型、肿瘤组织学分类、肠壁浸润程度、淋巴结转移情况、脉管侵犯情况、Ki-67表达情况比较差异均无统计学意义(均P>0.05)。见表3。

表3 两组对应的直肠癌患者临床病理资料比较n

表3(续)
3 讨论
PDX模型是将肿瘤患者的肿瘤组织移植至免疫缺陷小鼠体内,并使肿瘤组织在小鼠体内生长的一种肿瘤模型。PDX模型最重要的方面是保留患者肿瘤的分子生物学和遗传学特征,可以构成保留患者原始肿瘤特征的临床前模型,用于研究肿瘤进展、肿瘤治疗和肿瘤耐药的机制[14]。与基于肿瘤细胞株的异种移植相比,虽然PDX模型的移植成功率较低,但该技术使得动物模型肿瘤更加接近患者肿瘤,能更好地反映患者的肿瘤信息[15]。
目前,PDX模型已应用于多种肿瘤的研究当中,包括肝癌[15]、肺癌[16]、乳腺癌[17]、胃癌[18]、胰腺癌[19]等,可为抗肿瘤药物的选择提供参考,为探索肿瘤生物标志物及治疗靶标提供实验基础,在结直肠癌领域也已有相关的研究报道。Nunes等[20]对52例结直肠癌PDX模型进行了分析,结果显示这些模型动物对西妥昔单抗的治疗反应与临床患者用药的反应相似。Yao等[21]在对79例结直肠癌PDX模型的研究中发现,同时抑制EGFR和RAF对存在KRAS或BRAF突变的PDX模型具有协同抗肿瘤活性,为存在KRAS或BRAF突变的结直肠癌患者的临床治疗提供参考依据。生物标志物和治疗靶标探索是PDX模型的另外一个应用方向,它可以帮助我们更加深入地了解肿瘤的耐药机制[22]。Bertotti等[7]在一项85例结直肠癌PDX模型研究中发现,HER2特异性扩增与KRAS野生型肿瘤的西妥昔单抗耐药有关,这对于制定个体化的肿瘤治疗策略具有一定的指导意义。
虽然PDX模型有诸多的优点,但其较高的费用和较低的成功率不利于它的普及。因此,如何提高PDX模型的建模成功率成为一个令人关注的研究方向。PDX模型的建模成功率受多种因素的影响。肿瘤类型是其中一个重要的影响因素。不同类型的肿瘤移植成功率不尽相同,结肠癌、胰腺癌、胆道癌等是PDX模型建模成功率较高的肿瘤,而乳腺癌、胃癌、肝癌等的建模成功率较低[23]。而在模型动物方面,不同的动物类型也可能影响建模成功率,比如免疫缺陷的严重程度[24]。此外,移植部位对PDX模型建模成功率也有影响,研究表明皮下移植成瘤率较高[12,14,25]。
在本研究中,我们探讨影响PDX模型建模结果的结直肠癌患者临床病理因素。119例接受手术治疗的结直肠癌患者的肿瘤组织标本进行PDX模型建模后,共有44例取得成功(成功率为37.0%)。结肠癌PDX模型成功建模31例(成功率为38.3%),直肠癌PDX模型成功建模13例(成功率为34.2%),高于Fujii等[11]的建模成功率(约30.0%),但与Oh等[26]的建模成功率(62.2%)存在一定差距。总的来说,我们的总体建模成功率符合预期。随后,我们按照不同的肿瘤类型对患者的临床病理资料分别进行分析,结果提示结肠癌患者的肿瘤最大径及术前是否存在其他器官转移情况与PDX模型建模结果有关,而直肠癌患者的神经侵犯情况及术前是否存在其他器官转移情况与PDX模型建模结果有关。Na等[27]报道,肿瘤最大径是肿瘤移植成功与否的独立影响因素,本研究结果与之相符。但在Choi等[14]的研究中,研究者发现肿瘤大小、是否伴有神经侵犯与PDX模型建模成功率无关。不同研究的结论存在差异可能与纳入研究的肿瘤类型不同有关。Ki-67反映肿瘤细胞的增殖能力,在Na等[27]的研究中发现Ki-67指数高的肿瘤能获得相对更高的移植成功率,另外,Julien等[10]报道术前CEA水平也可能影响PDX模型建模成功率,但在本研究中未观察到类似的结果。本研究发现术前是否存在其他器官转移与PDX模型建模结果有关。类似的,在Oh等[26]的研究中,肿瘤分期晚、肿瘤分化程度低的患者肿瘤移植成功率相对较高,而这也可能是该研究PDX模型建模成功率较高的原因。
本研究存在一定局限性:(1)实验过程中,我们通过保存液和低温保存方法尽量保证了肿瘤组织标本从离体至进入实验阶段的肿瘤细胞活性,但不能除外因部分标本自离体至进入实验室管理的时间把控问题,导致这些标本的肿瘤细胞活性较低,从而影响PDX模型建模成功率。(2)由不同研究人员进行取材操作及其取材效果也可能对研究结果有影响。后续,我们拟围绕相关问题进行讨论与改进,以进一步减少人为因素对研究结果的干扰。
基于本研究认为,术前是否存在其他器官转移与结直肠癌PDX模型建模结果有关。此外,肿瘤最大径、神经侵犯情况分别与结肠癌PDX模型、直肠癌PDX模型建模结果有关。影响PDX模型建模成功率的其他临床病理因素还需进行更多的研究探讨。
利益冲突声明全体作者均声明不存在与本文相关的利益冲突。
