卵形鲳鲹神经坏死病毒基因组的分析及其特异性检测引物的筛选
2022-10-08王君芳杜和禾汤诗琪周永灿曹贞洁
王君芳,杜和禾,汤诗琪,周永灿,曹贞洁,孙 云
(海南大学海南省南海海洋资源利用国家重点实验室,海南省热带水生生物技术重点实验室,海南海口570228)
病毒性神经坏死病(Viral nervous necrosis,VNN)是由神经坏死病毒(Nervous necrosis virus,NNV)引起的,1985年首次发现于澳大利亚、日本、加勒比海地区,并于1990年被日本学者命名[1]. 神经坏死病毒是病毒性脑病以及视网膜病(Viral encephalopathy and retinopathy,VER)的病原体,属于β诺达病毒[2-3]. 通过入侵鱼体,进而导致鱼类脑、视网膜、脊髓等中枢神经系统坏死,主要侵染仔鱼和幼鱼[4-7]. 经报道,海水鱼及淡水鱼均可感染神经坏死病毒,且死亡率高达80%~100%,给渔业养殖带来了巨大经济损失,国际兽疫组织将其列为主要的鱼类病害之一[8-11]. NNV 病毒粒子呈二十面体,基因组由2 条正义单链RNA 构成(RNA1和RNA2). 其中RNA1片段相对较大,约3.0~3.2 kb,其编码的RNA聚合酶参与病毒的复制转录,具有RNA依赖性;RNA2片段相对较小,通常为1.3~1.4 kb,主要编码病毒的衣壳蛋白[12-15].RNA2是NVV引起神经坏死病毒病的决定性基因,T4区是决定基因RNA2的致病区域[16-17]. 根据RNA2的T4区,可将神经坏死病毒分为红鳍东方鲀型(tiger puffer NNV,TPNNV)、拟鲹型(striped jack NNV,SJNNV)、条斑星鲽型(barfin flouder NNV,BFNNV)、赤点石斑鱼型(red-spotted grouper NNV,RGNNV)4种基因型[18-20].Johansen等人还发现了第五种基因型:大菱鲆型(turbot NNV,TNNV)[21]. 到目前为止,已有120多种鱼可检测到神经坏死病毒[11],如虎龙石斑鱼中的NNV-HL[22],斑石鲷中的RGNNV_20200716 和RGNNV_20200725[23],珍珠龙胆石斑鱼中的CNPgg2018[24],点带石斑鱼中的MGNNV[25],卵形鲳鲹中的PNNV[26],以上分离出的NNV 已完成基因组测序. 除此之外,还有大部分鱼类NNV 尚未进行全基因组测序,或者只报道了部分NNV序列.
卵形鲳鲹(Trachinotus ovatus)主要分布在热带及亚热带,能持续游动,从而充分利用养殖空间,是我国特色养殖品种,也是主要的经济养殖鱼类之一,具有良好的发展前景[27-31]. 随着卵形鲳鲹养殖规模的扩大,由细菌、病毒等病原体引起的感染性疾病时有发生,给养殖户带来巨大的经济损失. 有报道指出,神经坏死病毒可引起卵形鲳鲹幼鱼的大规模死亡,对卵形鲳鲹养殖业产生巨大危害[32-33]. 近几年,国内外对神经坏死病毒的检测方法进行了相关报道,主要包括ELISA、RT-LAMP、RT-PCR、qRT-PCR 及细胞分离鉴定等[34]. 其中qRT-PCR 不仅灵敏度高、准确性强、速度快,而且还能对样本进行定量检测,适合于养殖场对病原的快速鉴定[35]. 本研究利用qRT-PCR 技术,建立了一种卵形鲳鲹神经坏死病毒(Golden Pompano NNV,GPNNV)的快速检测方法,并且通过对比筛选出检测速度快、灵敏度高的1对引物,可用于卵形鲳鲹神经坏死病毒的快速诊断,对预防卵形鲳鲹神经坏死病毒病具有重要意义.
1 材料与方法
1.1 实验材料在海南某养殖场发现发病的卵形鲳鲹,症状为典型的神经坏死病毒病,采用RT-PCR 进行检测,结果显示阳性. 将病鱼用液氮冷冻后带回实验室,放-80 ℃保存.
1.2 试剂 总RNA提取试剂盒、RNA反转录试剂盒购于Promega公司;胶回收以及质粒提取试剂盒购于诺唯赞公司;大肠杆菌DH5α、克隆载体pEASY®-T1 Simple Cloning Kit购于全式金公司,其他试剂为国产或进口分析纯.
1.3 方法
1.3.1 神经坏死病毒基因组扩增及分析(1)病毒RNA的提取、反转录:分别取发病卵形鲳鲹的脑部、眼部组织剪碎,按照相应试剂盒的说明书进行总RNA的提取及反转录,产物于-80℃保存备用.
(2)基因扩增、测序分析:参照陈晓艳等[36]设计的7对引物如表1所示,分段扩增卵形鲳鲹神经坏死病毒的RNA1链及RNA2链. 扩增所用引物由海口部擎科生物科技有限公司进行合成. 分别用7对特异性引物,以反转录的cDNA 为模板进行基因扩增.PCR 产物经过2%琼脂糖凝胶电泳进行检测,并按照胶回收试剂盒说明书中的步骤进行纯化. 将纯化产物与pEASY®-T1 载体连接,转入E.coliDH5α 感受态,检测阳性菌株保种后交由华大基因测序,测序结果使用DNAMAN软件进行序列拼接. 将拼接序列上传到Gen-Bank数据库,RNA1片段GenBank登录号为OM305085,RNA2片段GenBank登录号为OM305086.

表1 卵形鲳鲹神经坏死病毒基因组引物序列
1.3.2 构建分子进化树将拼接好的病毒RNA2 序列,与GenBank 中所收录的其他神经坏死病毒RNA2序列进行比对,使用MEGA7.0软件中的邻接法构建分子进化树,建树所用序列如表2所示.
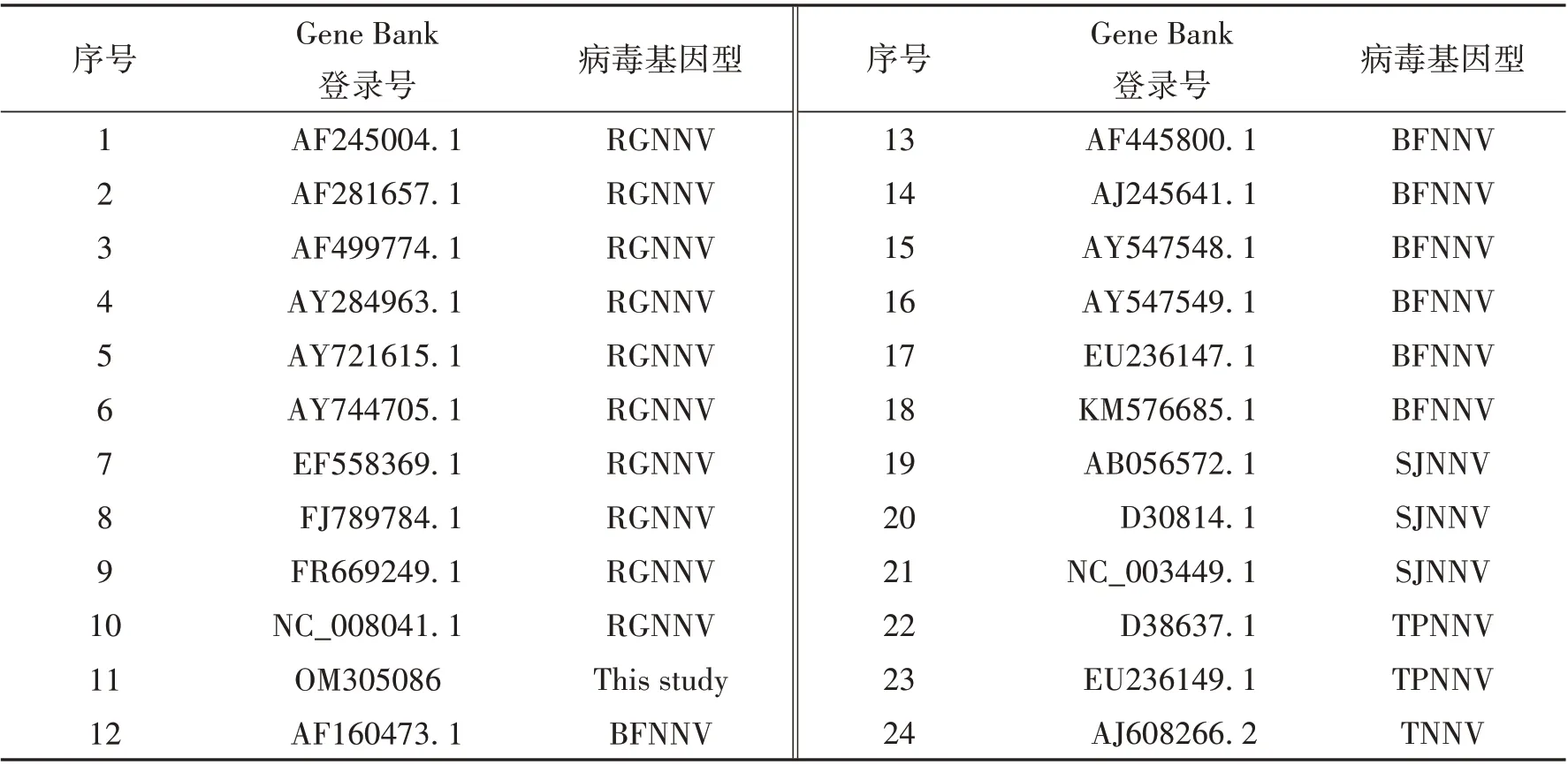
表2 用于构建进化树所用的病毒株
1.3.3 神经坏死病毒检测方法建立及检测引物筛选(1)神经坏死病毒重组质粒的构建:用表3 中的引物对1,以上述反转录的cDNA 为模板进行PCR 扩增. 程序设置为:95 ℃4 min;95 ℃30 s,59 ℃30 s,72 ℃1 min,30 cycles;72 ℃10 min. 程序结束后将PCR 产物采用琼脂糖凝胶电泳进行检测,回收目的基因片段. 将回收产物连接pEASY®-T1 载体,转入E. coliDH5α 感受态,阳性菌株交由华大基因公司进行序列测定.
(2)引物设计与合成:根据GenBank库中所收录的NNV的核苷酸序列,结合本病毒株基因组序列进行同源比对分析后,选择基因保守性较高的区域设计9 对引物,包括常规PCR 引物和qRT-PCR 引物. 引物均用于扩增NNV 编码衣壳蛋白的基因RNA2 的核酸片段. 各引物名称、序列和扩增目的片段大小如表3所示.
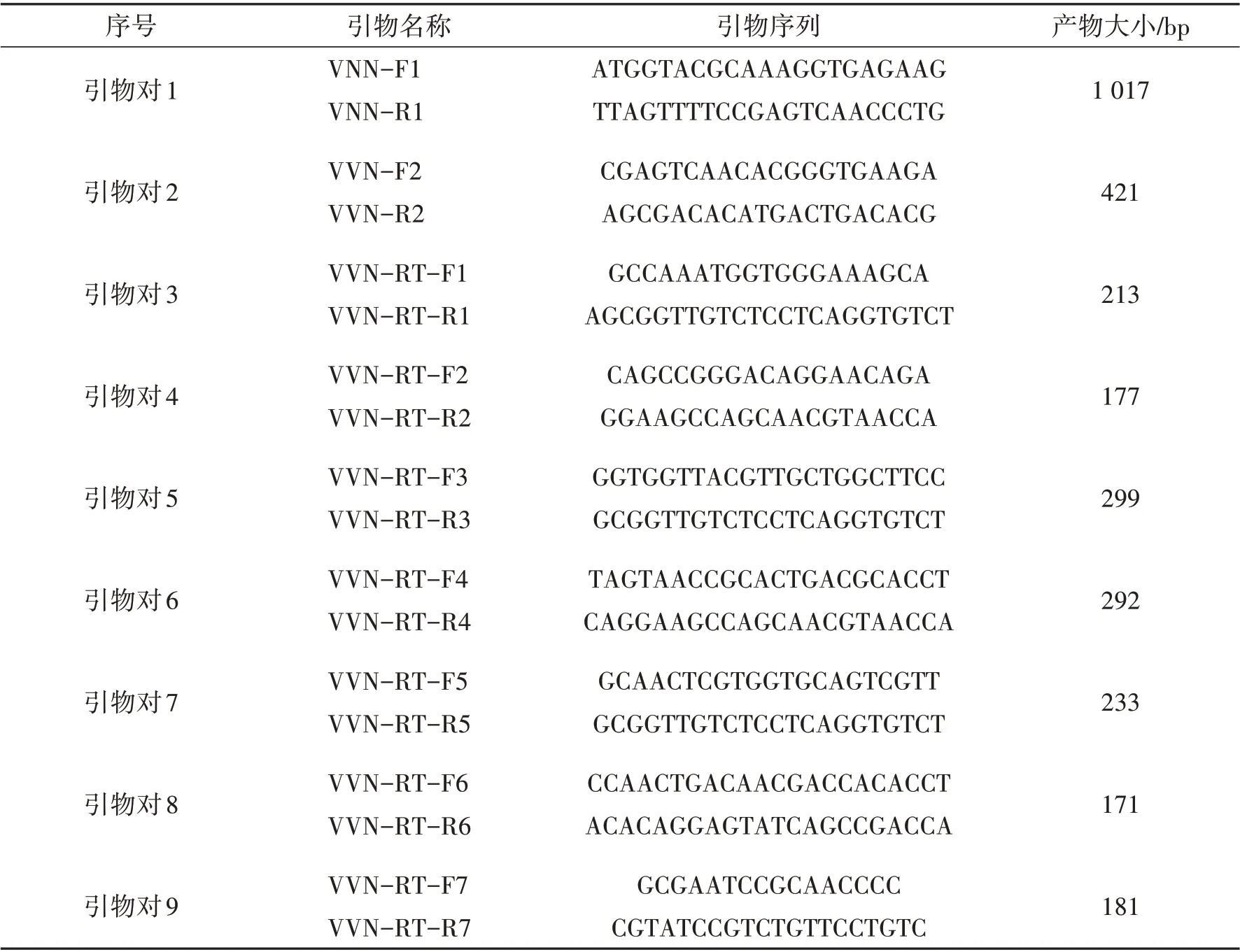
表3 神经坏死病毒检测引物序列
(3)普通PCR 检测:按照质粒DNA 提取试剂盒说明书从1.3.3(1)中转化的E. coliDH5α 中提取重组质粒,并使用NanoDrop 2000 测定所抽提的质粒浓度,按照公式换算成质粒拷贝数. 首先将质粒稀释为108copies·µL-1,然后以10 倍梯度稀释至101copies·µL-1. 将不同稀释度的质粒作为模板,分别以表3 中的引物对1~9 进行PCR 反应,PCR 所设程序为:95 ℃4 min;95 ℃30 s,58 ℃30 s,72 ℃30 s,35 cycles;72 ℃10 min. 反应产物经2%琼脂糖凝胶电泳检测.
(4)荧光定量PCR 检测:使用上述稀释后的质粒,作为荧光定量PCR 绝对定量检测的标准模板,拷贝数依次为101~107copies·µL-1. 荧光定量PCR 反应条件为:95 ℃2 min;95 ℃10 s,60 ℃30 s,40 cycles;Melt 15 s. 经过实时荧光定量PCR 检测,观察其扩增曲线和熔解曲线,根据质粒模板的Log(10)对数值和Ct 值绘制标准曲线.
(5)引物应用效果检测:利用筛选出的最佳引物对,以(1)中反转的病鱼组织cDNA 为模板,以健康鱼组织反转的cDNA 为阴性对照,分别采用普通PCR 及荧光定量PCR 进行病毒检测,验证该引物的应用效果.
2 结 果
2.1 神经坏死病毒基因组扩增及序列拼接用7对引物(YW1-7)分段扩增PGNNV 基因组RNA1 链和RNA2 链,PCR 产物经2%的琼脂糖凝胶电泳检测. 结果显示,7 对引物(YW1-7)扩增后的PCR 产物如图1 所示,大小分别为:472 bp、1 022 bp、1 026 bp、803 bp、431 bp、1 016 bp、585 bp,均与预期相符合. 经拼接后,PGNNV 的RNA1 片段全长为3 104 bp,编码区2 949 bp,编码982 个氨基酸;RNA2 片段全长为1 433 bp,编码区1 017 bp,编码338 个氨基酸.
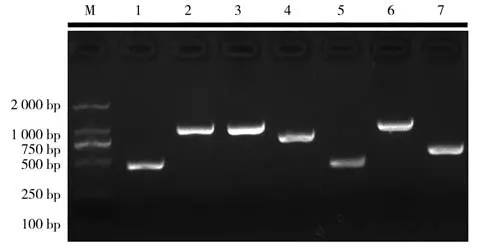
图1 7对引物对PGNNV基因组片段的分段扩增结果
2.2 神经坏死病毒系统进化树分析将卵形鲳鲹神经坏死病毒(PGNNV)的氨基酸序列与GenBank库中已公布的其他神经坏死病毒的氨基酸序列进行比较,结果如图2. 由图2可知,本研究中的PGNNV与RGNNV 基因型的各参比株聚为一支,同源性较高;PGNNV 与SJNNV、TNNV、BFNNV 同源性较低. 综上所述,PGNNV属于RGNNV基因型.
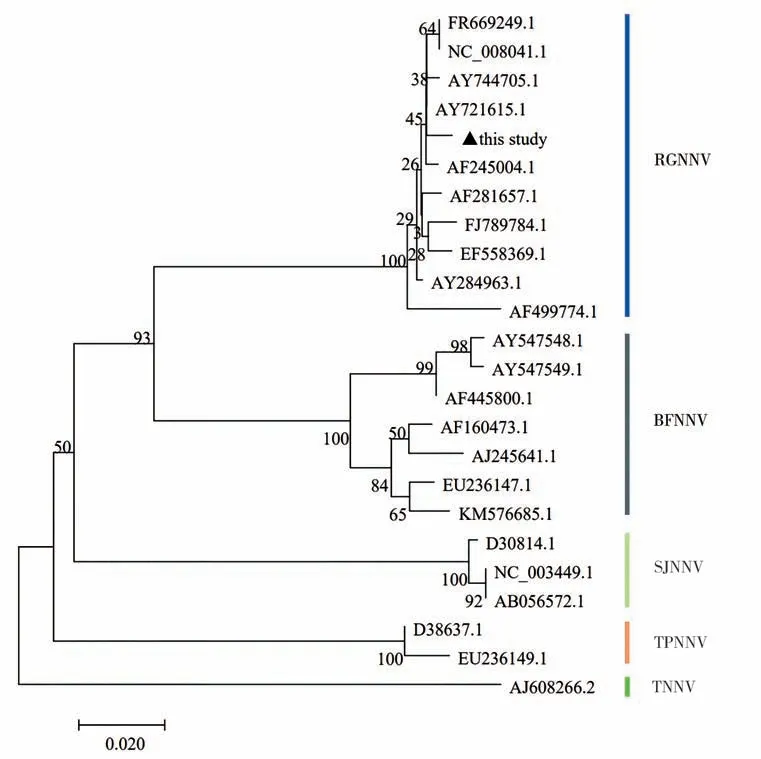
图2 基于鱼类NNV的氨基酸序列构建的系统进化树
2.3 神经坏死病毒质粒模板标准品的制备将从RNA2 链克隆出的PGNNV 序列克隆至pEASY®-T1载体,成功构建重组质粒pEASY®-T1-PGNNV. 经NanoDrop 2000测定,所提取重组质粒浓度为162.30 ng·µL-1,DNA 长度(重组质粒大小)为4 846 bp. 经公式计算后其拷贝数为3.05×1010copies·µL-1,以其作为后续实验的对照标准品质粒. 计算公式如下:
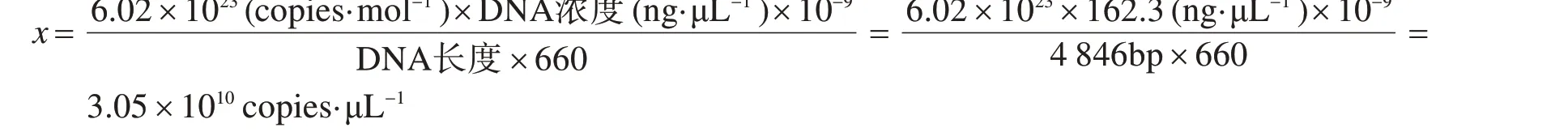
2.4 不同引物对在普通PCR中灵敏度的比较将上述标准品质粒用ddH2O稀释至108copies·µL-1,然后以10 倍梯度继续稀释至10 copies·µL-1. 采用本实验中设计的9 对特异性引物,分别检测101~107copies·µL-1不同稀释度的标准品质粒,结果如图3所示. 从图3中我们可以看出,有7对引物可以检测到103copies·µL-1,引物对3、引物对6、引物对7 均可以检测到浓度为10 copies·µL-1,其中引物对7 在普通PCR 中灵敏度高,在浓度为10 copies·µL-1处检测条带依然单一明亮.
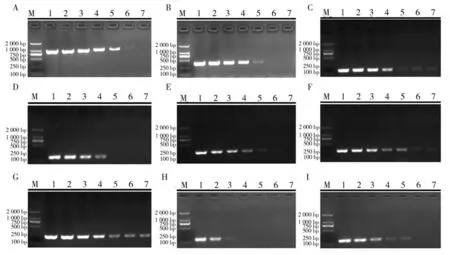
图3 不同浓度重组病毒质粒在不同引物下的普通PCR扩增结果
2.5 不同引物对在荧光定量PCR中标准曲线的建立及筛选 对标准品的各个稀释度样品用不同的引物进行检测,分别建立扩增动力学曲线. 不同引物的熔解曲线、扩增曲线、标准曲线如图4所示. 根据图4中的熔解曲线可知,7对引物最大峰均在85 ℃左右,峰值整齐且较为单一,说明7对引物特异性较好;根据扩增曲线可知,7对引物均出现明显扩增,说明本实验所选的引物在荧光定量PCR中均可以检测到样本浓度为10 copies·µL-1的病毒;在PGNNV 拷贝数为101~107copies·µL-1范围内,不同引物对的标准曲线图中,各相关系数R2数值均在0.99以上,说明扩增反应存在良好的线性关系.

图4 不同引物的熔解曲线、扩增曲线、标准曲线
2.6 筛选引物应用效果验证利用筛选出的最佳引物对病鱼脑组织进行检测,结果如图5所示. 从图中可以看出,在普通PCR 中,病鱼组织中检测到一条单一明亮的条带,且大小与预期相符,健康鱼组织中并未检测到条带. 在荧光定量PCR 中,4份病鱼组织样本均出现阳性扩增曲线(单峰),且Ct值在25以下,证明4份组织均感染了VNNV;相反,健康鱼组织样本无Ct值. 因此,本研究筛选出的引物可准确检测出VNNV的感染,具有较强的应用价值.
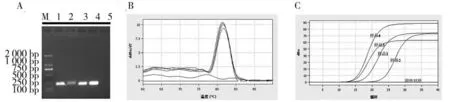
图5 筛选引物的应用结果
3 讨 论
鱼类神经坏死病毒属于RNA 病毒,可划分为4 类基因型,不同基因型在感染宿主的种类方面有所差别. 其中RGNNV 主要感染温水性鱼类,病鱼游泳异常、身体失衡、厌食,脾脏肿大、肾脏坏死、脑组织颜色变红等[37-39]. 许海东等采用肌肉注射、腹腔注射、口服感染、病毒液浸泡等4 种方式进行病毒感染,结果表明,卵形鲳鲹神经坏死病毒湛江株PNNV 对卵形鲳鲹有高致病率,死亡率高达100%[26]. 我国海南等地区已经成为RGNNV的主要流行地区[40],筛选出高灵敏性的引物对神经坏死病毒的检测至关重要.
本研究是海南省首次从卵形鲳鲹中分离到神经坏死病毒(PGNNV),并成功测序得到PGNNV 的基因组序列RNA1和RNA2. 根据PGNNV 的RNA2序列共设计了9对特异性引物,并且通过普通PCR 的琼脂糖凝胶电泳结果以及荧光定量PCR 的扩增曲线、熔解曲线以及标准曲线等对检测引物的灵敏度及特异性进行了比较筛选. 在普通PCR 中,引物对7 在浓度低至10 copies·µL-1的样品中依旧可以检测出神经坏死病毒,且条带单一明亮. 在荧光定量PCR 中,引物对3~9 均能在浓度低至10 copies·µL-1的样品中检测出神经坏死病毒,灵敏度高. 实验证明不同的检测引物间存在一定的差异,荧光定量PCR 检测灵敏性优于普通PCR. 综合两种不同检测方法的结果,其中引物对7检测效果最佳,在不同的方法中均可以准确检测神经坏死病毒浓度低至10 copies·µL-1的样品. 利用筛选出的引物对7,分别采用普通PCR 及荧光定量PCR在病鱼组织中进行检测,发现均可准确检测出感染VNNV 的病鱼样本. 葛辉等[41]建立的神经坏死病毒检测方法灵敏度达67 copies·µL-1,彭智发[35]建立的实时荧光定量RT-PCR 法可以检测病毒拷贝数为10 copies·µL-1的样品,检测用时75 min,本研究在样品病毒拷贝数为10 copies·µL-1时检测结果显示阳性,检测用时30 min,检测所需时间与彭智发等人的研究相比缩短了40 min以上. 综上所述,本实验筛选出的引物灵敏度高、所需时间短,为鱼类神经坏死病毒的检测与研究提供参考依据,对卵形鲳鲹神经坏死病毒病的预防与诊断具有显著性意义.
