枯草芽孢杆菌B2-GFP菌株的构建及其在土壤中的定殖
2022-10-08雷晶晶康业斌马君红石秋环
雷晶晶, 康业斌, 苗 圃, 马君红, 石秋环
(1.河南科技大学园艺与植物保护学院;2.河南省烟草公司洛阳市公司,河南 洛阳 471023)
由烟草疫霉(Phytophthoraparasitica)引起的烟草黑胫病是目前烟草生产上危害最为严重的土传真菌病害之一,该病菌在土壤中存活周期长,传播途径广,能侵染烟株根、茎、叶,在烟株整个生长期均可发生.微生物制剂因对生态环境无污染、不伤害天敌、不易产生抗药性而被广泛用于防治该病害[1-2].据报道,生物防治中对烟草疫霉具有较强拮抗作用的细菌主要隶属于芽孢杆菌属(Bacillus)、假单胞属(Pseudomonas)和农杆菌属(Agrobacterium)[3-5].其中,芽孢杆菌属抗逆性强,在离体环境下能够产生脂肽类抗生素[6],如伊枯草菌素[7]、生物表面活性素、丰原素和蛋白类抗菌物质[8],从而抑制多种病原菌生长.在实际生产中多在烟草移栽时通过穴施枯草芽孢杆菌(B.subtilis)等微生物菌剂预防烟草黑胫病的发生[9-11].微生物菌剂对病害的抑制效果和对烟株生长的促进作用,很大程度上取决于其在烟株根围土壤中及烟株体内的定殖能力[12].学者们研究了枯草芽孢杆菌标记菌株在番茄[13]、黄瓜[14]和烟草[15]等植物体内的定殖能力,证实标记菌株可以在植物体内迁移,且定殖能力是枯草芽孢杆菌发挥生防功能的重要因素.而有关枯草芽孢杆菌标记菌株在烟株根围土壤中的定殖、扩散和生存竞争能力鲜有报道.
绿色荧光蛋白(green fluorescent protein, GFP)是一种新型的标记基因,具有荧光稳定性,且没有组织化学染色的扩散效应,已被广泛用于细菌等物种标记、基因表达、分子定位、蛋白质折叠和转运等的研究[16-17].本试验将GFP基因导入对烟草疫霉具有较强拮抗作用的枯草芽孢杆菌B2菌株中构建工程菌株B2-GFP,并对该菌株在烟株根际、根围土壤中的定殖动态进行测定,为进一步研究其抑菌机理及实际应用提供依据.
1 材料与方法
1.1 材料
枯草芽孢杆菌B2菌株和烟草疫霉由河南科技大学烟草病虫害绿色防控重点实验室保存;大肠杆菌DH5α由河南科技大学动物科技实验室提供;烤烟品种LY1306种子由河南省烟草公司洛阳市公司提供;芽孢杆菌与大肠杆菌穿梭载体pGFP4412购自湖南丰晖生物有限公司.
试剂:十二烷基硫酸钠(sodium dodecyl sulfate, SDS),工作浓度60和70 μg·mL-1;柱式质粒提取试剂盒、质粒回收试剂盒、细菌基因组提取试剂盒均购自生工生物工程(上海)股份有限公司.
抗生素:氨苄青霉素(ampicillin, Amp),工作浓度50 μg·mL-1;卡那霉素(kanamycin, Km),工作浓度10 μg·mL-1.
1.2 质粒的消除及验证
质粒消除采用高温SDS法[18-19].第1步:将接种于LB培养液的野生型B2菌株在37 ℃、200 r·min-1条件下振荡培养18 h.第2步:取100 μL菌液接种于含60 μg·mL-1SDS的LB培养液中,置于45 ℃水浴18 h,取100 μL菌液接种于盛有20 mL LB 培养液的50 mL三角瓶中,在37 ℃、200 r·min-1条件下振荡培养24 h.第3步:重复第2步.使用柱式质粒提取试剂盒提取野生型菌株B2及经SDS处理菌株的质粒,所得产物经1%琼脂糖凝胶电泳检测,明确菌株质粒的消除程度.选取质粒条带消失的菌株用70 μg·mL-1SDS再消除一次后,涂布于LB固体培养基上,待出现完整菌落后保存菌样,备用.
1.3 B2-GFP工程菌株的构建
质粒的扩增:在LB固体平板上活化大肠杆菌DH5α,挑取生长良好的菌落划线培养出多个单菌落.将大肠杆菌单菌落培养至对数期,用氯化钙法制备大肠杆菌感受态.用热击法将pGFP4412导入大肠杆菌DH5α感受态菌体中,接种于含有Amp、X-gal和IPTG试剂的LB固体平板上进行扩增,培养3 d后含有质粒的菌落会与底物试剂产生颜色反应,根据细菌的蓝、白斑,挑选扩增成功的白斑菌落DH5α-GFP[20],回收其质粒.
质粒的导入:在LB固体平板上活化枯草芽孢杆菌B2菌株,挑取生长良好的B2菌落划线培养出多个单菌落.将B2单菌落用SDS消解后接种于B2培养基中培养至D600 nm=1.00.用氯化钙法制备消解后的B2菌株感受态,用热击法将pGFP4412导入B2菌株的感受态菌体中,接种于含有Km、X-gal和IPTG试剂的LB固体平板上,培养3 d后根据细菌的蓝、白斑,挑选出导入成功的白斑菌落B2-GFP.
工程菌株B2-GFP的分子检验:将通过蓝、白斑筛选的单菌落进行纯化培养,在荧光显微镜(Leica DM 2500)下观察菌落及菌体的荧光表征.将纯化后的发光单菌落用LB液体培养基于37 ℃、150 r·min-1条件下振荡培养24 h,用细菌基因组提取试剂盒提取其DNA作为模板,分别以GFP基因序列的3对引物进行PCR扩增,引物信息见表1.PCR反应体系:Taq PCR Master Mix 25 μL,DNA模板1 μL,上游引物2 μL,下游引物2 μL,ddH2O 20 μL.PCR循环体系:94 ℃预变性5 min,95 ℃变性45 s,55 ℃退火45 s,72 ℃延伸1 min,30个循环,最后72 ℃修复延伸10 min,4 ℃终止反应,保存.PCR产物经1%琼脂糖凝胶电泳(150 V,100 mA,20 min)检测.

表1 本研究所用引物
1.4 工程菌株生长曲线的测定
在荧光显微镜下挑选绿色荧光的工程菌单菌落,将其转接到含有Km(50 μg·mL-1)的LB液体培养基中,在30 ℃、150 r·min-1条件下振荡培养24 h,发酵液用无菌水稀释至浓度为2×108CFU·mL-1,备用.将1 mL菌液加入100 mL含有Km(50 μg·mL-1)的LB液体培养基中,在30 ℃、150 r·min-1条件下振荡培养.以B2菌株为对照,每隔1 h测定工程菌株和B2菌株的D600 nm值,绘制生长曲线.
1.5 工程菌株对烟草疫霉拮抗作用的测定
将烟草疫霉接种于PDA平板上,待菌落直径至5 cm以上时,用灭菌的直径5 mm的打孔器在菌落边缘处取菌饼,将菌饼转接至空的PDA平板中央,然后将工程菌株B2-GFP和野生型菌株B2分别接种于距离菌饼边缘2.5 cm等距的4个点上对峙培养.以不接细菌只接病原菌的培养皿为空白对照,每个处理重复5次.将各培养皿放入28 ℃恒温培养箱培养4~5 d,计算抑菌率.抑菌率/%=(对照病原菌半径-对峙病原菌半径)/对照病原菌半径×100.
1.6 工程菌株稳定性的测定
将工程菌株B2-GFP转接到不含Km的LB液体培养基中,每隔24 h取出10 μL,涂布在含Km(10 μg·mL-1)的LB固体培养基中培养,每隔24 h挑取单菌落转接到不含Km的LB固体培养基中划线培养,在不含Km的LB固体培养基中继代培养10代后检验单菌落及菌体的荧光表征[21].
1.7 工程菌株在烟株根际、根围土壤中定殖能力的测定
1.7.1 育苗与灌根处理 将烤烟LY1306种子催芽后播种到含有营养基质的黑色塑料穴盘(规格:72孔)中进行温室培育,待烟苗长至4~6片真叶时进行间苗,每穴留1株健壮烟苗备用.将取自河南科技大学校内试验田的黄壤土与蔬菜育苗基质(总有机质≥50%,山东莘县益农育苗基质有限公司生产)以2∶1混合,混合后土样的pH值为7.35,一部分土样经121 ℃灭菌2 h制成灭菌土,另一部分不灭菌土样为自然土.将灭菌土和自然土分别装入花盆(规格:26 cm×20 cm)中,移栽6~8叶期的烟苗,置于塑料大棚内培养,正常栽培管理.将工程菌株单菌落接种于50 mL LB液体培养基中,在37 ℃、150 r·min-1条件下振荡培养12 h后其D600 nm=2.00,含菌量6.42×105CFU·mL-1,将菌液浇灌于移栽7 d后的烟株根部,每株浇50 mL[22].
1.7.2 土壤样品的采集与处理 于灌根7、14、28、42、56和70 d后,取烟株根围土和根际土进行测定.根围土的采集:距烟株茎基5 cm处插入直径1.30 cm的取样器,推出圆柱形土柱,然后收集土柱表面向下5~10 cm的土样.根际土的采集:将烟株带根移出花盆,抖落根部附着的大土块后,用毛刷轻轻刷落并收集距根系表面2 mm的土样.将采集的土样置于室内阴凉处风干,剔除残根、石块等杂物,研磨后过10目筛(孔径为2 mm),用四分法收集土壤样品,保存备用.
1.7.3 土壤细菌活菌数测定 通过检测荧光强弱确定土壤中B2-GFP的数量可能会受到土壤中其他自发荧光微生物的影响;通过对GFP以及菌株B2序列设计多对特异性引物进行实时荧光定量PCR检测,发现试验效果不理想.因此,采用稀释平板法测定土壤细菌活菌数[23].称取1 g土加入9 mL的试管中,然后用无菌水分别稀释10、102、103、104、105、106倍,将各浓度的菌悬液吸取100 μL涂布于含Km(10 μg·mL-1)的LB平板上,重复5次,28 ℃恒温培养箱培养3 d,分别选择无污染、菌落分散相对均匀的平板,观察并标记符合枯草芽孢杆菌形态特征的菌落后,在紫外荧光灯激发波长488 nm照射下对绿色荧光菌落进行计数.计算菌落的平均数,再换算出每克干土中的细菌活菌数.细菌活菌数/(CFU·g-1)=(菌落平均数×稀释倍数×10)/干土克数[22].
2 结果与分析
2.1 质粒消除菌株的验证
试验结果表明,60和70 μg·mL-1的SDS对B2菌株质粒反复消除后致死率为98%,对B2质粒消除效果较好.经质粒电泳验证,确认最后一次消除菌株为质粒消除菌株.质粒消除菌株与野生型菌株B2相比,菌落透明,边缘不规则(图1).

A.野生型菌株B2菌落特征;B.质粒消除的B2菌株菌落特征;C.质粒凝胶电泳图(M为Marker;1为质粒消除菌株;2和3为野生型菌株B2).
2.2 工程菌株B2-GFP的构建及检测
从大肠杆菌中抽提的质粒pGFP4412片段大小为7 000 bp,左右割胶回收产物热击导入质粒消除后的枯草芽孢杆菌菌株,在含Amp及显色底物的LB平板上培养后,在荧光显微镜下观察到发出绿色荧光的菌落和菌体(图2).抽提发光菌落DNA为模板,以GFP的3对引物进行PCR扩增,扩增产物经1%的琼脂糖凝胶电泳,经核酸染料染色后,在紫外凝胶成像仪(BIO-RAD Gel Doc XR+)下检测到只有引物GFP3可以扩增出清晰的符合条件的条带;再将野生型菌株B2与工程菌株的DNA用引物GFP3进行PCR扩增,B2菌株没有扩增出相应片段,6个工程菌株均扩增出相应的片段(图3).这表明野生型菌株B2无GFP基因,且质粒pGFP4412已经成功导入野生型菌株B2中并构建出工程菌株B2-GFP.
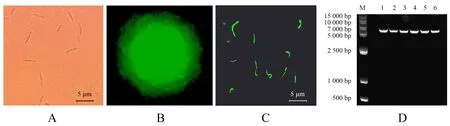
A.明场下工程菌株菌体;B.暗场下工程菌株菌落;C.暗场下工程菌株菌体;D.pGFP4412质粒电泳(M为Marker;1~6为工程菌株B2-GFP质粒).
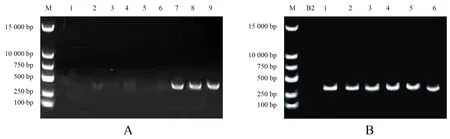
A.3对GFP引物扩增结果(M为Marker;1~3引物为GFP1;4~6引物为GFP2;7~9引物为GFP3);B.以GFP3为引物扩增B2与工程菌株电泳图(M为Marker;B2为野生型枯草芽孢杆菌菌株;1~6为工程菌株).
2.3 工程菌株B2-GFP的生长曲线
工程菌株B2-GFP比野生型菌株B2提前1 h进入指数增长期,在培养11 h后同时进入稳定生长期(图4).这说明工程菌株中GFP的高效表达可能对菌株的代谢造成了一定影响,从而使其生长曲线与野生型菌株略有不同.
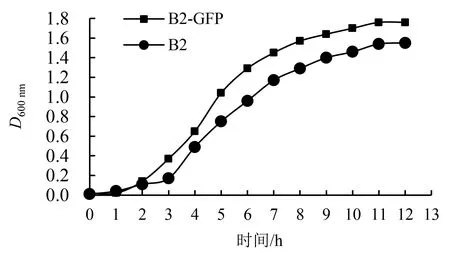
图4 菌株B2和B2-GFP的生长曲线
2.4 工程菌株B2-GFP对烟草疫霉的拮抗作用
野生型菌株B2对烟草疫霉的抑菌率为51.00%,工程菌株B2-GFP对烟草疫霉的抑菌率为48.30%(表2).因此,外源质粒的导入并未对野生型菌株B2对烟草疫霉的拮抗性产生显著影响.
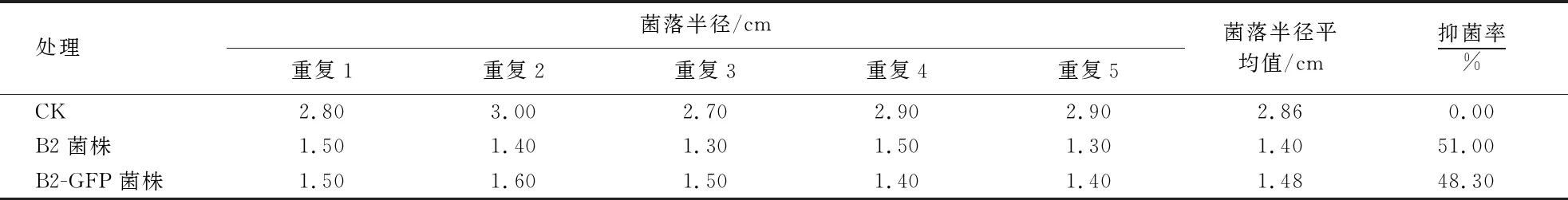
表2 菌株B2和B2-GFP对烟草疫霉的拮抗作用
2.5 工程菌株B2-GFP的稳定性
工程菌株B2-GFP继代培养10代后,在荧光显微镜下可见其菌落及菌体仍具有较强荧光.
2.6 工程菌株在土壤中的定殖能力
工程菌株B2-GFP接种于灭菌土第14天,烟株根际土壤的活菌数达1.61×107CFU·g-1,之后急速下降,第28天后数值趋于稳定;烟株根围土壤的活菌数增长平缓,第42天为3.92×106CFU·g-1,之后开始平缓下降;接种第42天时根际和根围的活菌数接近一致,接种第70天工程菌株B2-GFP仍保持荧光表型(图5).
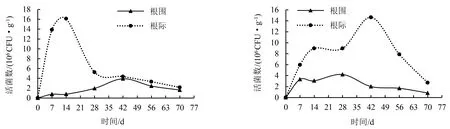
图5 灭菌土壤中工程菌株的定殖曲线
工程菌株B2-GFP接种于自然土后,烟株根际土中的活菌数先上升后下降,在第42天达到最大值(1.46×107CFU·g-1),且在整个取样周期中均高于根围土中的活菌数;根围土中活菌数增长较为平缓,无明显的峰值,整体呈下降趋势,并且接种第70天依旧可从土壤中检测出荧光菌落(图6).
3 讨论与结论
生防菌的定殖能力及其动态规律已经成为筛选、研发生防微生物的重要参考指标[24-25].刘邮洲等[26]通过抗生素平板回收结合激光扫描共聚焦显微镜观测标记菌株PTS-GFP在番茄根围的定殖数量,结果表明,标记菌株与原始菌株PTS-394的生长无明显差异,标记菌株在番茄根围土壤接种30 d后,存活数量为20 CFU·g-1.本试验通过SDS对枯草芽孢杆菌B2菌株原生质粒进行消除处理,从而成功地运用pGFP4412对B2菌株进行了GFP标记,且质粒消除与外源质粒导入对枯草芽孢杆菌的增殖和拮抗烟草疫霉的作用无显著影响;同时,通过抗生素平板回收结合荧光显微镜观测工程菌株B2-GFP在烟草土壤中的定殖能力.结果表明:工程菌株B2-GFP接种于灭菌土70 d后,根围土和根际土中的活菌数分别为1.62×106和2.16×106CFU·g-1;接种于自然土70 d后,根围土和根际土中的活菌数分别为0.83×106和2.71×106CFU·g-1.该数值大于菌株PTS-GFP在番茄根围土壤中的定殖数量[26],可能是由于不同作物根系分泌物的种类和含量不同而影响菌株在土壤中的定殖能力.董丽红等[27]研究发现,枯草芽孢杆菌NCD-2在海岛棉Pima90上的定殖能力最强,施用NCD-2第35天棉上的菌落数达到7.63×105CFU·g-1;进一步研究发现,棉花根系分泌物中的葡聚糖和脯氨酸对NCD-2生物膜形成起主要促进作用.本试验构建的工程菌株B2-GFP在烟株根际土壤中的定殖规律表现为先升后降再趋于稳定,且在整个采样期内根际土壤细菌数量大于根围土壤细菌数量,这是否与烟株根系分泌物有关有待进一步研究.
综上所述,工程菌株B2-GFP对烟草疫霉的抑菌率为48.30%;在LB液体培养基中较野生型菌株B2提前1 h进入指数增长期,培养11 h后进入稳定生长期.在灭菌土壤中接种工程菌株B2-GFP第14天,烟株根际土壤活菌数达1.61×107CFU·g-1,第70天活菌数为2.16×106CFU·g-1;在自然土壤中接种该菌第42天,根际土壤活菌数为1.46×107CFU·g-1,第70天活菌数为2.71×106CFU·g-1;工程菌株在灭菌土壤和自然土壤中存活70 d仍能保持绿色荧光表型.
