代谢工程改造枯草芽孢杆菌促进L-赖氨酸高效合成研究
2022-10-08张晓霞陈胜玲朱枝群康春涛徐建中
张晓霞,陈胜玲,朱枝群,康春涛,徐建中
1.江苏星海生物科技有限公司,江苏 盐城 224233;2.江南大学 生物工程学院/工业生物技术教育部重点实验室,江苏 无锡 214122
0 引言
L-赖氨酸是八大必需氨基酸之一,动物和人自身均无法合成。L-赖氨酸广泛应用于动物饲料中,可平衡饲料中氨基酸的组成,提高动物对氨基酸的摄取和代谢,促进家畜、家禽、鱼类等的生长发育,进而提高饲料蛋白质的利用率,节约生产成本,减少环境污染。谷类赖氨酸在加工过程中极易被破坏,致使饲料中的L-赖氨酸得率极低,故L-赖氨酸被称为第一限制性氨基酸[1]。目前,全球L-赖氨酸年产量估计为2.2×106t,并以每年10%左右的速度增长,在世界范围内是除L-谷氨酸之外的第二大氨基酸[2]。目前,工业上用于发酵生产L-赖氨酸的菌种主要有大肠杆菌(Escherichiacoli)和谷氨酸棒杆菌(Corynebacteriumglutamicum)。然而,将E.coli和C.glutamicum直接应用于动物饲料存在含内毒素、适口性差等缺陷。自2013年起,国家规定的饲料添加剂目录里已明文规定饲料级L-赖氨酸中不得含有E.coli,而市场上主要L-赖氨酸产品中L-赖氨酸的纯度一般为65%或70%[3]。因此,亟需开发具有食品安全性的微生物底盘细胞用于发酵生产饲用L-赖氨酸。
益生菌因其绿色、无残留、无污染的特性成为替代抗生素的最佳选择之一,受到国内外学者和饲料生产企业的广泛关注[4]。枯草芽孢杆菌(Bacillussubtilis)是芽孢杆菌属的一种,已被美国食品药品监督管理局(FDA)、美国饲料管制协会(AAFCO)和我国农业部认定为饲料安全性菌株,广泛应用于饲料生产中[5]。B.subtilis产生的枯草菌素、多黏菌素、制霉菌素、短杆菌肽等活性物质对致病菌或易造成内源性感染的条件致病菌具有明显抑制作用[6]。同时,B.subtilis合成的消化性酶类(蛋白酶、淀粉酶、脂肪酶、纤维素酶、果胶酶等)可降解饲料中的复杂碳水化合物,提高饲料消化率,提升动物生长性能[7]。此外,B.subtilis能刺激动物免疫器官的生长发育,激活T淋巴细胞和B淋巴细胞,提高免疫球蛋白和抗体水平,增强细胞免疫和体液免疫功能,提高群体免疫力[8]。有研究[9]表明,B.subtilis可使生猪日增重提高6%~7%,饲料转化率提高3%~4%,也能提高肉鸡的抗氧化能力,进而提高肉鸡生长性能。此外,为了有效提高饲料中营养物质的利用率,通过紫外诱变或其他代谢方法改造B.subtilis,选育具有高产消化性酶类的突变菌株已成为B.subtilis发酵饲料的发展趋势[10]。虽然B.subtilis作为益生菌广泛用于饲料生产,但该菌株不能有效积累L-赖氨酸[11],为了同时满足家畜或家禽对L-赖氨酸和B.subtilis的需求,需要在饲料中同时添加上述两种物质,这不仅造成饲料生产工艺复杂化,还在一定程度上增加了企业生产成本。因此,实现B.subtilis高效合成L-赖氨酸有利于简化饲料生产工艺,降低生产成本,提高企业的行业竞争力。
随着B.subtilis基因组注释的解析,B.subtilis发酵生产L-赖氨酸的生物合成途径和调节机制已较清晰。当以葡萄糖为原料时,B.subtilis有5个途径参与L-赖氨酸合成,分别是糖酵解途径、磷酸戊糖(PP)途径、三羧酸(TCA)循环、CO2固定反应和L-赖氨酸终端合成途径。现阶段,针对E.coli和C.glutamicum的代谢工程改造合成L-赖氨酸已有较多报道[12-14],主要集中在以下几个方面:1)解除合成途径中的反馈调节,提高L-赖氨酸合成途径的效率;2)阻断副产物的支路代谢途径,促进多代谢流进入L-赖氨酸合成途径;3)强化合成途径关键酶的表达水平,提高L-赖氨酸前体物的供应;4)拓宽菌株代谢底物谱,降低L-赖氨酸的生产成本;5)提高胞内还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)的有效供应水平,促进L-赖氨酸高效合成。然而,针对B.subtilis的代谢工程改造合成L-赖氨酸却鲜有报道。
基于此,本研究拟以饲料工业中常用的益生菌B.subtilisACCC11025为出发菌株,采用CRISPR-Cas9基因编辑技术对磷酸戊糖途径、L-赖氨酸终端合成途径和L-赖氨酸竞争支路代谢途径进行重构,以期获得具有益生功能和L-赖氨酸高效合成功能的“双功能”枯草芽孢杆菌重组菌株,为利用B.subtilis生产L-赖氨酸等饲用氨基酸提供参考。
1 材料与方法
1.1 主要试剂与设备
主要试剂:胰蛋白胨、酵母提取物,英国Oxoid公司产;质粒提取试剂盒、PCR产物纯化试剂盒、DNA聚合酶、DL1000 DNA Marker、甘露糖、氨苄青霉素(Amp)、卡那霉素(Kan) ,南京诺唯赞生物科技有限公司产;限制性内切酶、DNA连接酶,日本TAKARA公司产;葡萄糖、(NH4)2SO4、KH2PO4等常规化学试剂,均为分析纯,国药集团化学试剂有限公司产。
主要设备:DNA Engine型PCR仪、Biophotometer型核酸/蛋白电泳仪、Gel DOC GR+型凝胶成像仪、Micro Pulser型电穿孔仪,美国Bio-Rad公司产;BioPhotometer plus型核酸蛋白测定仪,德国Eppendorf公司产;Autotune超声波细胞破碎仪,美国Sonics公司产;Allegra X-15R型冷冻离心机,美国Beckman Coulter公司产;SBA40-E型生物传感分析仪,山东省科学院产。
1.2 菌株、质粒和引物序列
实验用主要菌株和质粒见表1,引物序列见表2。

表1 实验用主要菌株和质粒Table 1 The main strains and plasmids used in experiments

表2 实验用引物序列Table 2 The pimer pairs used in experiments
1.3 培养条件与培养基
于37 ℃、100 r/min条件下培养B.subtilis及其重组菌株。在特定条件下,添加质量浓度为100 μg/mL的Amp或质量浓度为50 μg/mL的Kan,用于筛选E.coli和B.subtilis重组菌株。
LB培养基:蛋白胨10 g/L,酵母提取物5 g/L,NaCl 10 g/L,pH值7.0。
SPⅠ培养基(20 mL):9.8 mL SPⅠ-A盐溶液(即Na3C6H5O7·2H2O 2 g/L,(NH4)2SO44 g/L,K2HPO4·3H2O 28 g/L,KH2PO412 g/L,0.1 MPa灭菌20 min);9.8 mL SPⅠ-B溶液(即MgSO4·7H2O 0.4 g/L,0.1 MPa灭菌20 min);200 μL 100×CAYE溶液(即酪蛋白水解物20 g/L,酵母提取物100 g/L,0.1 MPa灭菌20 min);200 μL葡萄糖溶液(500 g/L)。
SPⅡ培养基(6 mL):5.88 mL SPⅠ培养基,60 μL CaCl2溶液(50 mmol/L),60 μL MgCl2溶液(250 mmol/L)。
发酵培养基:葡萄糖80 g/L,玉米浆35 g/L,甜菜糖蜜12 g/L,(NH4)2SO436 g/L,MgSO4·7H2O 1.5 g/L,K2HPO41 g/L,KH2PO41 g/L,FeSO40.02 g/L,MnSO40.02 g/L,甜菜碱0.05 g/L,烟酰胺0.008 g/L,硫胺素0.000 45 g/L,生物素0.000 85 g/L,CaCO340 g/L。
所有培养基均用质量浓度为0.2 g/mL的NaOH溶液调节pH值至 7.0~7.2,并于121 ℃灭菌20 min,发酵培养基于115 ℃灭菌10 min。
1.4 质粒和菌株的构建方法
1.4.1 质粒pHT01-Cas9的构建以酿脓链球菌的基因组作为模板,使用引物Spcas9-F和Spcas9-R将基因Spcas9进行PCR扩增,随后利用限制性内切酶XbaⅠ和XamⅠ对质粒pHT01和片段Spcas9进行双酶切并酶连,获得目标重组质粒pHT01-Cas9。
1.4.2质粒pBE980b-hom59、pBE980b-lysC311、pBE980b-zwf234、pBE980b-gnd361和pBE980b-ddh的构建以质粒pBE980b为模板,利用引物hom-F、hom-R、lysC-F、lysC-R、zwf-F、zwf-R、gnd-F、gnd-R、pksD-F和pksD-R通过反向PCR扩增将20 bp的sgRNA无缝连接到质粒pBE980b,获得5个带有靶向位点的质粒。
以B.subtilisACCC11025基因组为模板,利用引物hom-L-F、hom-L-R、hom-R-F、hom-R-R、lysC-L-F、lysC-L-R、lysC-R-F、lysC-R-R、zwf-L-F、zwf-L-R、zwf-R-F、zwf-R-R、gnd-L-F、gnd-L-R、gnd-R-F、gnd-R-R、pksD-L-F、pksD-L-R、pksD-R-F和pksD-R-R分别对基因hom、lysC、zwf、gnd和pksD的上下同源臂进行扩增,同时以C.glutamicum为基因组,利用引物Cghom-F、Cghom-R、CglysC-F、CglysC-R、Cgzwf-F、Cgzwf-R、Cggnd-F、Cggnd-R、Cgddh-F和Cgddh-R分别扩增基因hom、lysC、zwf、gnd和ddh。将回收后的同源臂片段和基因片段同时作为模板,通过融合PCR进行基因融合,利用限制性核酸内切酶对融合片段及带有靶向位点的质粒pBE980b进行酶切和酶连,获得重组质粒pBE980b-hom59、pBE980b-lysC311、pBE980b-zwf234、pBE980b-gnd361和pBE980b-ddh。
1.4.3B.subtilis重组菌株的构建将重组质粒pHT01-Cas9电转化至B.subtilisACCC11025感受态细胞中,通过氨苄抗性筛选得到带有Cas9蛋白的转化子。将重组质粒pBE980b-hom59、pBE980b-lysC311、pBE980b-zwf234、pBE980b-gnd361和pBE980b-ddh分别电转化至带有Cas9蛋白的B.subtilisACCC11025感受态细胞中。目标重组菌株的具体筛选和鉴定参照A.J.Sachla等[15]的方法进行。
1.5 分析方法
1.5.1 酶活性测定采用超声波细胞破碎法处理细胞,离心后取上清液,获得粗酶液[16],将该粗酶液保存于-20 ℃备用或立即用于酶活性的测定。参照J.Z.Xu等[17]的方法测定葡萄糖-6-磷酸脱氢酶(G6PD)、6-磷酸葡萄糖酸脱氢酶(6GPD)和二氨基庚二酸脱氢酶(DapDH)的酶活性;参照许金坤等[18]的方法,采用吸光光度法测定高丝氨酸脱氢酶(HSD)的酶活性。
1.5.2 菌体生长情况测定参照J.Z.Xu等[17]的方法,每间隔2 h或4 h取200 μL发酵液,用0.25 mol/L的稀HCl溶液将其稀释到5 mL,用紫外分光光度计于562 nm处测定吸光度(即OD562)。
1.5.3 葡萄糖含量和L-赖氨酸产量测定参照J.Z.Xu等[17]的方法,将发酵液于4 ℃、12 000 r/min条件下离心5 min,取上清液稀释100倍后,通过生物传感分析仪测定发酵液中葡萄糖含量和L-赖氨酸产量。
1.6 数据处理
采用3次独立重复实验考查实验因素,数据表示为(平均值±标准差),统计学分析采用T检验。
2 结果与分析
2.1 目标重组菌株的筛选与鉴定结果分析
目标重组质粒和目标重组菌株的验证如图1所示,图1a)中,泳道1 为pBE980b-gnd361双酶切验证,泳道2 为pBE980b-lysC311双酶切验证,泳道3为pBE980b-zwf234双酶切验证,泳道4为pBE980b-hom59双酶切验证,泳道5为pBE980b-ddh双酶切验证,泳道M为DL10000 DNA Marker;图1b)中,泳道1为B.subtilisACCC11025对照,泳道2为菌株XH3中基因gndPCR验证,泳道3为菌株XH4中基因gndPCR验证,泳道4为菌株XH2中基因zwfPCR验证,泳道5为菌株XH6中基因ddhPCR验证,泳道6为菌株XH1中基因lysCPCR验证,泳道7为菌株XH5中基因homPCR验证,泳道M为DL10000 DNA Marker。由图1a)可知,所选择的质粒都带有目标片段,为目标重组质粒pBE980b-gnd361、pBE980b-lysC311、pBE980b-zwf234、pBE980b-hom59和 pBE980b-ddh。由图1b)可知,通过对候选目标菌株进行目标片段PCR验证,确定了目标重组菌株XH1、XH2、XH3、XH4、XH5和XH6。
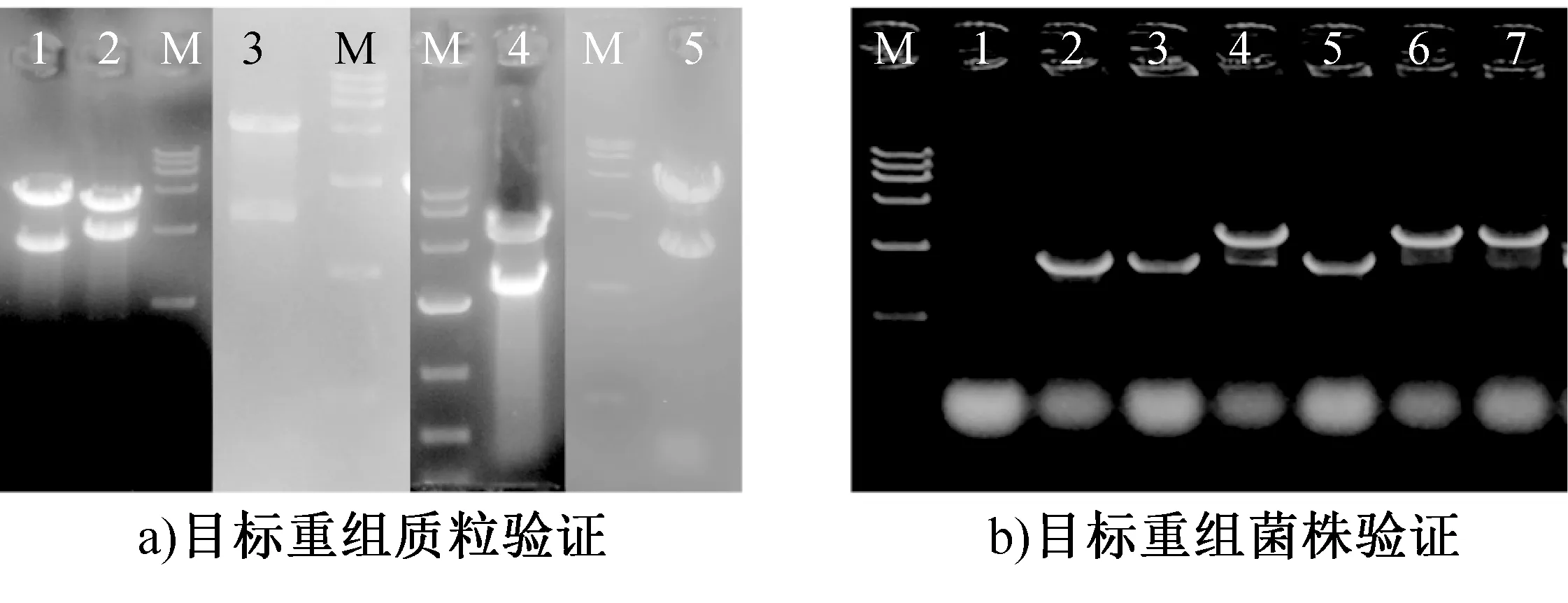
图1 目标重组质粒和目标重组菌株的验证Fig.1 Confirmation of target plasmids and recombinant strains
2.2 天冬氨酸激酶对L-赖氨酸终端合成途径碳通量的影响分析
天冬氨酸激酶(Aspartokinase,AK)是催化L-天冬氨酸形成天冬氨酸磷酸的酶,是天冬氨酸族氨基酸生物合成途径中的关键酶,也是L-赖氨酸生物合成过程中的第一个限速酶[3]。然而,在B.subtilis中,AK只有一个同功酶天冬氨酸激酶(AKⅢ),由基因thrD编码,其酶活力受L-赖氨酸和L-缬氨酸的协同反馈抑制和阻遏作用[19]。有研究[17]表明,将来源于C.glutamicum的AKⅢ氨基酸序列中的第311位氨基酸由苏氨酸定点突变成异亮氨酸,可以解除L-赖氨酸的反馈抑制作用。为此,本研究首次将B.subtilis中的AKⅢ替换成来源于C.glutamicum的已解除反馈调节作用的AKⅢ(编码基因lysC311),以调节L-赖氨酸终端合成途径的碳通量。lysC基因替换及替换后重组菌株的生长情况如图2所示。由图2a)可知,目标重组菌株B.subtilisXH1已成功将自身AKⅢ编码基因thrD替换成C.glutamicum中的lysC311。重组菌株B.subtilisXH1(XH0thrD::lysC311)可在添加有L-赖氨酸结构类似物S-(2-氨基乙基)-L-半胱氨酸(AEC)的LB固体培养基中正常生长,而出发菌株B.subtilisXH0则不能生长(图2b))。这表明,将B.subtilis中的thrD基因替换成lysC311基因成功解除了L-赖氨酸对AKⅢ的反馈调节作用。

图2 lysC基因替换及替换后重组菌株生长情况Fig.2 Sequencing of lysC and the growth of different strains
课题组前期研究[17]发现,解除C.glutamicum中AKⅢ的反馈调节作用有利于强化L-赖氨酸终端合成途径碳通量,从而促进L-赖氨酸合成。为了考查来源于C.glutamicum中解除反馈调节作用的AKⅢ是否能在B.subtilis中表达,本研究对出发菌株和重组菌株进行摇瓶发酵并测定胞外L-赖氨酸产量。不同菌株L-赖氨酸产量和菌体生长情况如图3所示。由图3a)可知,重组菌株B.subtilisXH1在发酵16 h后开始逐渐向胞外分泌L-赖氨酸,发酵结束后(发酵40 h)胞外L-赖氨酸产量为(11.7±0.6)g/L。相反,出发菌株B.subtilisXH0在整个发酵周期内都没有明显积累L-赖氨酸的现象。由图3b)可知,与出发菌株B.subtilisXH0相比,重组菌株B.subtilisXH1的菌体生长并未受到明显抑制,最终菌体量(OD562=38.4±3.5)为出发菌株(OD562=37.5±4.1)的97.6%。这表明,将B.subtilis中的AKⅢ替换成来源于C.glutamicum的解除反馈调节的AKⅢ可以实现改造B.subtilis以促进L-赖氨酸合成的目的。相似的结果也被魏佳等[20]报道,他们发现,将来源于C.glutamicum的解除反馈调节作用的AKⅢ替换E.coli中的AKⅢ,有利于L-苏氨酸的合成。

图3 不同菌株L-赖氨酸产量和菌体生长情况Fig.3 L-lysine production and cell growth of different strains
2.3 G6PD和6GPD对PP途径碳通量的影响分析
以葡萄糖为碳源时B.subtilis中L-赖氨酸的生物合成途径如图4所示,其中,每合成1分子的L-赖氨酸需要消耗4分子的辅酶因子NADPH;不同颜色的线条表示不同的合成途径,红色线条表示引入外源合成途径;椭圆圈里是编码基因,红色圈表示替代基因;⟹表示基因替换;基因zwf编码G6PD,基因gnd编码6GPD,基因lysC编码AKⅢ,基因hom编码HSD,基因ddh编码DapDH。对胞内NADPH水平的调控已成为当前菌种改造和发酵过程优化的热点之一。诸多文献[1,3,14]指出,胞内NADPH供给主要来源于PP途径中的G6PD和6GPD。有文献[21]报道,失活的PDHC有利于支链氨基酸中L-缬氨酸的合成,其原因是可以提高胞内丙酮酸的供应。然而,G6PD和6GPD的酶活性受到NADPH、ATP、果糖-1,6-二磷酸、甘油醛-3-磷酸、核酮糖-5-磷酸、赤藓糖-4-磷酸等的反馈调节,从而影响PP途径碳通量和NADPH供给[22]。为了强化PP途径碳通量,提高L-赖氨酸合成所必需的NADPH供给量,本研究选择来源于C.glutamicum的解除反馈调节作用的G6PD(编码基因zwf234)和6GPD(编码基因gnd361)替换菌株B.subtilisXH1中的野生型G6PD(编码基因zwf)和6GPD(编码基因gnd),分别获得重组菌株B.subtilisXH2(XH1zwf::zwf234)、B.subtilisXH3(XH1gnd::gnd361)和B.subtilisXH4(XH1zwf::zwf234gnd::gnd361)。不同重组菌株中G6PD和6GPD的酶学性质见表3。由表3可知,与出发菌株相比,重组菌株XH2和XH4中的G6PD及重组菌株XH3和XH4中的6GPD对葡萄糖-6-磷酸(G6P)和NADP+的亲和力都提高了。这表明,通过替换来源于C.glutamicum的解除反馈调节作用的G6PD和6GPD,可以解除菌株B.subtilisXH1中的野生型G6PD和6GPD的反馈调节作用,进而影响胞内G6PD和6GPD的酶活力。

图4 以葡萄糖为碳源时B.subtilis中L-赖氨酸的生物合成途径Fig.4 The biosynthetic pathway of L-lysine from glucose in B.subtilis
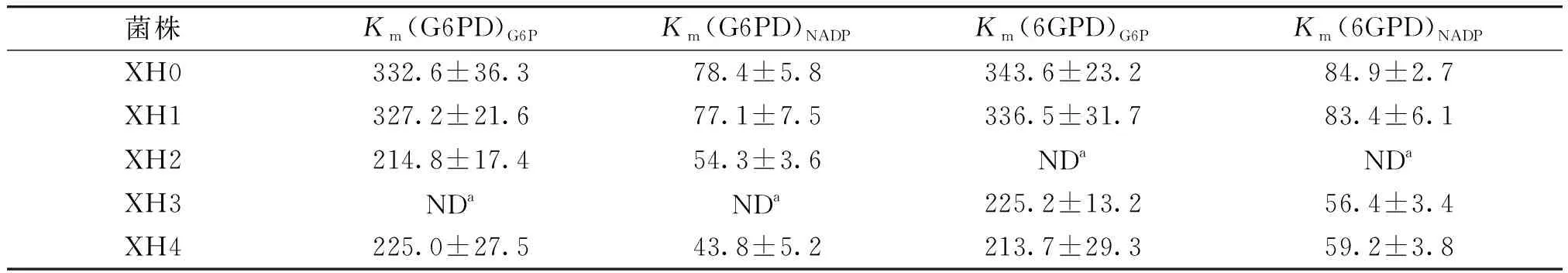
表3 不同重组菌株中G6PD和6GPD的酶学性质Table 3 Kinetic characterization of G6PD and 6GPD in different strains μmol/L
G6PD和6GPD是细胞内NADPH再生的关键酶[1,3,14],而胞内NADPH水平又显著影响L-赖氨酸的合成(图4)[1,3]。不同菌株胞内NADPH水平、L-赖氨酸产量和菌体生长情况如图5所示。由图5可知,由于不同重组菌株胞内的G6PD和6GPD酶活性不同,菌体胞内的NADPH水平也不同。胞内G6PD和6GPD酶活力越高,胞内NADPH水平也越高。由图5a)可知,重组菌株B.subtilisXH4胞内NADPH水平最高,从出发菌株B.subtilisXH1的(3.51×10-4)nmol/(104细胞)增加到(5.38×10-4)nmol/(104细胞),胞内NADPH/NADP+提高了43.2%。由图5b)可知,重组菌株B.subtilisXH2、B.subtilisXH3和B.subtilisXH4胞外L-赖氨酸产量都显著提升。重组菌株B.subtilisXH4摇瓶发酵40 h后积累了(20.3±1.9) g/L L-赖氨酸,比出发菌株B.subtilisXH1提高了73.5%。这些结果表明,引入外源的解除反馈调节的G6PD和6GPD可以强化PP途径碳通量,从而有效提高胞内NADPH供给水平,促进L-赖氨酸的合成。诸多研究[1,3,14,22]也指出,强化E.coli或C.glutamicum中PP途径碳通量,可以提高胞内NADPH水平,从而提高NADPH依赖型产物的合成效率。由图5c)可知,与出发菌株B.subtilisXH1相比,重组菌株表现出较差的菌体生长性能,尤其是重组菌株B.subtilisXH4。有研究[22]报道,引入外源的zwf234和gnd361不仅会显著改变目标产物合成量,还会显著影响葡萄糖利用速率和菌体生长。因此,造成重组菌株菌体生长差的原因可能是由于更多的碳源用于L-赖氨酸合成而不是菌体生长。
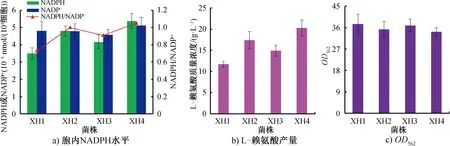
图5 不同菌株胞内NADPH水平、L-赖氨酸产量和菌体生长情况Fig.5 Intracellular NADPH level, L-lysine production and cell growth of different strains
2.4 HSD对胞内副产物积累的影响分析
天冬氨酸族氨基酸以草酰乙酸为前体物进行生物合成,包括5种氨基酸,即L-天冬氨酸、L-赖氨酸、L-蛋氨酸、L-苏氨酸和L-异亮氨酸。由图4可知,L-赖氨酸生物合成途径中的重要中间物质天冬氨酸半醛在HSD的催化作用下进入L-赖氨酸生物合成的竞争途径,从而影响L-赖氨酸生物合成。虽然通过失活HSD可以阻断竞争途径,但会使重组菌株成为营养缺陷型菌株,需要在发酵过程中额外添加高丝氨酸等物质,增加生产成本[18]。为此,本研究通过在重组菌株B.subtilisXH4中调节HSD酶活力,尝试将B.subtilis中的HSD(编码基因hom)替换为来自C.glutamicum的渗漏型HSD(编码基因hom59)以有效降低竞争途径碳通量,获得目标重组菌株B.subtilisXH5(XH4hom::hom59)。不同菌株生长情况、L-赖氨酸产量和副产物积累量见表4。由表4可知,重组菌株B.subtilisXH5菌体生长性能表现出与菌株B.subtilisXH4相似的水平。需要指出的是,尽管重组菌株B.subtilisXH5的菌体量低于出发菌株B.subtilisXH0和B.subtilisXH1,但其L-赖氨酸产量远高于二者。重组菌株B.subtilisXH5中L-赖氨酸产量达到(23.2±1.7) g/L,比菌株B.subtilisXH1和B.subtilisXH4分别增加了98.3%和14.3%。此外,随着重组菌株HSD酶活力的降低,仍可促进L-赖氨酸的合成,同时减少其他4种天冬氨酸族氨基酸的积累量。重组菌株B.subtilisXH5发酵液中未检测到L-蛋氨酸、L-苏氨酸和L-异亮氨酸,而菌株B.subtilisXH1和B.subtilisXH4在胞外都积累了一定量的副产物。这一结果表明,替换来源于C.glutamicum的渗漏型HSD,可以调节B.subtilis的胞内HSD酶活力水平,从而有利于促进L-赖氨酸合成、减少副产物积累。

表4 不同菌株生长情况、L-赖氨酸产量和副产物积累量Table 4 The cell growth, the concentration of L-lysine and by-products in different strains
2.5 外源DapDH对L-赖氨酸合成效率的影响分析
在已知的具有L-赖氨酸生物合成途径的微生物和植物中,可以将L-赖氨酸生物合成划分为两个完全不同的途径,即氨基乙二酸途径(AAA)和二氨基庚二酸途径(DAP)[1]。DAP是天冬氨酸族氨基酸合成途径中的一部分,存在4种不同的变化形式用于合成内消旋二氨基庚二酸,即脱氢酶途径、琥珀酰化酶途径、乙酰化酶途径和转氨酶途径[23]。B.subtilis中只存在乙酰化酶途径,即以L-Δ1-四氢吡啶二羧酸为底物经5步酶促反应合成L-赖氨酸(图4)。然而,一些革兰氏阳性菌(如C.glutamicum)存在更为简单的脱氢酶途径,该途径以L-Δ1-四氢吡啶二羧酸为底物经2步酶促反应即可合成L-赖氨酸[23]。为了提高B.subtilis合成L-赖氨酸的效率,本研究在菌株B.subtilisXH5中引入C.glutamicum中的DapDH(编码基因ddh),获得重组菌株B.subtilisXH6(XH5pksD::ddh)。菌株XH5和XH6的菌体生长和L-赖氨酸合成情况如图6所示。由图6a)可知,与出发菌株B.subtilisXH5不同,重组菌B.subtilisXH6表现出菌体生长延滞,但两者最终的菌体量基本一致。由图6b)可知,重组菌株B.subtilisXH6在发酵初期(10 h)就开始积累L-赖氨酸,这可能是导致重组菌株B.subtilisXH6生长延滞的原因。重组菌株B.subtilisXH6中L-赖氨酸产量最高达到(25.6±2.3)g/L,比菌株B.subtilisXH5增加了10.3%。这一结果表明,来源于C.glutamicum的DapDH可以调节B.subtilis中的DAP碳通量,引导部分碳流进入脱氢酶途径,从而促进L-赖氨酸的合成。

图6 菌株XH5和XH6的菌体生长和L-赖氨酸合成情况Fig.6 The cell growth and L-lysine production in XH5 and XH6 strains
3 结论
本研究首次以饲料工业中常用的益生菌B.subtilisACCC11025为出发菌株,围绕胞内前体物和辅酶因子NADPH供应、副产物积累和优化终端合成途径对L-赖氨酸合成的影响,采用CRISPR-Cas9基因编辑技术对磷酸戊糖途径、L-赖氨酸终端合成途径和L-赖氨酸竞争支路代谢途径进行重构,获得一株枯草芽孢杆菌重组菌株。结果表明,将B.subtilis中内源的参与L-赖氨酸合成的关键性酶替换成来源于C.glutamicum中的解除反馈调节作用的关键性酶(AKⅢ、G6PD和6GPD),可有效为合成L-赖氨酸提供前体物和辅酶因子NADPH,保证在B.subtilis中有效积累L-赖氨酸。此外,将B.subtilis中L-赖氨酸合成支路途径中的限速酶HSD替换成来源于C.glutamicum中的渗漏型HSD,可实现在不影响菌体生长的情况下降低副产物积累,从而保证在B.subtilis中高效清洁发酵生产L-赖氨酸。进一步实验结果表明,在B.subtilis中引入来自C.glutamicum的脱氢酶途径,可以引导碳流进入脱氢酶途径,从而促进L-赖氨酸的高效合成。经上述对B.subtilis基因组进行的一系列遗传改造,最终获得的重组菌株B.subtilisXH6中L-赖氨酸产量达到(25.6±2.3) g/L。重组菌株B.subtilisXH6经10次传代培养后仍然具有稳定的L-赖氨酸产量,这些结果表明重组菌株B.subtilisXH6具有良好的遗传稳定性。此外,重组菌株B.subtilisXH6的出发菌株为饲料工业常用的益生菌B.subtilisACCC11025,因此重组菌株B.subtilisXH6保留了出发菌株的益生功能。综上所述,B.subtilisXH6即为兼具益生功能和L-赖氨酸高效合成功能的“双功能”枯草芽孢杆菌重组菌株。
