miR-21-3p靶向VEGFA调节PI3K/AKT信号通路对子痫前期大鼠肾损伤的影响
2022-10-08张爱萍赵得雄霍春霞
张爱萍, 赵得雄, 霍春霞, 谢 玲
(青海红十字医院, 青海 西宁 810000)
子痫前期(Preeclampsia,PE)是妊娠中晚期特有的并发症之一,是一种严重的妊娠期特异性多器官功能障碍疾病,病因复杂且治疗困难,严重威胁孕产妇与胎婴的生命安全,是临床上导致围产期孕妇及婴儿死亡的重要原因[1]。PE的发病机制复杂,多以高血压、蛋白尿、多器官功能障碍等为病理表现,肾是其损伤的主要靶器官之一[2]。磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,AKT)信号通路参与机体多种重要的细胞生长过程以及多种疾病的发生发展。研究表明PI3K/AKT信号通路能够调节肿瘤细胞的增殖与分化,目前临床上将PI3K/AKT信号通路作为肿瘤治疗的分子靶点[3]。在PE早期病因研究中发现,PE发生时出现胎盘浅着床、组织缺氧以及子宫螺旋动脉重铸异常,导致胎儿血氧供给不足等病理现象[4],其发生机制复杂,与肿瘤中许多细胞组织的病理变化极为相似,因此,PI3K/AKT信号通路也参与PE的发生与发展,可能作为其治疗的分子靶点[5]。血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)的表达参与细胞分裂增殖,促进血管生成,其过表达可以激活PI3K/AKT信号通路,参与调控多种肿瘤疾病的发生发展[6]。越来越多的研究证实多种microRNA(miRNA)都能够参与PE组织损伤的发生发展[7,8]。有研究表明[9],miR-21-3p是急性肾损伤发病的重要调控因子,参与脓毒症相关急性肾损伤(SAKI)的发生发展,可以作为急性肾损伤的诊断及预后评估标志物,但miR-21-3p在PE肾损伤中的机制尚未明确。本研究通过体外实验验证miR-21-3p与VEGFA的靶向关系,并建立PE大鼠模型探究miR-21-3p通过靶向VEGFA调节PI3K/AKT信号通路对PE大鼠肾损伤的影响,为PE肾损伤的诊疗与预后提供参考。
1 材料与方法
1.1实验动物:SPF级雄性SD大鼠30只与雌性SD大鼠60只,6周龄,雄性体质量180-200g,雌性体质量160-180g。均购自中国科学院理化技术研究所,生产许可SYXK(京)2018-0042。雌雄大鼠2∶1合笼过夜,次日凌晨雌性大鼠发现有阴道栓即为受孕成功。将受孕大鼠饲养于温度(22±2)℃、湿度(45±5)%,昼夜时长1∶1的环境下适应一周,期间自由饮水和采食。
1.2实验药品:亚硝基左旋精氨酸甲酯(L-nitro arginine methyl ester,L-NAME)试剂(美仑生物科技有限公司);戊巴比妥钠(Sigma公司);携带miR-21-3p基因的腺病毒载体、携带抑制miR-21-3p基因表达的腺病毒载体及其对照miRNA-NC空质粒腺病毒载体(武汉博欧特生物科技有限公司);尿蛋白、血清肌酐(serum creatinine,Scr)、血尿素氮(blood urea nitrogen,BUN)ELISA试剂盒(江西江蓝纯生物试剂有限公司);Trizol试剂盒、逆转录试剂盒、实时荧光定量PCR试剂盒、蛋白提取试剂盒、苏木精-伊红染色试剂盒(北京碧云天生物技术研究所);兔抗人VEGFA、PI3K、p-PI3K、AKT、p-AKT、GAPDH抗体,辣根过氧化物酶标记的羊抗兔抗体(北京索莱宝科技有限公司);双荧光素酶活性检测试剂盒(上海联迈生物工程有限公司)。
1.3实验仪器:光学显微镜(日本尼康公司);ABI StepOnePlus实时荧光定量PCR仪(北京希凯恩生物科技有限公司);凝胶成像仪(杭州米欧仪器有限公司)等。
1.4方 法
1.4.1腺病毒载体构建、建模与分组:从miRNA数据库中查找大鼠miR-21-3p基因序列,然后根据该序列设计并合成一段含有与miR-21-3p完全互补的8个重复片段,再设计一段与miR-21-3p序列完全不同的miRNA序列。将PCR扩增的带有酶切位点的上述3段序列克隆至PUC19载体,然后将其与pAdTrack-CMV载体同时双酶切,接着用T4 DNA连接酶4℃连接,并转化至大肠杆菌感受态细胞中,即可得到3种重组质粒。重组质粒经抗性筛选和酶切鉴定后进行线性化,然后转染至293A细胞,即可得到携带miR-21-3p基因腺病毒载体、携带抑制miR-21-3p基因表达腺病毒载体和miRNA-NC空质粒腺病毒载体。接着对转染后的293A细胞进行多轮扩增,来提高病毒滴度。60只SD孕鼠随机分为正常组、模型组、mimics NC组、miR-21-3p mimics组、miR-21-3p inhibitor组,每组12只。除正常组外,其余四组建立大鼠PE模型:妊娠第10d,按300mg/kg的剂量腹腔注射L-NAME溶液,每天1次,共给药5d,并通过测血压、24h尿蛋白,以血压≥18kPa、尿蛋白定量≥4.0mg确认PE大鼠造模成功[12]。造模成功后,mimics NC组尾静脉注射miRNA-NC空质粒腺病毒载体;miR-21-3p mimics组尾静脉注射携带miR-21-3p基因腺病毒载体;miR-21-3p inhibitor组尾静脉注射携带抑制miR-21-3p基因表达腺病毒载体,各1mL,每日1次,连续7 d。
1.4.2各组大鼠肾指数的计算与肾功能指标检测:实验结束后,收集各组大鼠尿液,称取大鼠体质量,将大鼠麻醉后动脉取血,制备血清,保存在-80℃冰箱中备用。待血液样本采集结束,处死各组大鼠,快速分离肾脏,去除周围组织,称重计算肾指数:肾指数(mg/g)=肾质量(mg)/体质量(g)。之后将部分肾组织用0.9%的生理盐水进行漂洗、用滤纸吸干表面水分,放入4%多聚甲醛中固定;部分肾组织保存在-80℃冰箱中。取制备好的血清,按照试剂盒说明书操作测定各组大鼠血清中SCr、BUN含量;取尿液,检测尿蛋白含量。
1.4.3各组大鼠肾组织病理变化检测:将放入4%多聚甲醛中的肾组织固定48h后进行脱水、石蜡包埋、切片。之后将切片依次放入二甲苯20min、梯度乙醇各5min。苏木精-伊红染色后中性树脂封固,光学显微镜下观察大鼠肾组织形态及病理变化。
1.4.4各组大鼠血清中IL-6、TNF-α的检测:取1.4.2中制备好的血清,运用试剂盒测定各组大鼠血清中IL-6、TNF-α含量。
1.4.5双荧光素酶报告基因实验验证miR-21-3p与VEGFA的靶向关系:采用生物信息学软件Target Scan7.1数据库分析miR-21-3p的靶基因,检测到VEGFA的3’端含有miR-21-3p的潜在结合位点,提示VEGFA可能是miR-21-3p的直接靶基因。将VEGFA野生型和突变型质粒分别与miR-21-3p mimics(miR-21-3p mimics组)、miR-NC(miR-NC组)转染至肾小管上皮细胞中,37℃培养箱培养48h后,收集并裂解细胞,严格根据双荧光素酶报告基因试剂盒说明书进行检测,采用萤火虫荧光素酶活性与海肾荧光素酶活性的比值表示目的基因荧光素酶相对活性。
1.4.6各组大鼠肾组织中miR-21-3p、VEGFA mRNA相对表达水平的检测:取2.2中保存在-80℃冰箱中的肾组织,机械匀浆后取上清液,运用Trizol法提取各组大鼠肾组织总RNA,根据目的RNA种类不同使用不同试剂盒进行逆转录,采用RT-PCR法检测各组miR-21-3p和VEGFA基因的表达水平。以GAPDH为内参基因,按照2-△△Ct法计算miR-21-3p、VEGFA mRNA的相对表达水平。引物序列见表1。

表1 引物序列
1.4.7各组大鼠肾组织中VEGFA、PI3K、p-PI3K、AKT、p-AKT蛋白表达水平的检测:取1.4.2中保存在-80℃冰箱中的肾组织,加入RIPA裂解液提取总蛋白,加入BCA测定蛋白浓度,电泳转膜后将目的条带用5%脱脂牛奶封闭1h,清洗后加入VEGFA(1∶1000)、PI3K(1∶500)、p-PI3K(1∶1000)、AKT(1∶500)、p-AKT(1∶1000)一抗孵育过夜,再次清洗后加入辣根过氧化物酶标记的二抗(1∶5000)孵育1h,清洗后按照ECL化学发光检测试剂盒说明书进行显色操作,以GAPDH为内参蛋白,应用凝胶成像系统扫描图像,进行灰度值分析,GAPDH为内参蛋白,以所得目的条带灰度值与GAPDH条带灰度值目的蛋白相对表达量,计算各组VEGFA、p-PI3K/PI3K、p-AKT/AKT蛋白的相对表达水平。

2 结 果
2.1各组大鼠肾组织病理结构变化:如图1所示,正常组大鼠肾组织结构正常,上皮细胞排列规则,未发现病变,无水肿变性现象。模型组与mimics NC组大鼠肾组织结构被破坏,肾小管上皮细胞水肿变性,肾小球体积增大,肾小囊间隙明显缩小,炎细胞大量浸润。与阴性对照组相比,miR-21-3p mimics组大鼠肾组织损伤明显减轻,炎细胞浸润减少,肾小管上皮细胞排列整齐,肿胀减轻;miR-21-3p inhibitor组肾组织损伤明显加重,视野明显可见大量炎细胞浸润,肾小管上皮细胞结构紊乱,肾小球体积明显变大,损伤严重。
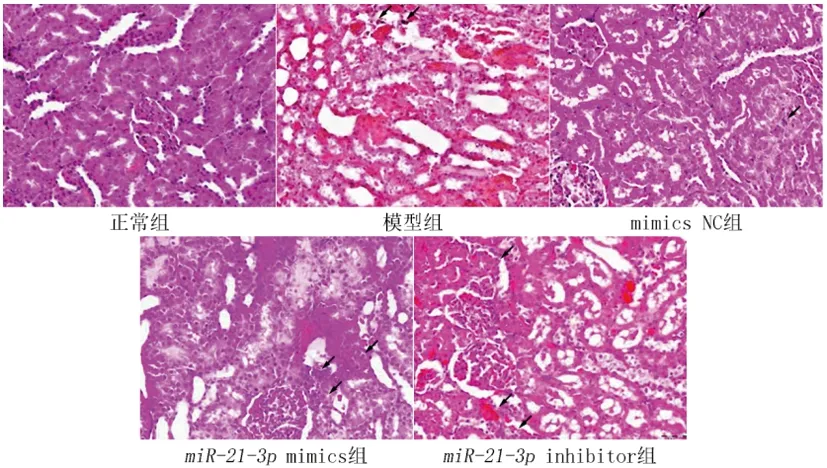
图1 各组大鼠肾组织病理结构变化(HE,×100)
2.2各组大鼠肾指数与肾功能指标的检测结果:与正常组比较,模型组大鼠肾指数以及SCr、BUN、尿蛋白含量均显著升高(P<0.05)。mimics NC组肾指数、SCr、BUN、尿蛋白含量与模型组比较(P>0.05)。与mimics NC组比较,miR-21-3p mimics组肾指数、SCr、BUN、尿蛋白含量均明显降低(P<0.05);miR-21-3p inhibitor组上述指标均明显升高(P<0.05)。见表2。

表2 各组大鼠肾指数与SCr BUN 尿蛋白含量的比较
2.3各组大鼠血清中炎性因子IL-6、TNF-α的检测结果:与正常组比较,模型组大鼠血清中IL-6、TNF-α水平均明显升高(P<0.05)。模型组与mimics NC组血清中IL-6、TNF-α水平变化无显著差异(P>0.05)。与mimics NC组比较,miR-21-3p mimics组大鼠血清中血清中IL-6、TNF-α水平均显著降低(P<0.05);miR-21-3p inhibitor组大鼠血清中上述炎性因子水平均明显升高(P<0.05)。见表3。

表3 各组大鼠血清中IL-6 TNF-α水平的比较
2.4miR-21-3p与VEGFA的靶向关系验证结果:生物信息学分析网站www.targetscan.org分析结果显示,miR-21-3p与VEGFA基因3’端存在互补的结合位点,见图2。双荧光素酶报告基因实验分析结果显示,转染VEGFA野生型质粒的miR-21-3p mimics组细胞荧光素酶活性较miR-NC组显著降低(P<0.05),结果见表4。

表4 双荧光素酶活性检测结果

图2 miR-21-3p和VEGFA的结合位点
2.5各组大鼠肾组织中miR-21-3p、VEGFA mRNA相对表达水平的检测结果:与正常组相比,模型组大鼠肾组织中miR-21-3p相对表达量明显降低,VEGFA mRNA相对表达量明显升高(P<0.05)。mimics NC组大鼠肾组织中各mRNA相对表达量与模型组相比无显著差异(P>0.05)。与mimics NC组比较,miR-21-3p mimics组肾组织中miR-21-3p相对表达量明显升高,VEGFA mRNA相对表达量明显降低(P<0.05);miR-21-3p inhibitor组肾组织miR-21-3p相对表达水平明显降低,VEGFA mRNA表达水平显著升高(P<0.05)。见表5。

表5 各组大鼠肾组织中miR-21-3p VEGFA mRNA相对表达水平的比较
2.6各组大鼠肾组织中VEGFA、PI3K、p-PI3K、AKT、p-AKT蛋白表达水平的检测结果:与正常组比较,模型组肾组织中VEGFA、p-PI3K/PI3K、p-AKT/AKT蛋白表达水平均显著升高(P<0.05)。与模型组比较,mimics NC组上述指标变化无显著差异(P>0.05)。与mimics NC组比较,miR-21-3p mimics组肾组织VEGFA、p-PI3K/PI3K、p-AKT/AKT蛋白表达水平均明显降低(P<0.05);miR-21-3p inhibitor组肾组织VEGFA、p-PI3K/PI3K、p-AKT/AKT蛋白表达明显升高(P<0.05)。见图3、表6。

表6 各组大鼠肾组织中VEGFA p-PI3K/PI3K p-AKT/AKT蛋白表达水平的比较

图3 各组大鼠肾组织VEGFA、PI3K、p-PI3K、AKT、p-AKT蛋白表达水平
3 讨 论
PE发病率极高,发生机制复杂,主要病理表现为血压、尿蛋白升高以及肾功能受损等[10]。PE肾损伤发生较早,研究发现,PE发生肾损伤的主要病理变化为肾小球扩张、尿蛋白含量升高,大量性细胞浸润,以及血清肌酐以及尿素氮含量增加[11],因此,本研究采用HE染色法观察肾组织病理变化结果显示,模型大鼠肾组织发生严重组织病变,肾小管上皮细胞水肿变性,炎细胞浸润,另外采用ELISA法检测血清中SCr、BUN以及尿液中尿蛋白含量,发现上述指标显著增加,提示模型大鼠肾功能受损。
PI3K是在细胞内参与增殖、分化、凋亡以及葡萄糖转运等多种细胞功能调节的一种重要的信号转导分子。研究表明,AKT是PI3K下游分子,PI3K/AKT信号通路与如糖尿病等多种人类疾病的发生密切相关[12],是经典炎症反应调控通路。有研究表明PE患者体内胎盘血流灌注不足,加上炎性因子以及活性氧的堆积,诱导TXA2生成,同时激活PI3K/AKT信号通路,参与介导机体的炎症反应以及细胞凋亡[13]。本实验设计PE大鼠模型,利用Western Blot法检测到PE大鼠肾组织中该通路相关蛋白的表达均明显升高,炎性因子IL-6、TNF-α的含量也相对升高,说明PI3K/AKT信号通路激活诱导PE大鼠释放炎性因子,进而导致肾损伤的发生。
VEGFA是由血管内皮细胞分泌的一种二聚糖蛋白,参与机体血管生成,促进血管内皮细胞增生与凋亡[14]。miR-21-3p是SAKI的治疗与预后中,有效改善肾组织管状上皮细胞的代谢改变,调控能量代谢,改善SAKI不良预后[9]。研究证明,VEGFA通过激活PI3K/AKT信号通路,诱导多种疾病的发生发展[15]。本实验通过建立PE大鼠模型,探究其对PE肾损伤的保护作用以及对PI3K/AKT信号通路的调控机制。通过双荧光素酶报告基因分析结果证实,VEGFA是miR-21-3p的靶基因,进一步研究显示,miR-21-3p表达增加后,VEGFA的mRNA以及蛋白水平的相对表达受到抑制,另外还抑制了PI3K/AKT通路相关蛋白表达和PE大鼠的炎症反应,肾损伤也明显减轻。以上结果提示miR-21-3p通过下调VEGFA表达抑制PI3K活化,导致下游AKT失活,进而改善PE大鼠肾损伤。
综上所述,miR-21-3p通过靶向VEGFA抑制PI3K/AKT信号通路,改善PE肾损伤,可能为临床治疗PE提供一些参考。但由于PE的发生机制复杂,miR-21-3p的靶点通路较多,还需要设计实验进一步研究。
