长链非编码RNA调控植物生长发育与逆境胁迫响应研究进展
2022-10-07李春梅万小荣关子盈赖晓凤罗凯晴
李春梅,万小荣,关子盈,赖晓凤,罗凯晴,刘 凯
(仲恺农业工程学院 农业与生物学院,广州市特色作物种质资源研究与利用重点实验室,广东 广州 510225)
随着高通量测序技术的发展,大量的非编码RNA在不同物种中被鉴定,主要包括短链小RNA(short-sequence small RNA)和长链非编码RNA(long non-coding RNA,lncRNA)。其中,短链非编码RNA(small non-coding RNA, microRNA)和小干扰RNA(small interfering RNA, siRNA)的功能研究较多且作用机制已非常清楚,而lncRNAs的功能直到近年才为人所知。lncRNAs是一类转录本长度大于200 nt的非编码RNA,具有细胞或组织特异性。随着核糖体测序、质谱等技术的发展,也有研究表明,某些lncRNAs能够编码少于100个氨基酸的小肽或蛋白。与mRNA相比,lncRNAs的表达量及其序列保守性均较低。大多数lncRNAs由RNA Pol Ⅱ转录,少数由PolⅠ、PolⅢ、Pol Ⅳ 和Pol Ⅴ 转录。根据lncRNA在基因组上的来源,通常可将lncRNAs分为4类:来源于基因间区的基因间lncRNA(intergenic lncRNA,lincRNA)、来源于蛋白编码基因内含子区域的内含子lncRNA(intronic lncRNA,incRNA)、来源于蛋白编码基因反义链的天然反义lncRNA(natural antisense lncRNA,NAT)、来源于包含蛋白编码基因外显子区域的正义lncRNA(sense lncRNA)。
真核基因组包含成千上万个lncRNAs,在各种生物学过程中发挥重要作用。目前,lncRNAs的功能与作用机制研究主要集中在人、小鼠等哺乳动物中,如lncRNAs在胚胎干细胞维持、器官发育和癌症进展中发挥重要作用。随着哺乳动物lncRNAs的功能逐渐被揭示,植物中lncRNAs的功能也开始受到广泛关注。植物中虽然已经鉴定出大量lncRNAs,但仅小部分lncRNAs的功能和作用机制被阐释,绝大多数lncRNAs的功能和机制还有待进一步探索。目前,拟南芥()、水稻()、番茄()等模式植物有较多lncRNAs功能得到验证(表1)。本文从植物生发育、生殖、应对外界胁迫与抗病免疫等方面总结了已进行功能验证的植物lncRNAs,根据lncRNAs在基因组上的来源,分类讨论了不同来源lncRNAs的作用机制,为深入挖掘植物lncRNAs,探究其功能与作用机制提供参考。
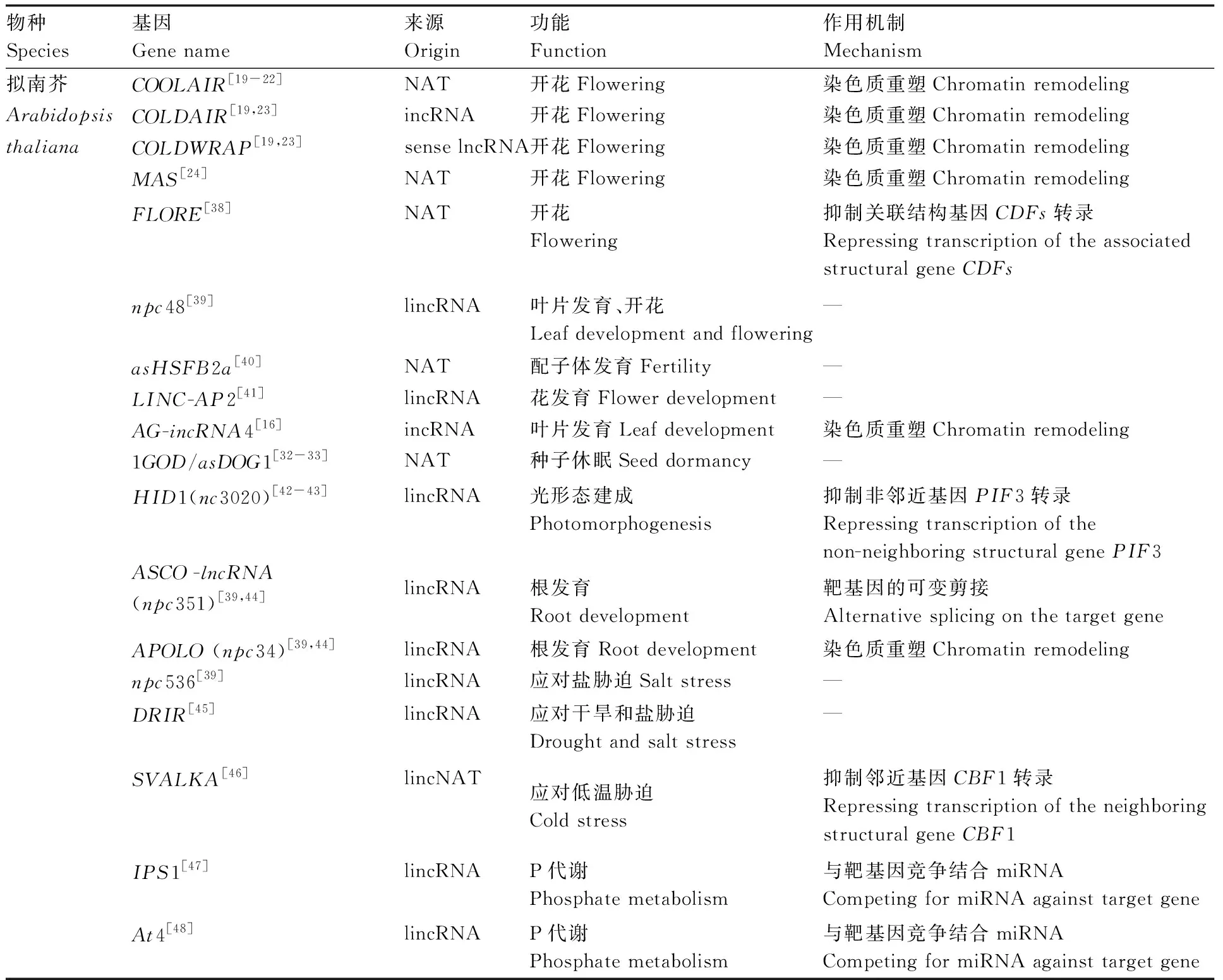
表1 LncRNAs在植物中的功能与作用机制
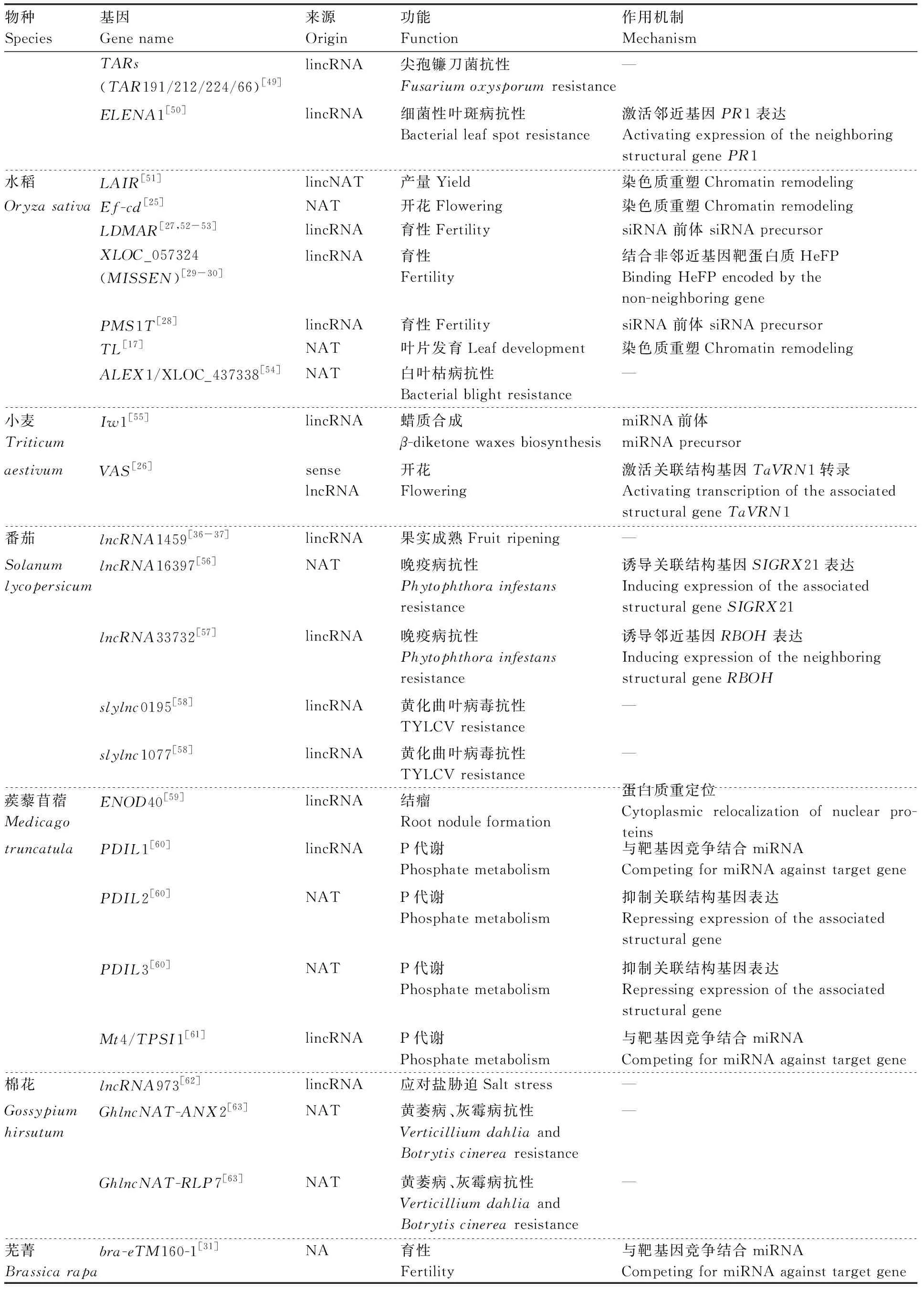
续表1 Continued Table 1
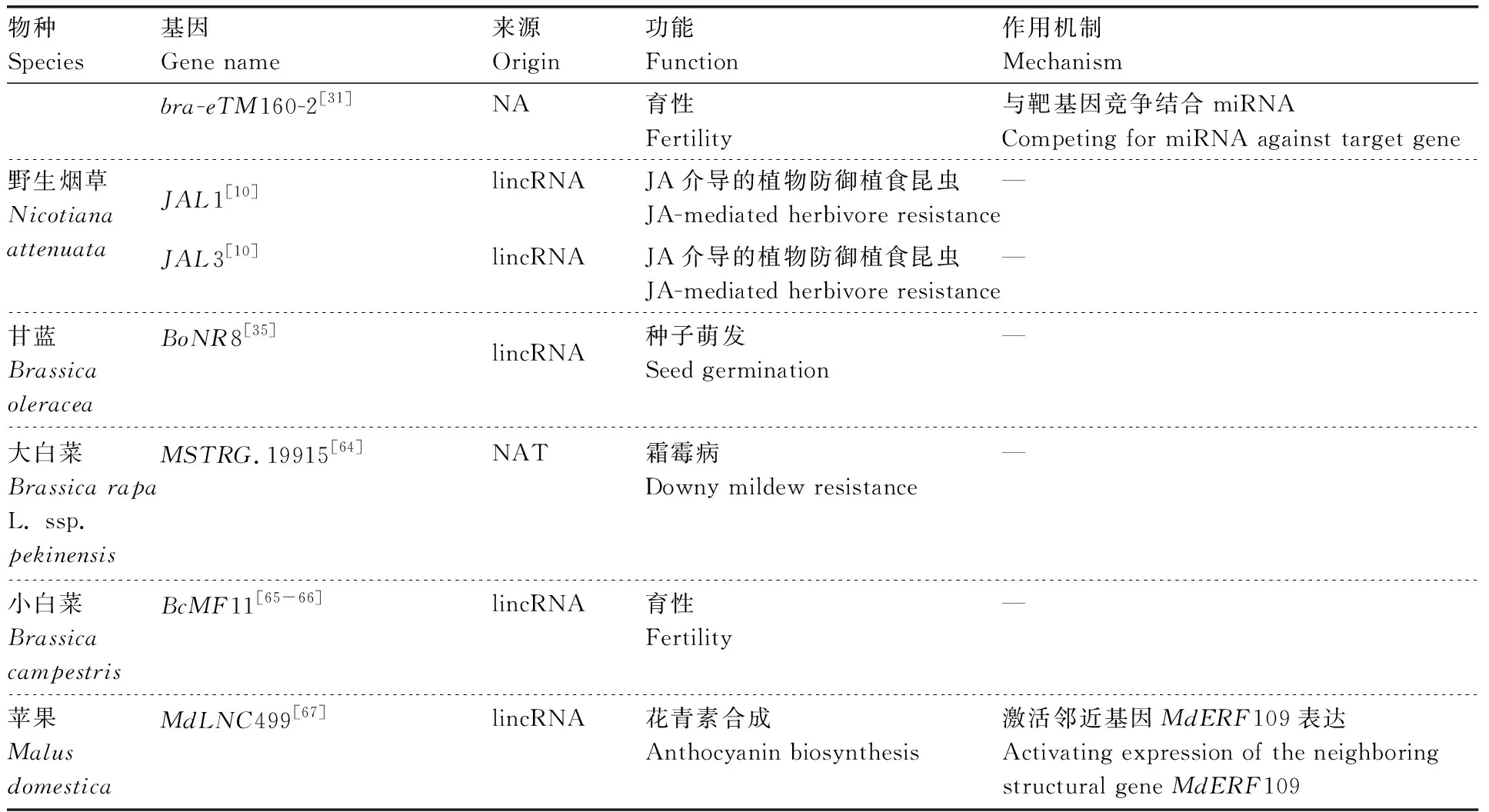
续表1 Continued Table 1
1 LncRNAs与植物生长发育、生殖
1.1 调控植物生长发育
植物生长发育受外在环境因素和内在基因共同调控,目前研究主要关注的是编码蛋白基因对植物生长发育的调控。近年来,随着测序技术的发展,lncRNAs对植物生长发育调控的研究不断增加,揭示了其在调控植物生命活动过程中发挥的重要作用。-4来源于拟南芥中调控花器官形成的()基因,-4干扰植株的叶片卷曲,花瓣和萼片发育受到抑制,表明该lncRNA参与调控叶片发育。水稻lncRNA()来源于转录因子60,干扰植株表型与Os60过表达植株表型相似,表现为叶片发育不平展。
1.2 调控植物开花
植物开花时间是植物适应环境光照变化的结果。(flowering locus C)是抑制开花的一个关键调节因子,(COLD ASSISTED INTRONIC NONCODING RNA)、(cold induced long antisense intragenic RNA)、(cold of winter-induced noncoding RNA from the promoter)均为来自的lncRNAs,上述lncRNAs的干扰植株开花均延迟。4(MADS AFFECTING FLOWERING4)是另一个开花抑制基因,是来自于4的lncRNA,干扰或敲低植株开花均延迟;此外,作物中也有lncRNAs调控开花的报道。水稻-(early flowering-completely dominant)是通过图位克隆得到的一个控制开花的lncRNA,该lncRNA从促进开花的Os1基因的反义链转录而来;小麦()lncRNA(1 alternative splicing)来源于促进开花的春化基因1(vernalization gene)中的一个转录本,其过表达植株开花早于野生型。
1.3 调控植物育性
育性是作物稳产的关键因素,育性研究对育种中不育系的培育有重要意义。LncRNAs除了调控开花以外,还参与调控植物育性。水稻光敏不育系农垦58S中2个lincRNAs,(long-day-specific male-fertility-associated RNA)和1(photoperiod-sensitive male sterility 1),均发生了单碱基突变,造成农垦58S在长日照条件下不可育。过表达后,不育系农垦58S的育性恢复正常。水稻另一个育性调控lncRNA_057324()在幼穗和雌蕊中表达较高,其T-DNA插入突变体育性降低。最新研究表明,通过结合解旋酶家族蛋白质HeFP,抑制微管蛋白的功能,从而抑制胚乳发育,授粉后,的表达降低。此外,十字花科作物芜菁()中也发现了调控育性的lncRNA-160-1/2,其过表达植株花粉育性降低。
1.4 调控植物种子活力和果实成熟
种子萌发是指种子打破休眠进入新的生长周期,对保证植物的顺利繁衍有重要意义。1(DELAY OF GERMINATION 1)是一个特异抑制种子萌发的编码蛋白基因,其反义转录本lncRNA1可通过抑制1的表达从而打破种子休眠;甘蓝()lncRNA8与拟南芥响应低氧胁迫的lncRNA8同源,拟南芥中过表达8后,高脱落酸浓度下种子萌发较野生型快。果实成熟过程涉及颜色、风味物质等的变化,番茄1459的表达随着果实的成熟而上调,沉默或敲除该基因后,果实成熟延迟,进一步研究证实1459能通过调控类胡萝卜素的合成进而调控果实成熟。
2 LncRNAs与植物应对外界胁迫
2.1 调控植物应对非生物胁迫
非生物胁迫,例如磷胁迫、盐胁迫、干旱胁迫等对于植物的生长发育影响较大,植物通常需要付出生长和产量的代价来应对非生物胁迫。植物中已鉴定出许多响应非生物胁迫的lncRNAs,但只有小部分的功能被验证,绝大多数功能仍不清楚。植物lncRNAs最早被报道参与调控植物磷的代谢。拟南芥4、1 (INDUCED BY PHOSPHATE STAR-VATION1)、蒺藜苜蓿()41、1(phosphate deficiency-induced LncRNA 1)基因具有23个保守核苷酸,但没有保守的ORF,属于不编码蛋白质的lncRNAs,上述lncRNAs均能够与调控磷稳态的2(Phosphate2)基因竞争结合miR399,缓解miR399对靶基因2的抑制作用,进而调节磷稳态。蒺藜苜蓿2和3是受低磷诱导的lncRNAs,其与磷转运蛋白基因部分序列互补进而抑制其表达。LncRNA536能够响应低磷和盐胁迫,高浓度盐胁迫条件下,536过表达植株的根系较野生型更发达。(drought induced lncRNA)是受盐和干旱胁迫诱导的lncRNA,过表达植株的耐旱和盐胁迫能力显著增强。1(C-repeat/dehydration-responsive element binding factors)是响应低温胁迫的基因,lncRNA位于1的邻近区域,能抑制1的转录进而调控植物耐寒性。棉花(spp.)973能够响应盐胁迫,其过表达植株对盐胁迫耐受性增强,而沉默植株对盐胁迫耐受性减弱。虽然536、和973均被证实正向调控植物应对盐胁迫的耐受性,但作用机制尚不清楚。
2.2 调控植物应对生物胁迫
固着生长的植物除应对非生物胁迫以外,还要面对病原菌、害虫、线虫等生物胁迫的威胁。植物应对生物胁迫的研究主要是通过正向或反向遗传学挖掘和鉴定与植物防御相关的QTL、基因等,通过组学技术挖掘差异基因、蛋白、代谢物等,进一步通过T-DNA插入、RNA干扰等技术探究差异基因等的功能。尽管lncRNA的研究还处于起步阶段,但是已报道的lncRNA与这些已知的防御机理密切相关。
Zhu等采用链特异性RNA测序的方法,将拟南芥中lncTARs(transcriptionally active regions)鉴定为响应尖孢镰刀菌浸染的一类lncRNAs,T-DNA插入或RNA干扰敲除lncTARs植株对尖孢镰刀菌的抗性降低,病征更明显;0195和1077亦是通过链特异性配对末端RNA测序在番茄感染黄花曲叶病毒前后鉴定的差异表达lncRNAs,其沉默植株中,黄化曲叶病毒积累量显著增加;Cui等通过对易感晚疫病和抗晚疫病番茄品种的比较转录组分析,筛选到688个差异表达lncRNAs,进一步发现,16397能够作为22(Solyc04g011880.1.1)的反义转录本进而调控其表达,16397过表达番茄植株的晚疫病抗性显著增强;-2和-7分别来自类受体激酶基因2和类受体蛋白基因7的反义链,能够响应棉花黄萎病和灰霉病病菌的侵染,这2个lncRNAs基因沉默后,棉花对黄萎病和灰霉病的抗性均显著增强;LncRNA1(an leaf expressed and Xoo-induced lncRNA 1)能够响应水稻白叶枯病病原菌黄单胞菌的浸染,1过表达植株茉莉酸途径被激活,白叶枯病抗性增强;1(Elf18-induced long-noncoding RNA1)是基于平铺阵列分析筛选获得的受病原相关分子模式(pathogen-associated molecular patterns)18诱导的lncRNA,其过表达植株中防御相关基因表达上调,细菌性叶斑病的抗性增强。在上述已验证参与调控植物抗病的lncRNAs中,仅1的作用机制被阐明。
目前,在植物lncRNAs参与应对害虫取食方面,仅有Li等鉴定了野生烟草()早期和晚期响应烟草天蛾()取食的lncRNAs,其中,1(jasmonate associated lincRNA 1)和3(jasmonate associated lincRNA 3)的功能得到了验证。1和3在烟草天蛾攻击早期响应,沉默1或3的烟草植株茉莉酸积累降低,抵御烟草天蛾攻击的能力减弱,但1和3介导茉莉酸途径调控烟草抗虫性的作用机理尚不明确。
3 植物lncRNAs的作用机制
LncRNAs的作用机制大致可分染色质重塑、R-loop、可变剪切、转录调控、siRNA、miRNA前体与竞争结合miRNA6类(图1),对于植物来说,lncRNAs因其来源不同,作用机制存在差异。
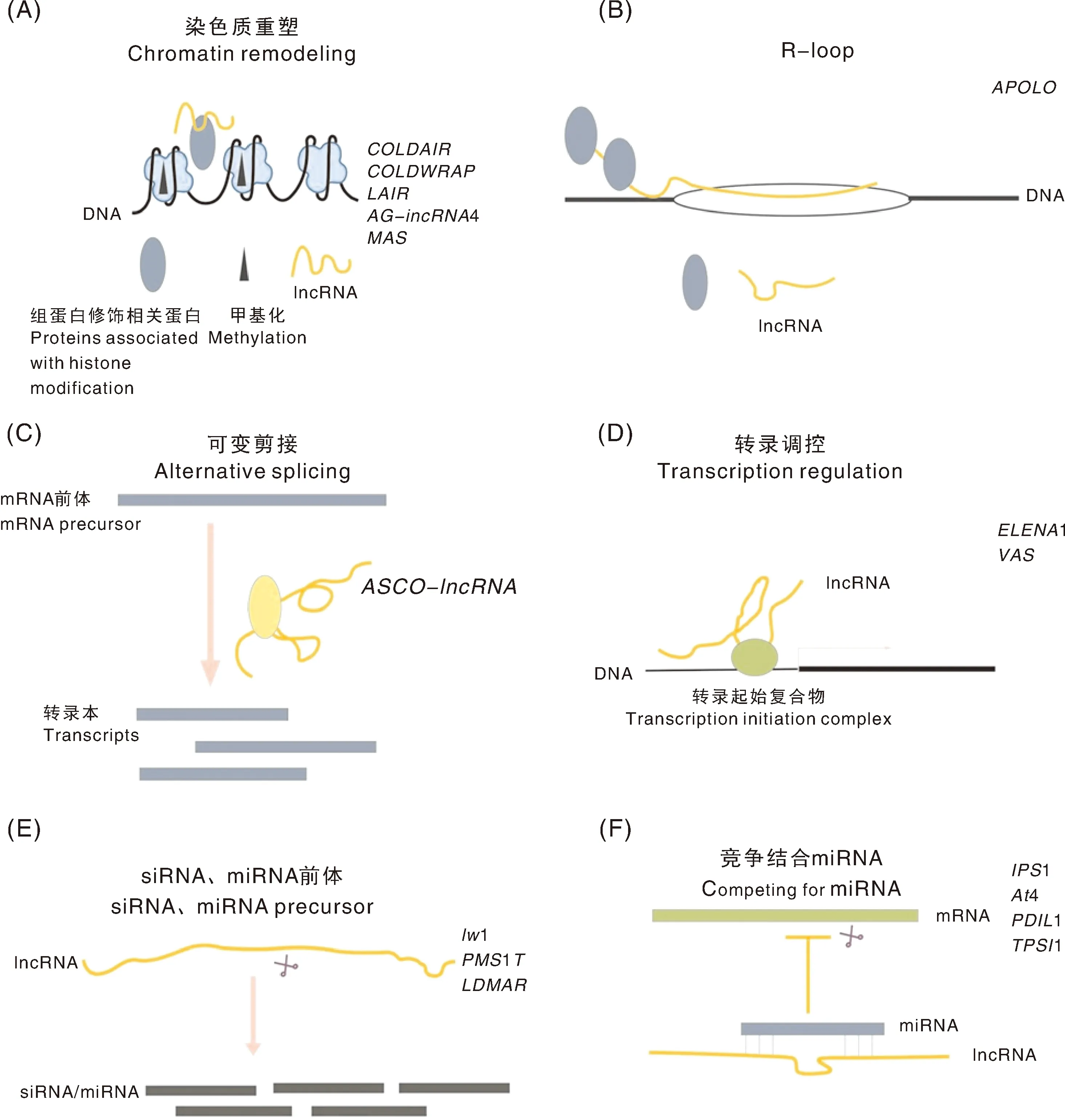
图1 植物中lncRNAs的作用机制Fig.1 Molecular mechanism of lncRNAs in plant
3.1 LincRNAs的作用机制
LincRNAs是最丰富的一类lncRNAs,其作用机制多样,根据靶基因的不同,大致可分为3类:靶基因为邻近基因、靶基因为非邻近基因、靶基因不明确。
3.1.1 靶基因为邻近基因
LincRNAs可通过参与邻近基因的染色质重塑进而调控基因表达。(AUXIN REGULATED PROMOTER LOOP RNA,34)位于调控生长素极性运输的蛋白激酶基因(PINOID)的上游,表达的变化能够调控启动子区域组蛋白修饰和DNA甲基化水平,通过动态调控染色质环的形成动态调节的表达;水稻(LRK antisense intergenic RNA)与亮氨酸重复受体激酶基因簇(leucine-rich repeat receptor kinase)邻近,是该区域的反义转录物,既可结合1基因的5’和3’-UTR,还能结合该区域的组蛋白修饰蛋白OsMOF和OsWDR5,使邻近基因簇的343和416水平增加,进而激活基因的表达。
LincRNAs也可通过其他方式调控邻近基因的表达。是耐寒相关基因1和3的反义转录物,植物遭到低温胁迫后,开始转录,负责转录的RNAPⅡ与反向负责转录的RNAPⅡ碰撞,导致1转录减缓。番茄33732可诱导邻近下游基因呼吸爆发氧化酶基因(respiratory burst oxidase)的表达,从而增强对晚疫病的抗性。
3.1.2 靶基因为非邻近基因
LincRNAs通过富集到非邻近基因的启动子区域调控基因表达。1(HIDDEN TREASURE 1,3020)是植物中较保守的lncRNA,其可结合在非临近基因3的启动子区域。1为位于基因间区的lincRNA,其可与转录装置重要组成部分中介因子MED19a结合,致使MED19a在先天免疫基因1(PATHOGENESIS-RELATED GENE1)的启动子区域富集,促进1基因的表达,增强植株抗性。
LincRNAs能够通过与靶基因竞争结合miRNA进而调控靶基因的表达。1是植物中保守的lncRNA,磷缺乏诱导产生的miR399和2(Phosphate Over accumulator 2)序列互补结合,1与2竞争结合miR399,过表达1使2转录本在植株中富集进而导致茎尖磷含量降低。
LincRNAs参与非邻近基因的可变剪接调控基因表达。RNA结合蛋白NSRs(nuclear speckle rna-binding proteins)调控可变剪切,NSRs可既结合mRNA,也结合40或351等lncRNAs,这些与NSR结合的lncRNAs统称为ASCO-RNA(alternative splicing competitor RNA)。ASCO-RNA与mRNA竞争结合NSRs,改变了NSR对下游响应生长素靶基因的可变剪接,从而影响拟南芥侧根的生长。
LincRNAs能够编码miRNA的前体。1(INHIBITOR of WAX1)是通过图位克隆得到的小麦lincRNA,其能够转录形成长发夹结构的miRNA前体,将1转入小麦后,蜡质合成基因1-(WAX1-CARBOXYLESTERASE)的表达显著下调。
3.1.3 靶基因不明确
LincRNAs可编码siRNA的前体。LincRNA的启动子区域可产生siRNA-。-可介导启动子区域甲基化,进而介导水稻光敏雄性不育;水稻1是另一个调控光敏雄性不育的lincRNA,可被2118切割产生21 nt的phasiRNA进而发挥功能。
3.2 NATs、incRNAs、sense lncRNAs的作用机制
NATs、incRNAs和sense lncRNAs均来自结构基因,从已报道的作用机制来看,NATs、incRNAs和sense lncRNAs主要是参与来源结构基因的染色质重塑。和分别来自基因的内含子和启动子,来自的反义转录本,上述3个lncRNAs能够增强基因不同区域的组蛋白修饰,重塑染色质,进而抑制基因的表达。-4是来源于基因的incRNA,是来源于4的反义转录本,-4与均能够通过结合组蛋白修饰相关蛋白参与其关联结构基因和4的染色质重塑。水稻是23 MYB转录因子的反义转录本,尽管未显示其能直接结合蛋白质,但其能够增强关联结构基因Os60的组蛋白甲基化。sense lncRNAs可通过结合转录因子调控关联结构基因表达。如小麦开花基因1其中一个转录本是一个lncRNA,可结合转录因子2,使其在1启动子区域富集,从而促进1的表达。
4 展望
LncRNAs在植物各个阶段的生长发育和应对逆境胁迫中发挥重要作用。最初lncRNAs是通过RNA探针杂交的方式或图位克隆的方式得到的(、1、1、-),但随着高通量测序技术的出现和发展,转录组测序现如今已成为鉴定植物lncRNAs最高效快捷的方式。LncRNAs在植物中的研究可以从以下几个方面深入探究:
(1)在大量鉴定植物lncRNAs的基础上深入功能验证和机制探究。目前,模式植物拟南芥,主要粮食作物水稻、玉米、小麦,以及一些经济作物花生、大豆、棉花、蒺藜苜蓿等中均已鉴定出大量lncRNAs,但仅拟南芥中有相对较多的lncRNAs已进行功能验证,其他植物如番茄、芜菁、野生烟草、卷心菜和白菜中仅有少数lncRNAs的功能被验证。大多数lncRNAs的功能未知,今后的研究应主要集中在lncRNAs的功能验证。功能研究的基本思路如下:1) lncRNA的筛选。通过现代测序技术与生物信息学分析手段筛选获得候选lncRNA及其预测靶基因。2)lncRNA全长的获得。利用RACE技术获得lncRNA的全长。3)lncRNA的亚细胞定位。利用RNA荧光原位杂交技术对lncRNA进行亚细胞定位。4)lncRNA的表达模式分析。利用qRT-PCR或Northern杂交分析lncRNA在不同组织中的表达情况。5)lncRNA的功能验证。利用RNAi和过表达转基因技术验证候选lncRNA的生物学功能。6)lncRNA作用机制研究。利用RNA-pull down和RNA免疫共沉淀(RNA immunoprecipitation,RIP)获得lncRNA互作蛋白,染色质免疫共沉淀(chromatin immunoprecipitation,ChIP)分析靶基因组蛋白修饰状态,miRNA结合位点分析获取内源竞争性miRNA等研究lncRNA与预测靶基因间的作用机制。
LncRNAs的鉴定是通过多个生物信息学方法分析其编码能力,在获得lncRNAs后还需要通过免疫荧光染色对其编码能力进行确认;在获得lncRNAs全长时,5’RACE相对3’RACE较难,5’-UTR容易在逆转录的过程中丢掉,连接反应特异性差、效率低,通常可采用多轮巢式扩增保证特异性;RNA荧光原位杂交技术的关键在于探针,小于1 kb的序列难以用直接标记的探针检测,可采用间接标记的探针检测。总的来说,用于lncRNAs研究的技术大多还是基于编码蛋白基因的研究技术,新技术并不多,为了阐明lncRNAs的作用机制,需要更先进的成像技术和灵敏度检测技术。
(2)完善lincRNAs与靶基因的作用机理研究。尽管有部分lncRNAs的作用机理较为清楚,但这类lncRNAs主要是来源于结构基因的incRNAs和NATs,而来源于基因间区的lincRNAs作用机制相对较复杂多样。因此,对植物lncRNAs的作用机理研究可以进一步集中在lincRNAs。
(3)挖掘跨界调控植物的lncRNAs并探究作用机制。目前,植物跨界非编码RNA的研究主要集中在植物miRNA跨界到昆虫体内。最新报道显示,桃蚜lncRNAs可跨界到其寄主体内调控寄主植物的抗性。来自昆虫或微生物跨界lncRNAs对植物的调控作用还有很多“未解之谜”,是非编码RNA研究的热点领域。挖掘更多跨界调控植物的lncRNAs并阐明其调控机理,对于研究植物-害虫、植物-病原菌互作机制,挖掘生物农药的潜在靶标具有重要意义。
