肿瘤电场治疗高级别脑胶质瘤8 例临床分析
2022-10-04张晴戴慧
张晴 戴慧
杭州市肿瘤医院放疗科,浙江杭州 310002
脑胶质瘤是成人最常见的原发性中枢神经系统肿瘤,占脑恶性肿瘤的81%。胶质瘤的发病率因年龄、性别、种族和地理位置而异,每10 万人中有1.9~9.6 例发病。根据世界卫生组织(World Health Organization,WHO)分类标准,胶质瘤分为Ⅰ~Ⅳ级,其中Ⅰ级和Ⅱ级为低级别胶质瘤,Ⅲ级和Ⅳ级为高级别胶质瘤。高级别胶质瘤起源于中枢神经系统的神经胶质细胞,包括胶质母细胞瘤、间变性星形细胞瘤和间变性少突胶质细胞瘤。高级别胶质瘤易广泛浸润,容易颅内复发,即使通过手术、放疗和化疗,5 年生存率仅为6.8%,预后极差。过去十余年,高级别胶质瘤药物治疗研究进展甚微。肿瘤电场治疗(tumor treating fields,TTFields)是继手术、放疗及药物疗法之后的一种新型的非侵入性肿瘤治疗手段。2020 年,国家药品监督管理局批准TTFields上市,用于与替莫唑胺联用治疗新诊断的胶质母细胞瘤,以及作为单药疗法用于治疗复发性胶质母细胞瘤。目前,国内关于TTFields 报道较少,本研究回顾性分析于杭州市肿瘤医院进行TTFields 的高级别脑胶质瘤患者的临床数据,以评价TTFields 的近期疗效和安全性。
1 资料与方法
1.1 一般资料
采用单中心回顾性方法,收集2020 年1 月至2021年10 月在杭州市肿瘤医院进行术后辅助放化疗及TTFields 的8 例高级别脑胶质瘤患者的临床资料,其中男4 例,女4 例;年龄33~61 岁,中位年龄50岁;卡氏功能状态(Kamofsky performance status,KPS)评分≥80 分7 例,<80 分1 例;WHO Ⅲ级3 例,WHOⅣ级5 例;根据分子病理检测结果,2 例具有异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH)突变特征,6例为IDH1 野生型;O–甲基鸟嘌呤–DNA 甲基转移酶(O–methylguanine–DNA–me-thylhransferase,MGMT)甲基化2 例,非甲基化6 例;端粒酶逆转录酶(telomerase reverse transcriptase,TERT)启动子突变阳性4 例,阴性4 例;开始使用TTFields 时,2 例为复发病例,6 例为新诊断的高级别脑胶质瘤病例,见表1。本研究获得杭州市肿瘤医院伦理委员会批准(伦理审批号:HZCH–2022 快审第004 号),所有研究对象已签署临床研究知情同意书。

表1 8 例患者的临床资料
1.2 纳入与排除标准
纳入标准:①经病理组织确诊为高级别脑胶质瘤;②年龄在18 岁以上;③完成术后辅助放疗,④使用TTFields≥2 个月;⑤有可测量病灶。排除标准:①病例资料不全;②失访或不配合随访;③合并心血管、肝脏及肾脏等严重并发症;④有其他恶性肿瘤病史。
1.3 放疗及Stupp 方案化疗
全组患者手术治疗后2~7 周内开始辅助放疗,且完成全程放疗。使用6MV–X 射线直线加速器进行照射,容积旋转调强放疗技术,常规分割方式进行照射,处方剂量为:59~60Gy/28~30 次,2.0~2.15Gy/次,每天1 次,每周5 次。Stupp 方案:放疗期间予以替莫唑胺同步化疗,剂量为75mg/(m·d),连续口服42d;在放疗完成1 个月后,每28 天按照标准的5d计划给予替莫唑胺辅助化疗,剂量为150~200mg/(m·d),共6 个周期,疾病进展或出现不能耐受的不良反则予以停用。
1.4 TTFilds 治疗
TTFilds 仪器是一种便携式医疗器械。该器械可传输中频、低场强的交变电场。纳入的8 例患者均接受TTFilds(以色列NovoCure GmbH 公司)。治疗参照手术前和最近1 个月内的颅脑磁共振影像学资料;有专业人员通过TTFields 治疗计划系统设计最佳电场贴片位置;治疗时需同时使用4 片电场贴片,根据电场贴片示意图放置贴片位置;每周需更换2 次电场贴片(每3~4d 更换1 次),并持续使用TTFilds进行治疗,建议每天至少使用18h;设备支持专员每月下载并分析患者依从性数据,并返回给临床医师。
1.5 随访与临床评估
研究主要终点事件为无进展生存期(progression–free survival,PFS),是指佩戴TTFields 治疗开始至疾病进展或死亡时间;研究次要终点事件为不良事件发生率。本研究末次随访日期为2022 年4 月30日,中位随访时间为14.4 个月。
术后24~48h 的头颅磁共振平扫+增强图像为基线影像学标准。在TTFields 治疗开始后每1~2 个月进行头颅磁共振检查。疗效评价参照神经肿瘤反应评价(response assessment in neuro–oncology,RANO)标准。
不良事件记录参考TTFields 相关皮肤不良事件分级标准及不良事件通用术语标准(common terminology criteria for adverse events,CTCAE v5.0)。TTFields 相关皮肤不良事件由研究人员亲自评估,共分为4 级:1 级表现为轻度或无症状,不需要处理或仅需要局部治疗,TTFields 中断时间小于3d;2 级为中度症状,需要系统治疗,TTFields 中断3d 以上;3级症状严重,不立即治疗将危及生命;4 级症状危及生命,需要紧急干预。
1.6 统计学方法
采用SPSS 20.0 统计学软件对数据进行处理分析。采用Kaplan–Meier 法计算8 例接受TTFields 患者的PFS,并绘制生存曲线。计算95%置信区间(confidence interval,)。<0.05 为差异有统计学意义。
2 结果
2.1 治疗情况
8 例患者治疗情况见表2,有2 例为脑胶质瘤颅内复发后开始进行TTFields,其中1 例进行TTFields的同时联用盐酸安罗替尼胶囊,每次10mg,每天1次,早餐前口服,连续服药2 周,停药1 周,即3周为1 个疗程抗血管生成治疗,另外1 例TTFields的同时联合贝伐珠单抗注射液,每次10mg/kg,静脉注射,每2 周1 次抗血管生成治疗。另外6 例为新诊断的高级别脑胶质瘤患者,均在术后辅助同步放化疗开始时进行TTFields,其中2 例在同步放化疗结束后,因头皮反应以及不习惯长期佩戴停用TTFields;4 例在进行Stupp 方案化疗时继续使用TTFields,其中1 例因情绪原因在佩戴5 个月后拒绝继续TTFields。
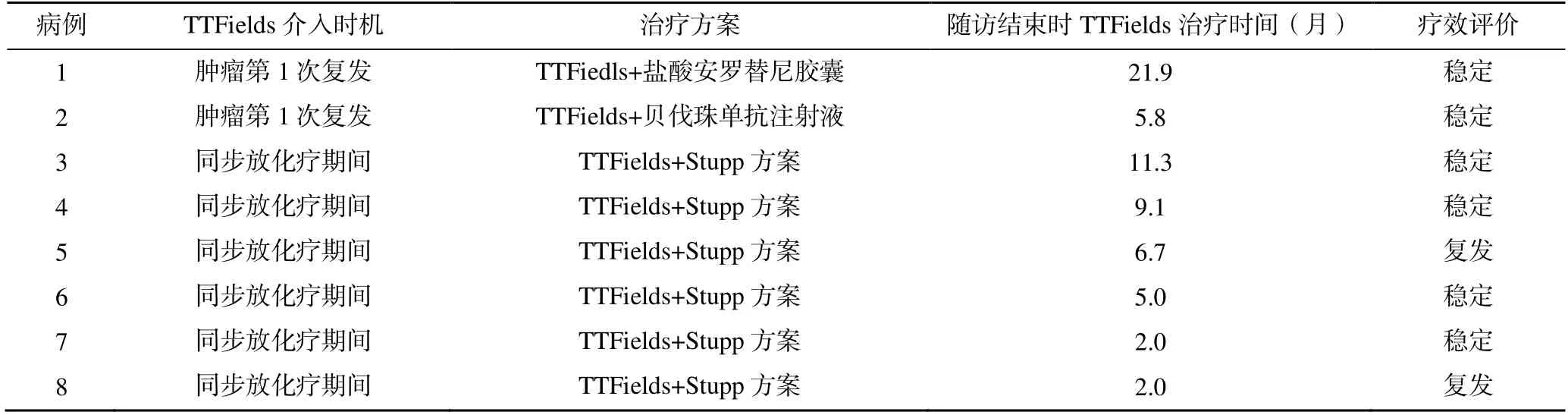
表2 8 例患者的TTFields 情况
2.2 TTFields 持续时间和依从性
8 例患者共使用TTFields 63.8 个月,中位治疗持续时间为4.2 个月(2.0~21.9 个月)。依从性:肿瘤电场治疗仪会产生一个内部日志文件,允许根据每月中的日平均治疗时间计算患者治疗依从性。8 例患者总的中位治疗依从性为91.5%(61.9%~97.0%)。
2.3 患者的预后分析
随访至2022 年4 月30 日,全组8 例患者在佩戴TTFields 后有2 例出现肿瘤复发,均为术区复发,无死亡事件,中位PFS 为12.7 个月(95%:5.931~19.469),见图1。
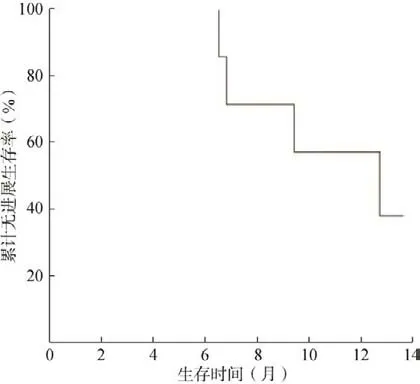
图1 8 例患者无进展生存时间曲线
2.4 不良反应
主要的不良反应为电场贴片接触的头部皮肤反应。2 例(25%)患者在同步放化疗期间佩戴TTFields时,出现1~2 级TTFields 相关皮肤不良事件,表现为头皮红斑、小水疱,局部予以皮质类固醇乳膏涂抹后好转。没有发现消化道、血液学及感染等不良事件。无3~4 级严重不良事件。
3 讨论
TTFields 是一种新型的非侵入性的抗肿瘤治疗方法,通过皮肤传感器阵列,将低强度(1~3V/cm)、中频(100~300kHz)交变电场局部作用于肿瘤部位,选择性地干扰肿瘤细胞有丝分裂过程,以达到抑制肿瘤细胞增生的目的。2011 年,美国食品药品监督管理局(Food and Drug Administration,FDA)批准TTFields 用于复发性胶质母细胞瘤的治疗。2015 年,FDA 批准TTFields 联合替莫唑胺用于新诊断的胶质母细胞瘤的治疗。2018 年,美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南已将常规放疗联合同步及序贯化疗联合TTFields 治疗作为新诊断高级别脑胶质瘤的Ⅰ类推荐。2019 年,我国《脑胶质瘤诊疗规范(2018年版)》推荐TTFields 用于新发胶质母细胞瘤(Ⅰ级证据)和复发高级别脑胶质瘤的治疗(2B 级证据)。本研究中,8 例高级别脑胶质瘤患者使用TTFields的时间均≥2 个月,治疗的中位依从性为91.5%,中位PFS 为12.7 个月,显著高于既往的研究数据(PFS为6.9 个月)。其中2 例出现1~2 级局部接触性皮炎,无3~4 级不良反应。
有研究对TTFields 作用机制报道如下:①TTFields参与细胞电生理活动。细胞电生理活动在信号转导、有丝分裂等生理过程中起着重要作用。生物细胞含有许多有极性、带电的分子和离子,如蛋白质和DNA。在交变电场的作用下,这些分子和离子会朝着一定的方向运动。不均匀电场中,所有带电分子都会向高场强方向移动。当电场的频率足够高时,例如,在肿瘤治疗电场的情况下,分子运动的强度就会减弱。②TTFields 干扰有丝分裂纺锤体的形成。在有丝分裂期间,纺锤体将复制的染色体均等地分布到2 个子细胞中。微管蛋白是一种微小的极性分子,可聚合成棒状亚基,延伸到排列在细胞中心的遗传物质,并与染色体结合。分析表明,TTFields选择性地影响细胞分裂,而未分裂的细胞保持不受干扰。TTFields 破坏微管蛋白以阻止有丝分裂和纺锤体的形成。TTFields 还可诱导肿瘤细胞有丝分裂长期停滞在间期(G/S/G),阻止肿瘤细胞的有丝分裂周期,甚至引起细胞分裂,导致异常的染色体分离、多核和凋亡。③TTFields 诱导处于有丝分裂中后期的细胞进行双向电泳,导致肿瘤细胞结构紊乱和破坏,最终抑制肿瘤生长。一系列体外研究报道,TTFields 抑制增生并杀死肿瘤细胞,包括黑色素瘤、胶质瘤、肺癌、前列腺癌和乳腺癌细胞。TTFields抑制肿瘤细胞分裂、促进细胞凋亡的作用与电场强度有关。在一定范围内,随着电场强度的增加,对肿瘤细胞的抑制作用逐渐增强。不同的细胞对电场强度的敏感性不同。最敏感的细胞是大鼠黑色素瘤细胞,最不敏感的细胞是人类乳腺癌细胞。
TTFields 在高级别脑胶质瘤治疗方面显示出巨大潜力。2002 年,EF–02 试验是TTFields 的首次人体研究,试验纳入6 例经组织学证实的局部晚期或转移的恶性肿瘤患者,其中1 例为胶质母细胞瘤患者。患者接受100~200kHz、场强0.7V/cm 的TTFields疗法2~4 周,结果证实TTFields 的潜在疗效和安全性,TTFields 的耐受性高达80%,唯一的不良反应是皮肤刺激,且通过局部用药和调整电极位置可缓解。EF–07 是一项单中心、探索性研究,考察TTFields 与替莫唑胺联合疗法在10 例新诊断胶质母细胞瘤受试者治疗中的应用。该研究患者的中位PFS已远超既往在新诊断胶质母细胞瘤患者中开展的临床试验结果(分别为155 周和31 周),中位生存期超过40 个月(而历史对照组则为14.7 个月)。临床试验中可见设备电场贴片下轻、中度皮肤刺激是常见的与设备有关的不良事件。继而,Stupp等开展一项针对复发性胶质母细胞瘤患者的随机Ⅲ期临床试验(EF–11),该临床试验共纳入237 例复发性胶质母细胞瘤患者,中位年龄为54 岁,KPS≥70分。随机分组后,120 例进行单独TTFields 治疗,117例接受单药/联合化疗。结果显示,单独TTFields 治疗组和化疗组患者的中位总生存期(overall survival,OS)分别为6.6 个月和6.0 个月,差异无统计学意义(>0.05);两组患者的中位PFS 分别为2.2 个月和2.1 个月,差异无统计学意义(>0.05)。但单独TTFields 治疗组耐受性较好,不良事件显著减少。下一项随机临床试验(EF–14)将研究对象扩大到新诊断的胶质母细胞瘤患者,共纳入698 例患者,其中接受TTFields 和替莫唑胺联合治疗的共466 例,单独接受替莫唑胺化疗的有229例,结果显示,TTFields联合替莫唑胺治疗组与单独替莫唑胺治疗组患者的中位PFS 分别为6.7 个月(95%:6.1~8.1)和4.0个月(95%:3.8~4.3),与单独接受替莫唑胺治疗的患者相比,接受TTFields 和替莫唑胺联合治疗的患者中位PFS 增加2.7 个月,差异有统计学意义(<0.001)。两组患者的中位OS 分别为20.9 个月(95%:19.1~22.6)和16.0 个月(95%:13.9~18.2 个月),TTFields 联合替莫唑胺治疗组OS 延长31%,差异有统计学意义(<0.001)。对于不良事件发生率,除TTFields 治疗的受试者的头皮刺激外,2个队列之间没有显著差异,没有严重毒性或不良事件发生。2021 年,杨群英等分析真实世界中15例复发和9 例新诊断的接受电场治疗的高级别脑胶质瘤患者的疗效和安全性,结果显示,TTFields 显著延长复发高级别脑胶质瘤患者的OS,且依从性好、耐受性高。
综上所述,TTFields 是一种新型的无创肿瘤治疗方法,可显著性延长复发性胶质母细胞瘤和新诊断的高级别胶质瘤患者的生存期,且TTFields 具有良好的依从性、安全性及耐受性。由于本研究为单中心回顾性分析,随访时间短,病例数少,后续需设计更为严谨的大样本多中心研究,以为脑胶质瘤患者TTFields 提供更多的临床支持。
