液相色谱-串联质谱法测定草鱼中磺胺类药物的不确定度评定
2022-10-02王新新封腾望王慧姣李晋成孙慧武刘欢
王新新,封腾望,王慧姣,李晋成,孙慧武,刘欢*
(1. 中国水产科学研究院, 农业农村部水产品质量安全控制重点实验室, 北京 100141;2. 上海海洋大学水产与生命学院, 上海 201306)
磺胺类药物基本结构是对氨基苯磺酰胺,是可经取代反应合成的一类有机化合物的总称,其磺酰胺基上的氢可被杂环取代,形成多种多样的磺胺类化合物[1-2],磺胺类药物因其显著的抗菌作用,在水产养殖过程中常被用于预防疾病或作为饲料添加剂[3]。对养殖动物使用磺胺类药物后,大部分会以药物本身或其代谢物的形式排出体外,造成其在环境中的污染和动物体内的残留[4-8],并经食物链导致人体内磺胺类药物的富集[9-11],因此,长期摄入含磺胺类药物的食品会对人体产生致癌、致畸、致突变等严重的潜在危害[12-13]。
国际食品法典委员会、欧盟和美国都将磺胺类药物列为动物饲养过程中限制使用的药物,中国《食品安全国家标准 食品中兽药最大残留限量》规定水产品肌肉组织中磺胺类药物总量以及单个磺胺类药物的最大残留限量为100 μg/kg[14-16]。目前,水产品中磺胺类药物残留常采用液相色谱—串联质谱法测定[17-18],为保证检测结果的准确性和可靠性,有必要对测量不确定度的分量来源进行具体分析,评定影响测定结果的不确定度[19-20]。根据 《检验检测机构资质认定能力评价》 要求,应建立评定测量不确定度的程序,在检验检测过程出现临界值、内部质量控制或客户有要求时,报告测量不确定度。因此,本研究参照农业部1077号公告-1-2008,使用液相色谱—串联质谱法测定了草鱼(Ctenopharyngodonidella)中10种磺胺类药物残留,根据CNAS-GL06 《化学分析中不确定度的评估指南》[21]和 JJF 1059.1-2012《测量不确定度评定与表示》[22],对测定过程中标准溶液配制、测量重复性、标准曲线拟合、样品的称量等引入的不确定度进行分析评定,确定对测定结果影响较大的不确定度因素,为正确评价和使用检测数据提供依据。
1 材料与方法
1.1 材料与试剂
磺胺甲噁唑(SMZ,CAS:723-46-6)、磺胺二甲异噁唑(SFZ,CAS:127-69-5)、磺胺二甲基嘧啶(SM2,CAS:57-68-1)、磺胺甲基嘧啶(SM1,CAS:127-79-7)、磺胺甲二唑(SMT,CAS:144-82-1)、磺胺喹噁啉(SQX,CAS:59-40-5)、磺胺噻唑(STZ,CAS:72-14-0)、磺胺嘧啶(SDZ,CAS:68-35-9)、磺胺间甲氧嘧啶(SMM,CAS:1220-83-3)、磺胺氯哒嗪(SCP,CAS:80-32-0)标准物质均购于德国 Dr.Ehrenstorfer 公司;氘代磺胺邻二甲氧嘧啶(SDX-D3,CAS:2447-57-6)、氘代磺胺间二甲氧嘧啶(SDT-D6,CAS:122-11-2)均购于德国 Witega 公司;乙腈、甲醇、正己烷(色谱纯,美国 J.T.Baker 公司);乙酸铵、甲酸(质谱级,美国 Fisher 公司);无水硫酸镁(上海麦克林生化科技有限公司)。
鲜活草鱼购自北京市房山区琉璃河镇某养鱼场(约1 kg/尾),于北京市房山区中国水产科学研究院鲟鱼繁育技术与工程中心养殖池中暂养备用。
1.2 仪器与设备
QTRAP®5500超高效液相色谱-三重四级杆/复合线性离子阱质谱仪(美国SCIEX公司); MVM-2500多管涡流混合器(上海泰坦科技股份有限公司);MS3 Basic 基本型旋涡混匀器(德国IKA公司);SB-5200DTN超声波清洗机(宁波新芝生物科技股份有限公司);PL2002电子天平(Mettler Toledo仪器(上海)有限公司);H-2050R台式高速离心机(湖南湘仪实验室仪器开发有限公司);Buchi R210旋转蒸发仪(瑞士Buchi公司)。
1.3 实验方法
1.3.1 标准溶液配制
分别准确称取10.02 mg SMZ、10.03 mg SFZ、10.02 mg SM2、10.03 mg SM1、10.06 mg SMT、10.11 mg SQX、10.09 mg STZ、10.08 mg SDZ、10.19 mg SMM、10.09 mg SCP、10.02 mg SDX-D3、SDT-D6标准品,用甲醇配制成1.0 mg/mL标准储备液;分别移取适量标准储备液,用甲醇逐级稀释成浓度为100.0 μg/mL、10.0 μg/mL的外标混合标准中间液和内标混合标准中间液;以甲醇为溶剂,移取适量混合标准中间液,配制成1.0 μg/mL、100.0 ng/mL外标混合标准工作液和1.0 μg/mL内标混合标准工作液,-20 ℃保存。
1.3.2 样品测定
样品检测按照农业部1077号公告-1-2008中的操作方法测定SMZ、SFZ、SM2、SM1、SMT、SQX、STZ、SDZ、SMM、SCP残留量[23]。
1.3.3 液相色谱条件
色谱柱:Hypersil GOLD C18柱(150 mm×2.1 mm,5 μm);柱温:40 ℃;进样量:5 μL;流动相A为 0.1 %甲酸溶液(含5.0 mmol/L醋酸铵),B为甲醇;梯度洗脱程序见表1。
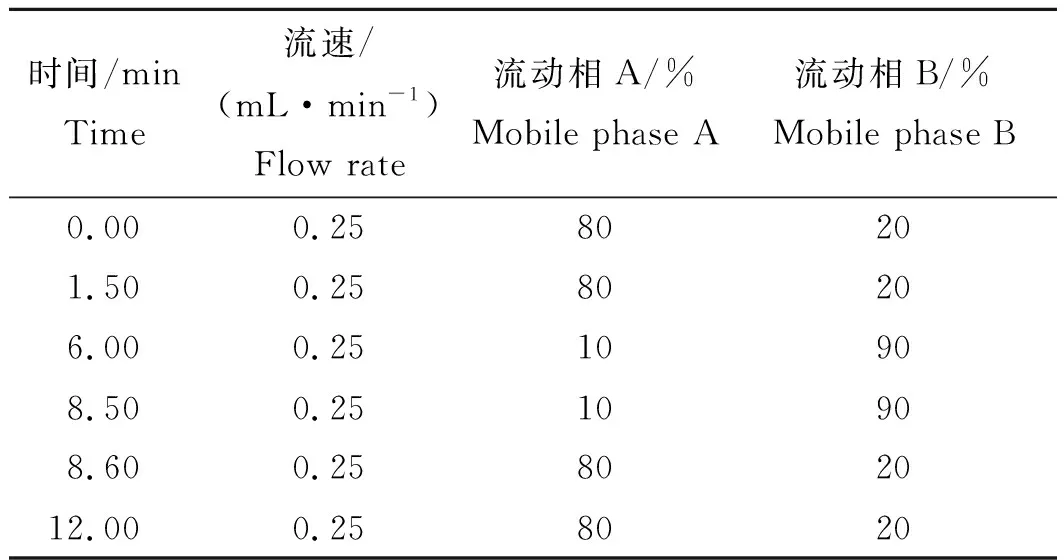
表1 梯度洗脱条件Tab.1 Conditions of gradient elution
1.3.4 质谱条件
采用电喷雾离子源(ESI),正离子模式下采用多反应监测(MRM)模式采集数据。离子源的详细参数如下:喷雾电压(IS):5 500 V;离子源温度(TEM):550 ℃;气帘气(CUR):30 psi;雾化气(GS1):45 psi;辅助加热气(GS2):55 psi;磺胺类化合物MRM质谱参数参考农业部1077号公告-1-2008。
1.4 数学模型
不确定度评定要从测量全过程的每一个环节入手,根据测定方法,建立草鱼样品中磺胺类药物残留量的数学模型如下:
式(1)
式中:X为样品中磺胺类药物的残留量,单位为μg/kg ;C为从标准工作曲线中得到的样品中被测组分的质量浓度,单位为 ng/mL ;V为试样最终定容体积,单位为mL;m为称样量,单位为g。
2 结果与分析
样品中磺胺类药物测量不确定度的来源主要有以下几个方面:外标标准溶液配制引入的不确定度u1;内标标准溶液配制引入的不确定度u2;测量重复性引入的不确定度u3;标准曲线拟合引入的不确定度u4;待测样品称量引入的不确定度u5;样品定容引入的不确定度u6。
2.1 外标标准溶液配制引入的不确定度u1
2.1.1 标准物质纯度的相对标准不确定度
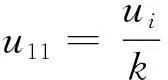
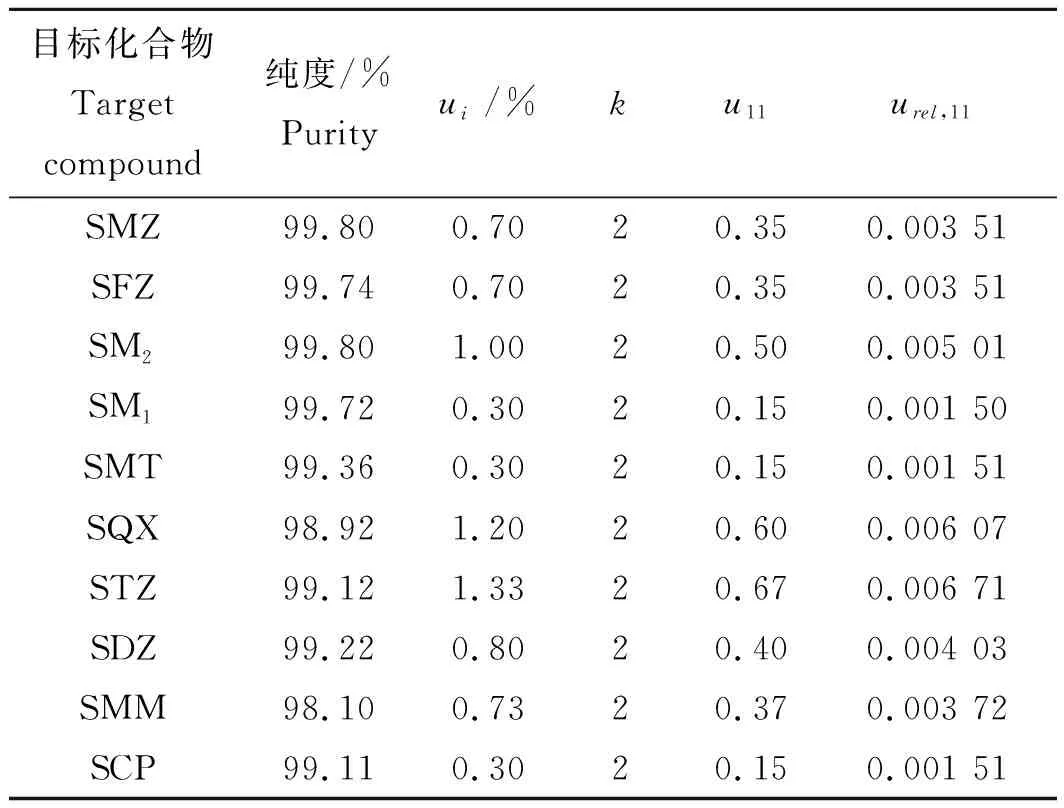
表2 标准物质纯度引入的不确定度Tab.2 Uncertainty introduced by the purity of standard substances
2.1.2 标准物质称量引入的相对标准不确定度urel,12
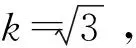
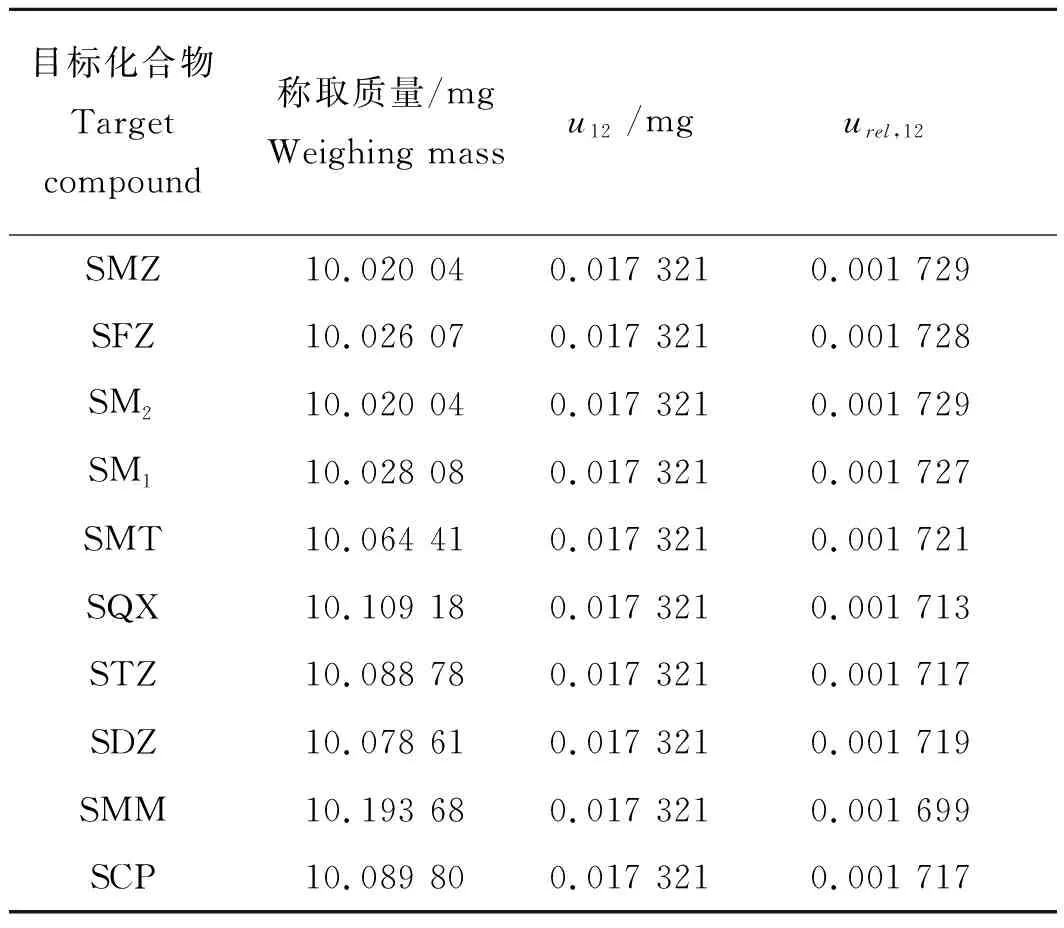
表3 标准物质称量引入的不确定度Tab.3 Uncertainty introduced by the weighing of standard substances
2.1.3 标准物质定容引入的相对标准不确定度urel,13
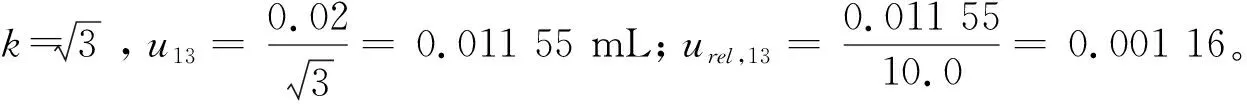
2.1.4 稀释过程引入的相对标准不确定度urel,14
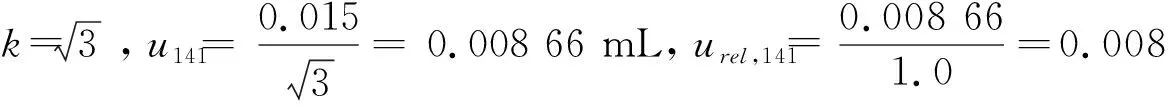
综上,10种磺胺类药物的外标标准溶液配制引入的相对标准不确定度结果分别为:
2.2 内标标准溶液配制引入的不确定度u2
2.2.1 内标标准物质纯度引入的相对标准不确定度urel,21
内标标准物质纯度引入的不确定度见表4。

表4 内标标准物质纯度引入的不确定度Tab.4 Uncertainty introduced by the purity of internal standard reference material
2.2.2 内标标准物质称量引入的相对标准不确定度urel,22
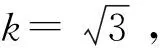
2.2.3 内标标准物质标准品定容引入的相对标准不确定度urel,23
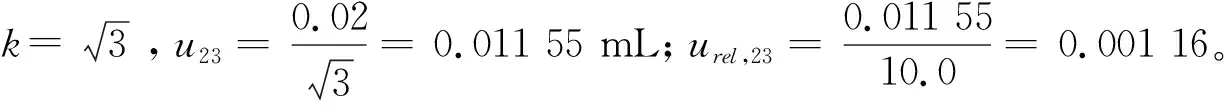
2.2.4 稀释过程引入的相对标准不确定度urel,24
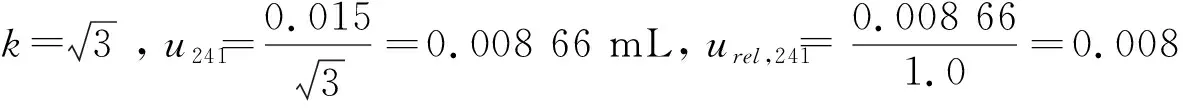
2.2.5 内标标准物质加入体积引入的相对标准不确定度urel,25
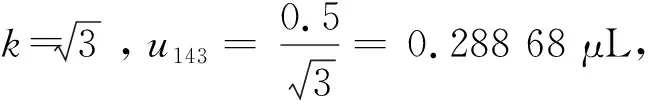
综上,内标标准溶液引入的相对标准不确定度结果如下:
urel,2,SDT-D6=
urel,2,SDX-D3=
2.3 测量重复性引入的不确定度u3
测量重复性引入的不确定度,在实验中主要是样品平行测定引入的不确定度,按1.3实验方法对样品进行测定,以 6 次测量的平均值作为测量结果,平均值的标准偏差S(x)及测量重复性引入的不确定度见表5。
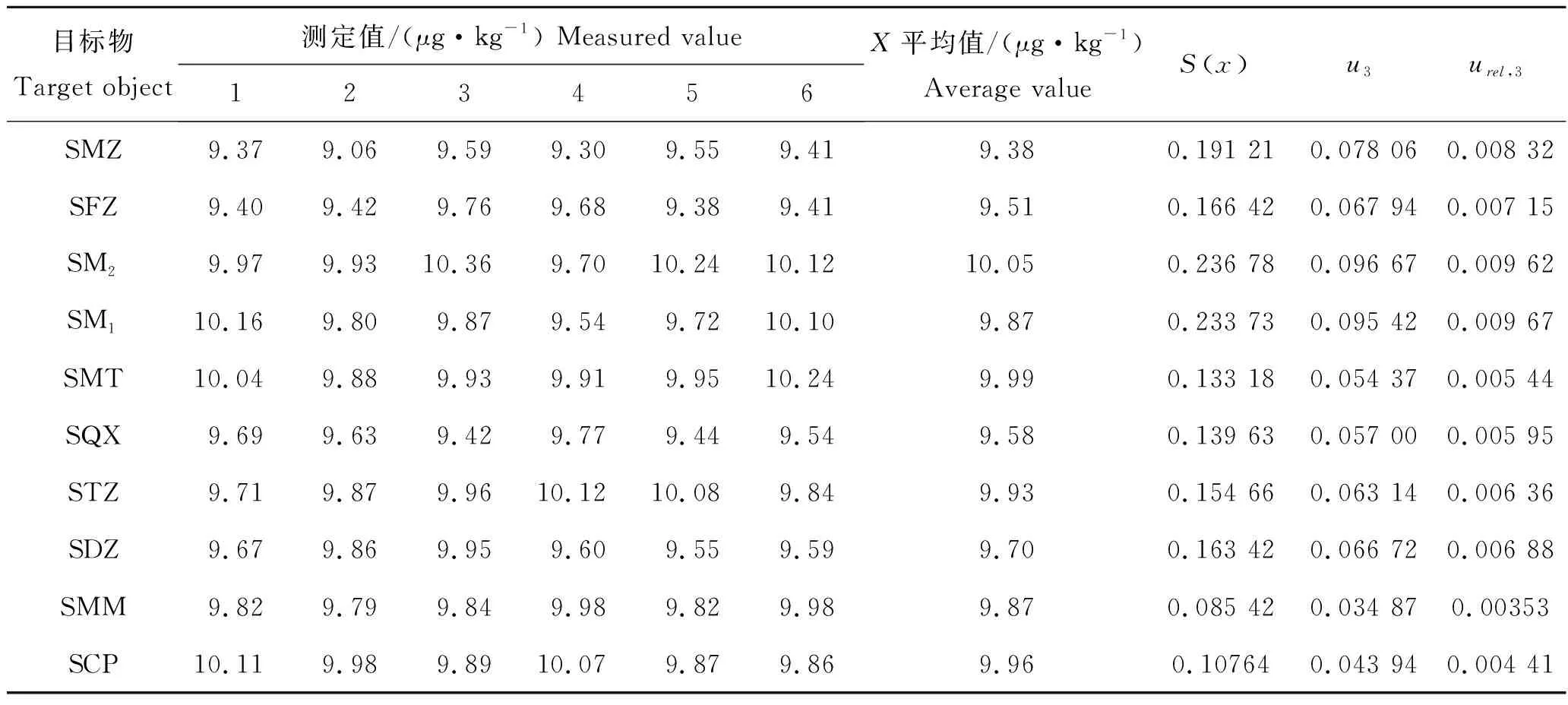
表5 重复性测定结果和不确定度Tab.5 Repeatability determination results and uncertainty
2.4 标准曲线拟合引入的不确定度u4
对标准工作溶液进行测定, 经线性拟合得到校准曲线。采用5个浓度水平的混合标准工作液,每个浓度测定6次,以标准溶液浓度Ci为横坐标,以标准溶液外标峰面积(A外标)与内标峰面积(A内标)的比值为纵坐标,采用最小二乘法拟合获得线性回归方程A=a+b×C(a为截距,b为斜率)和相关系数。本研究中对样品测定液测量次数为6次,线性回归导致C0的标准不确定度为u4,根据下列公式对标准曲线拟合引入的标准不确定度进行计算[16],结果见表6。
式(2)
式(3)
式(4)
式(5)
式(6)
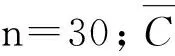

表6 最小二乘法拟合标准曲线及不确定度Tab.6 Fitting standard curve and uncertainty by least square method
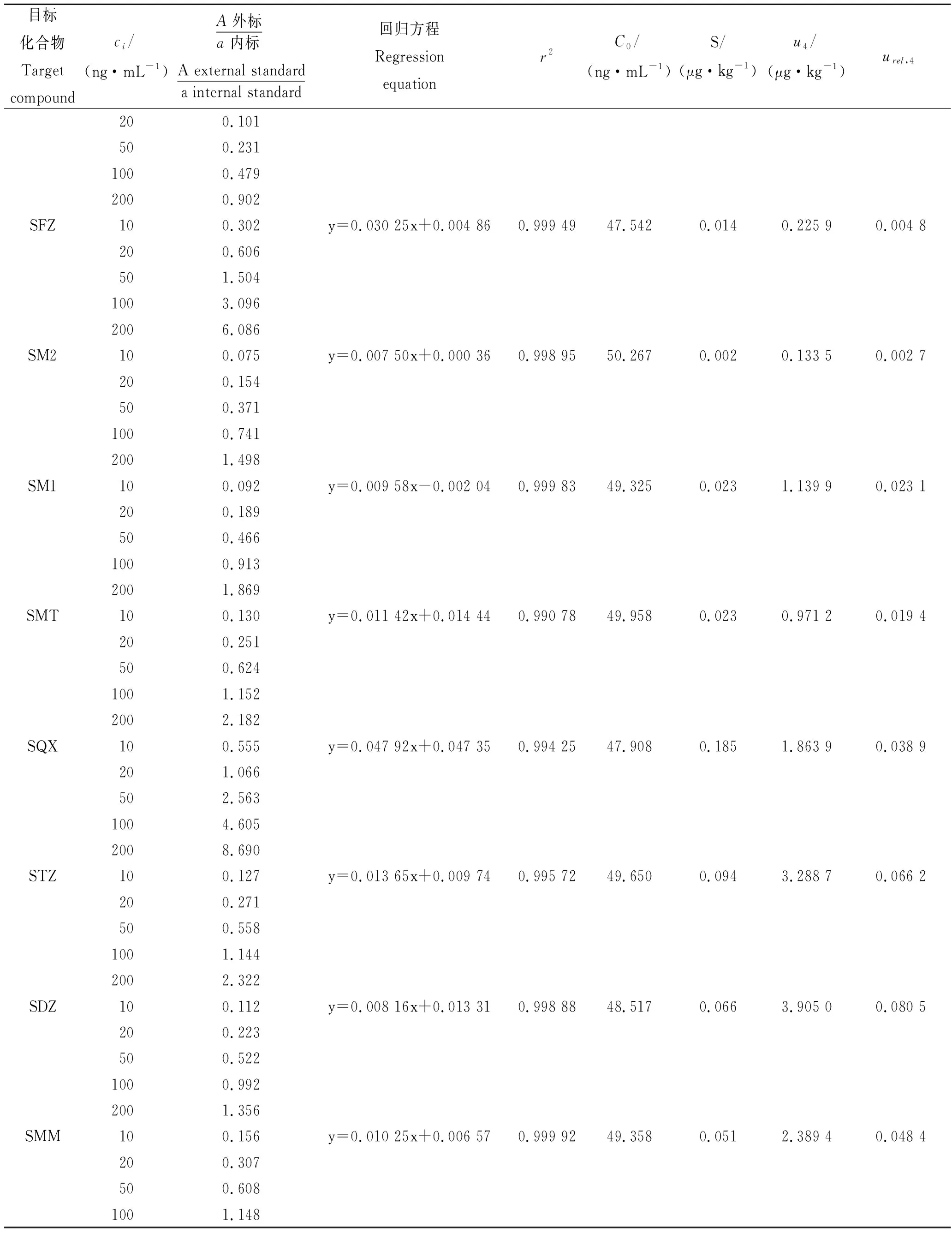
续表6,Tab.6 Continued

续表6,Tab.6 Continued
2.5 样品称量引入的不确定度u5
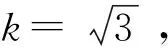
2.6 样品定容引入的不确定度u6
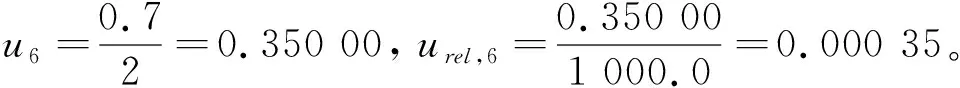
2.7 合成不确定度uc
液相色谱-串联质谱法测定草鱼中磺胺类药物的相对合成不确定度urel和合成标准不确定度uc分别按照urel=
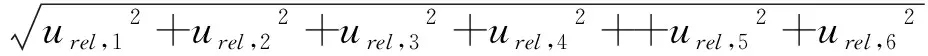
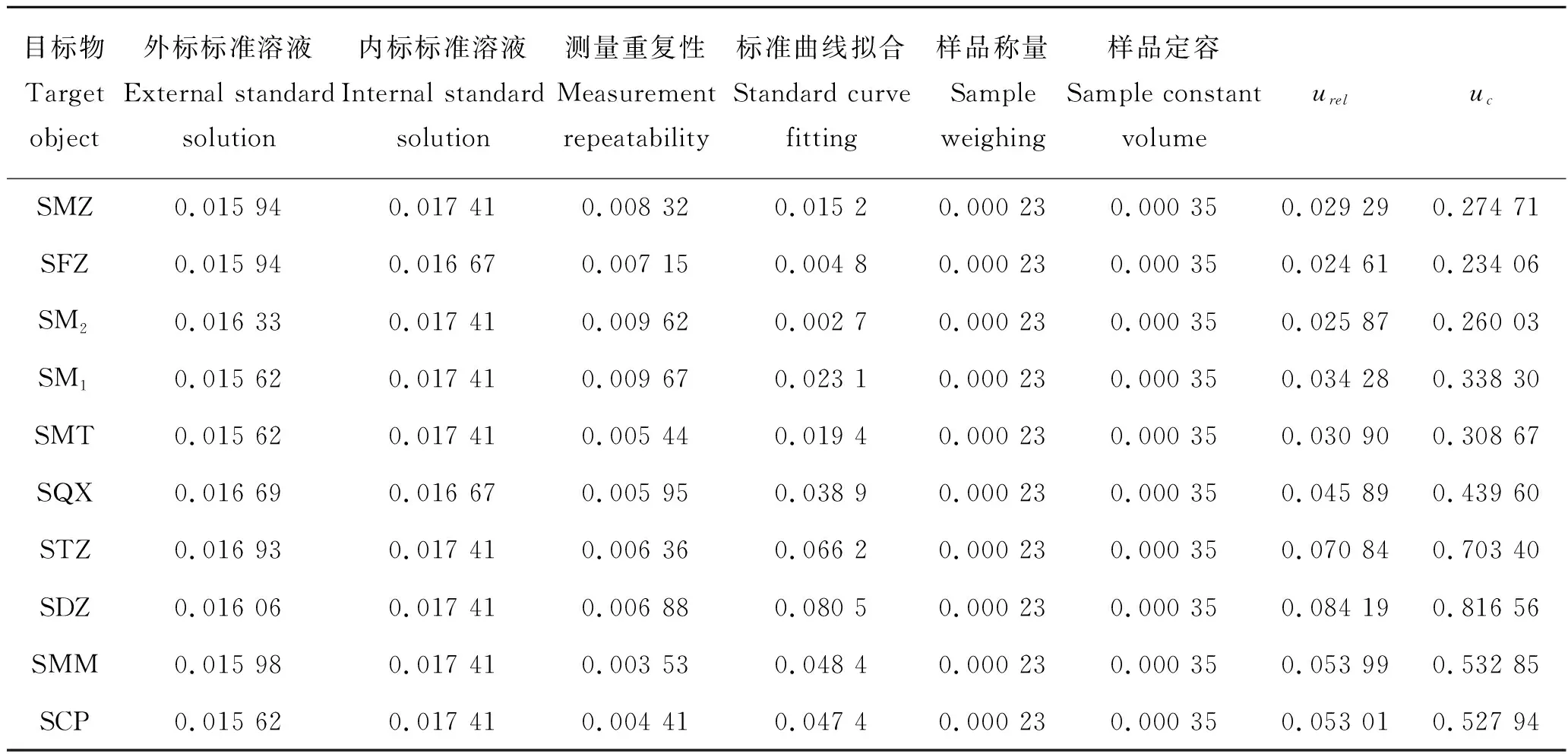
表7 不确定度分量及相对合成不确定度Tab.7 Uncertainty component and relative combined uncertainty
2.8 扩展不确定度U
包含因子取k=2,扩展不确定度按照公式U=k·uc计算,因此,草鱼中磺胺类药物残留不确定度评定结果见结果见表8。
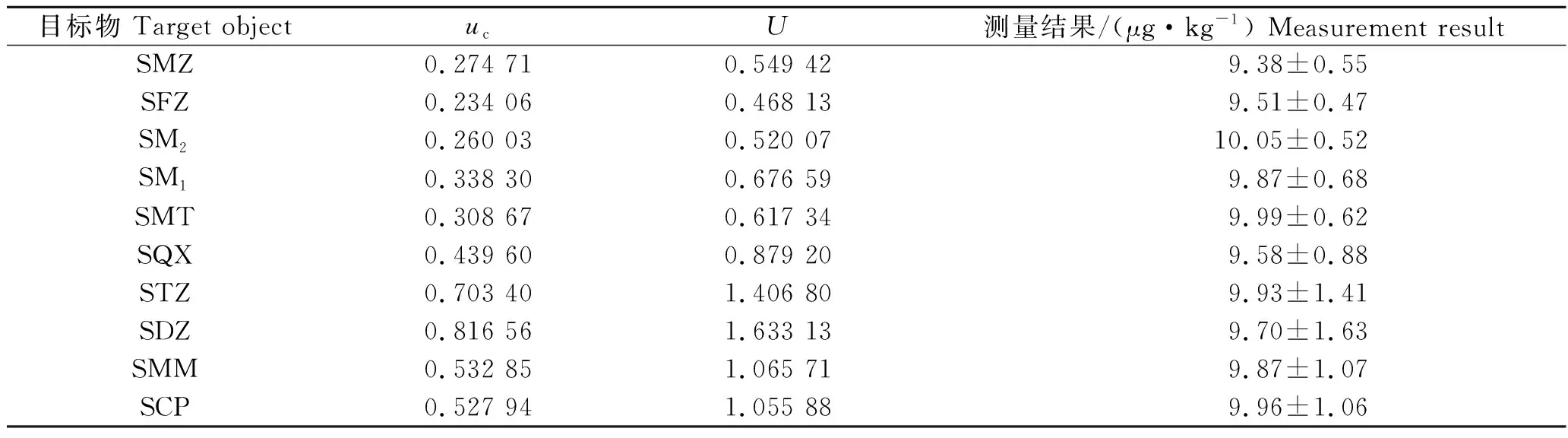
表8 不确定度评定结果Tab.8 Uncertainty evaluation results
3 结论
本研究分析了液相色谱-串联质谱法测定草鱼中10 种磺胺类药物残留的不确定度,通过评估各不确定度分量,建立了不确定度评估数学模型。不确定度评定结果如图1所示:经过分析和评定发现影响测定结果不确定度的主要因素为标准曲线拟合、标准溶液的配制,其次是测量重复性引入的不确定度,样品定容与样品称量引入的不确定度贡献较小,可忽略不计。因此,在实际操作过程中应尽量提高实验人员的操作规范,并选择经过检定、精度较高的容量瓶与移液管,减少由标准溶液配制引入的不确定度。在检测磺胺类药物过程中,可采取增加测量的平行测定次数或提高标准曲线线性,减少不确定度。此外,还应定期检定、校准仪器,严格管理和维护仪器设备,保持液质联用仪良好的稳定性和较高的灵敏度,来保证检测结果的准确度,降低分析结果的不确定度。
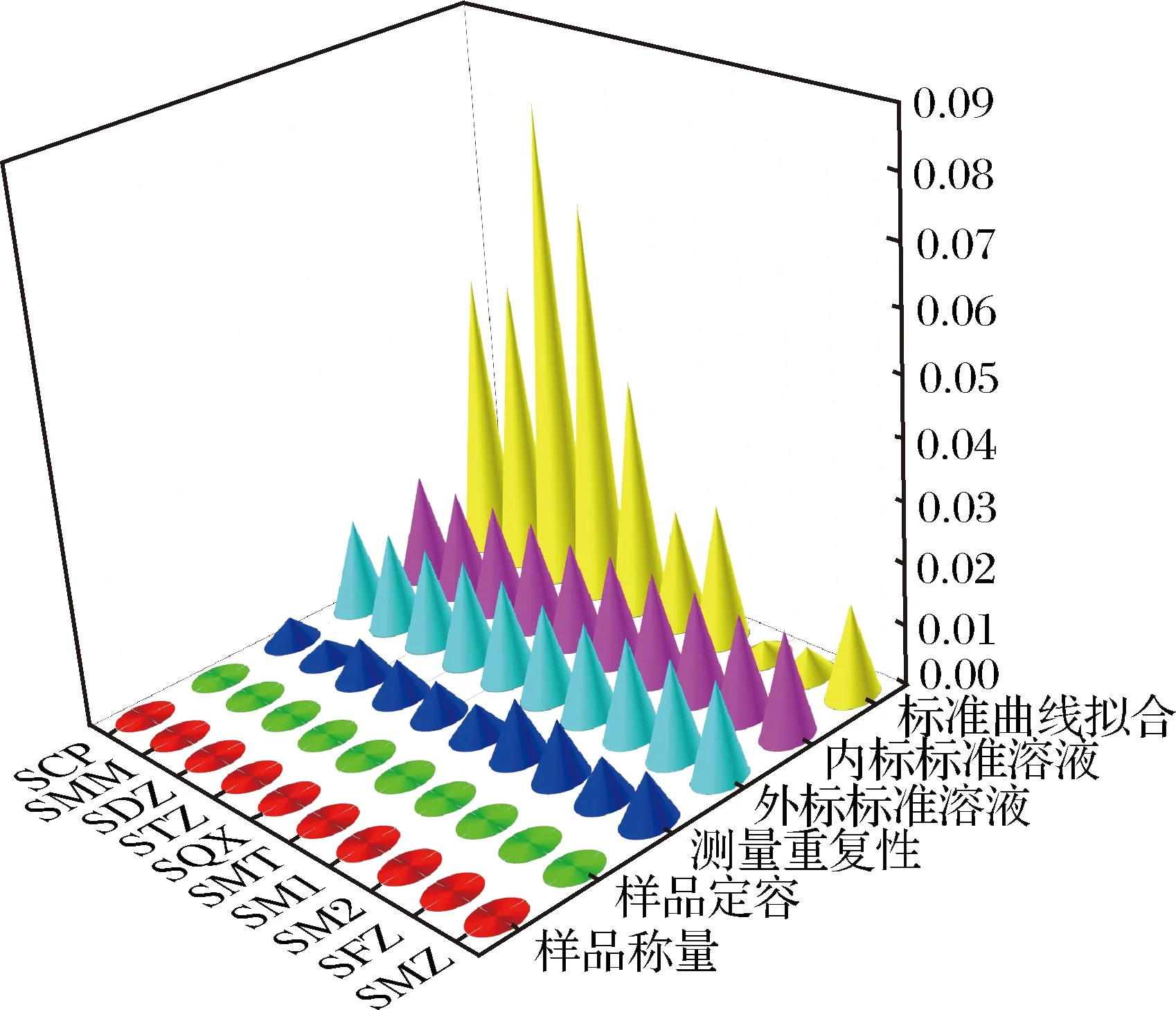
图1 不确定度分量评定结果Fig.1 Uncertainty component evaluation results
