沉默A549 细胞中的CD46 和DSG2 可抑制人3 型和7 型腺病毒的侵入及IL-8的释放
2022-10-02杨中英付扬喜陈诗懿刘恩梅
人腺病毒(HAdV)为无包膜的线性双链DNA 病毒,其结构分为病毒核心及衣壳两部分,衣壳呈二十面体结构,主要由五邻体、六邻体和纤毛蛋白3种蛋白构成。HAdV为儿童急性呼吸道感染的常见病原之一,在世界范围内广泛流行。腺病毒肺炎是世界范围内小于5岁儿童患病率及死亡率最高的病毒性肺炎,死亡率最高可达50%。腺病毒肺炎引起的持续性高热及呼吸衰竭的发生率占呼吸道常见病毒的首位,常伴有危及生命的严重并发症,如呼吸衰竭、急性呼吸窘迫综合征(ARDS)、肺出血、脑炎等。迄今为止,腺病毒分为7个亚属(A-G),包括100多个基因型;其中B亚属中的人腺病毒3型(HAdV-3)、人腺病毒7型(HAdV-7)是引起全球范围内儿童重症腺病毒肺炎的主要病原。然而,目前临床上尚无针对HAdV的特异性有效治疗方法,因此,对于腺病毒感染的病毒复制和炎症因子干预的相关机制研究对于制定抗腺病毒策略至关重要。
既往研究多重点关注病毒复制周期进入后的阶段,如对腺病毒入胞后早期、中期和晚期病毒基因(包括E1A、IVa2、hexon等)沉默对体外腺病毒复制的影响。同时,抗腺病毒药物(包括西多福韦)的设计也主要靶向病毒入胞后的复制。腺病毒纤毛蛋白与相应的受体结合后介导腺病毒粘附靶细胞,启动胞吞作用,促使HAdV 入胞,这是腺病毒感染致病的第一步。腺病毒的纤毛蛋白与受体结合入胞是病毒感染的关键环节,研究报道三价化合物ME0322能够有效地抑制37型腺病毒纤毛蛋白结合唾液酸受体,茶素没食子酸酯(EGCG)可以通过与硫酸乙酰肝素或唾液酸部分竞争结合腺病毒粒子。但以上研究均未证明阻断受体与病毒结合后的效应以及具体机制。
CD46是识别B亚属腺病毒纤毛蛋白的受体之一,B亚属腺病毒纤毛蛋白与CD46 结合触发了感染。早期研究认为CD46 同时做为HAdV-3 和HAdV-7 的受体近年来桥粒芯蛋白(DSG2)被认为是与B亚属的3、7、11、14、55型腺病毒结合的主要高亲和力受体。HAdV-3和HAdV-7具有嗜气道上皮细胞特性,直接与宿主受体CD46、DSG2特异性结合,介导病毒的初始接触并促进入胞,从而触发后续细胞信号转导,引起呼吸道感染。本文以A549 细胞为研究对象,并通过siRNA 的干扰分析沉默CD46、DSG2 对HAdV-3、HAdV-7的入胞及炎症因子释放的影响,说明CD46、DSG2是抗腺病毒感染的潜在靶点,为针对腺病毒与宿主细胞受体的结合设计抗腺病毒药物以及疫苗的设计和改进提供参考。
同时,开设客观评标分值体系,采用综合评分法,可以根据维保标的物的实际情况,设置不同评审要素,如维修工程师资质、经验、用户评价和PDCA记录等客观指标,“从而最大程度减少对投标人维保方案的主观判断,避免投标人仅因文件做得好的印象分中标。”
1 材料和方法
1.1 实验材料
A549细胞株(中国社会科学院上海细胞库),由重庆医科大学附属儿童医院儿科研究所儿童呼吸病学研究室稳定传代后保存提供。DMEM培养基、胎牛血清、青霉素、链霉素(Gibco)。氯化铯(默克),氯化铯离心柱(Bio-Rad)。病毒DNA提取试剂盒(Qiagen);HAdV-3、7标准品质粒和TaqMan荧光探针由Invitrogen公司设计合成,qRT-PCR引物由北京六合华大基因科技有限公司引物合成,SYBR qPCR Master Mix(南京诺唯赞生物科技股份有限公司)。CD46、DSG2的siRNA干扰序列(siRNA-CD46、DGS2)及非特异性序列(siRNA-CD46、DGS2 Nc)由Santa Cruz公司设计并合成,转染试剂及转染专用培养基(Santa Cruz),siRNA-CD46(h)(sc-35004),siRNA-DSG2(h)(sc-35226)。BCA 蛋白定量试剂盒、一抗稀释液及快速封闭液(碧云天生物技术有限公司),全蛋白提取试剂盒(江苏凯基生物技术股份有限公司)。一抗CD46(Abcam)、DSG2(成都正能生物技术有限责任公司);HAdV-3抗体、HAdV-7抗体为广州医科大学呼吸疾病国家重点实验室赠予;Western blot山羊抗兔二抗(成都正能生物技术有限责任公司),免疫荧光山羊抗兔Cy3二抗(博士德生物工程有限公司)、驴抗小鼠555 二抗(碧云天生物技术有限公司)。人IL-8 ELISA试剂盒(深圳欣博盛生物科技有限公司)。
1.2 病毒分离与纯化
使用Graphpad Prism8.0软件进行统计分析,计量资料用均数±标准差表示;多组比较用采用单因素方差分析,以<0.05为差异有统计学意义。
1.3 细胞培养及转染
处理4、龙粳40,株行距为10cm*30cm。水整地时施入二胺6公斤、50%硫酸钾3公斤、尿素2公斤。插秧时侧深施肥时加入15公斤云天化复合肥。
将存放于液氮的A549细胞系复苏传代,DMEM 高糖培养基添加10%胎牛血清和1%双抗,置于37 ℃、5%CO培养箱内培养,待细胞长至70%~80%时,做传代和转染处理。A549细胞以适当密度接种于孔板中,配制如下溶液:溶液A:5 μL siRNA-CD46(10 μL siRNADSG2)、5 μL siRNA-CD46 Nc(10 μL siRNA-DSG2 Nc)加入到100 μL siRNA transfection Medium。溶液B:5 μL siRNA transfection reagent 加入到100 μL siRNA transfection Medium。然后将配制好的溶液A直接加入到溶液B中,轻轻混匀后室温孵育45 min。将0.8 mL siRNA transfection Medium直接加入到溶液A和溶液B 的混合液中,轻轻混匀后分别加入到siRNA-CD46(siRNA-DSG2)处理孔、siRNA-Nc阴性对照孔,空白对照孔则只加DMEM培养基,每孔加入所需培养基的一半。7 h后将剩余一半DMEM培养基(20%胎牛血清和2%抗生素)加入到孔板中的每一孔并孵育24 h,24 h后更换新的(10%胎牛血清和1%抗生素)DMEM培养基,根据实验设计的时间点进行转染后的实验。
1.4 Western blot 法检测转染siRNA 后CD46、DSG2表达
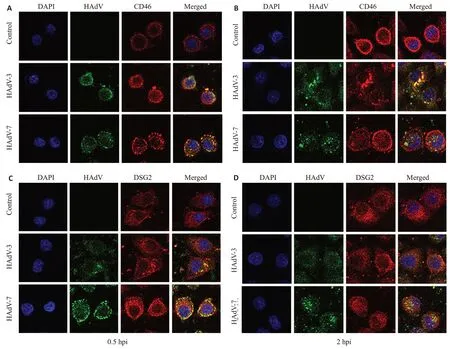
将细胞爬片置于12孔板,A549细胞(2.5×10/孔)转染siRNA-CD46 24 h,siRNA-DSG2 48 h 后吸弃旧液,以MOI=2000 vp/cell接种HAdV-3、HAdV-7后,用2%FBS的DMEM培养基于37 ℃,5%CO孵育0.5、2 h,然后用PBS漂洗10 min×3次,在室温下用4%多聚甲醛固定30 min,5%BSA封闭30 min,随后加入CD46兔单克隆抗体(1∶200 稀释)或DSG-2(AH12.2)兔多克隆抗体(1∶100 稀释),50 μL 的HAdV3(3E6-FITC)单抗(1∶50 稀释)或HAdV7(6F3-FITC)单抗(1∶100 稀释)并放入湿盒中,4 ℃孵育过夜;第2天用PBS漂洗10 min×3次,山羊抗兔Cy3 二抗(1∶500 稀释)或驴抗小鼠555二抗(1∶500 稀释),室温避光孵育1 h;经DAPI复染后,贴片,封片,然后在激光共聚焦扫描显微镜下采集图像。
2017年的世界互联网大会上,人们还在畅想“人工智能让生活更美好”,2018年,人们已经开始着眼“人工智能的融合发展的新机遇”。“融合”是人类为未来美好生活寻找的道路,而在这条路上,人工智能带领人类会走得更远,走向更开阔的生存空间,让一个又一个“可能”与“创见”在人们的生活里落地生根,舒枝展叶。
激光共聚焦显微镜观察结果显示,在感染早期,HAdV-3、HAdV-7与CD46、DSG2明显共定位(图1),HAdV-3、HAdV-7直接与其受体CD46、DSG2结合进入细胞。
1.5 免疫荧光检测病毒与受体结合情况
A549细胞(2.5×10/孔)铺于6孔板,转染siRNACD46 24 h,siRNA-DSG2 48 h后,用凯基全蛋白提取试剂盒提取各组细胞总蛋白,并以BCA 蛋白浓度检测试剂盒检测各组总蛋白浓度。蛋白质在10%SDS-PAGE凝胶上分离,然后转移到聚偏二氟乙烯(PVDF)膜上,快速封闭液封闭15 min 后,孵育一抗(CD46,1∶5000;DSG2,1∶2000)于4 ℃过夜,取出膜以TBST 洗脱后,室温孵育二抗(GAPDH,1∶10 000),使用化学发光(ECL)法获得蛋白条带,用于比较分析。
1.6 qRT-PCR检测人3、7型腺病毒拷贝数
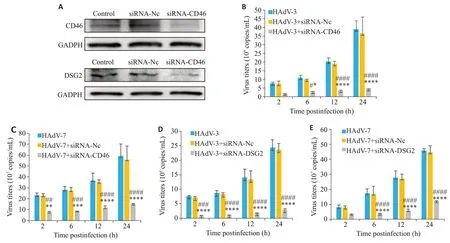
siRNA-CD46、siRNA-DSG2分别转染A549细胞24、48 h后,siRNA-CD46和siRNA-DSG2组与相应的siRNA-NC组比较,以及Control组比较,CD46、DSG2表达水平下调,而siRNA-NC组与Control组的CD46、DSG2表达无明显差异(图2A)。
1.7 统计学方法
HAdV-3(CQ5291)、HAdV-7(CQ4411)临床株分离于重庆医科大学附属儿童医院呼吸科腺病毒感染的住院患儿鼻咽抽吸物(NPAs),长期液氮保存。采用用氯化铯密度梯度离心法纯化病毒,测定值,计算病毒浓度(VP/mL)=×dilution×10,本研究中的HAdV-3和HAdV-7滴度为5×10VP/mL和3×10VP/mL。
2 结果
2.1 腺病毒与受体CD46、DSG2结合促进病毒的入胞
互动性是推特的又一大特性。传统媒体时代,用户大多数时候系被动接受内容,用户和信息发布者之间存在一定的互动可能性,如读者可给报社编辑写信或通过收视率向电视台作出反馈,但该类模式不对等程度较高,且实现较为不便。推特大大提高了用户间进行互动的便利。任一推特用户均可通过“@”、评论、带评论转发、私信等手段便捷地向其他用户发起互动,这一行为实时传达至对方,对方也可直接回应,这一过程易于实现,可操作性强。
2.2 转染siRNA-CD46、siRNA-DSG2 降低腺病毒拷贝数
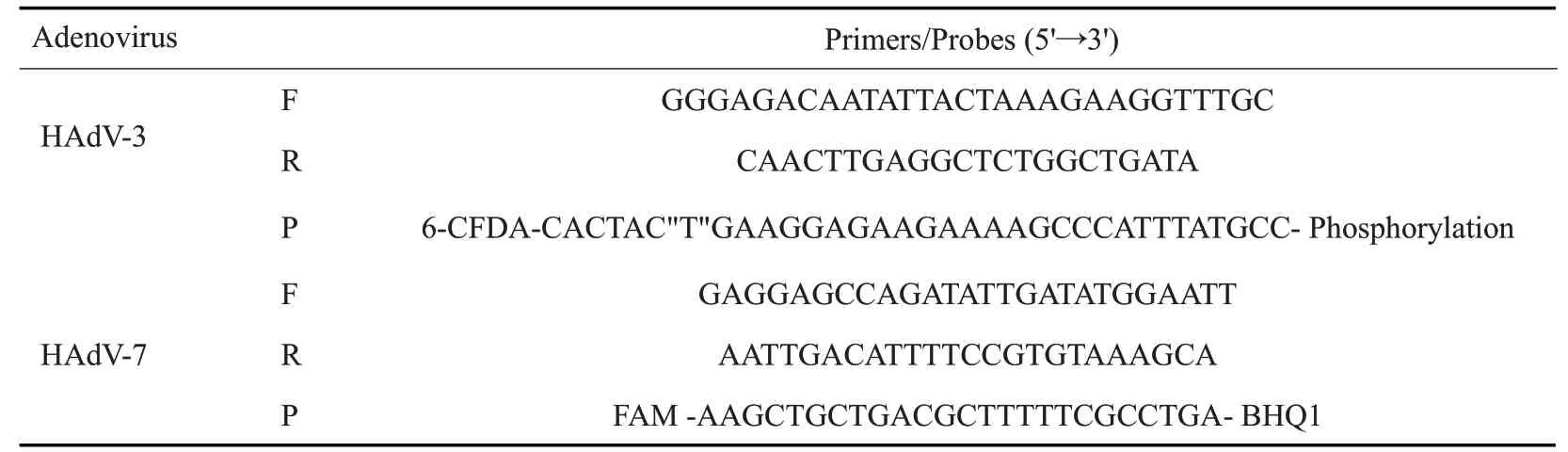
A549细胞(2.5×10/孔)铺于6孔板,转染siRNACD46 24 h,siRNA-DSG2 48 h后,以MOI为l vp/cell分别接种HAdV-3、HAdV-7后,用2%FBS的DMEM培养基于37 ℃,5%CO孵育2、6、12、24 h,然后按照Qiagen DNA提取试剂盒的说明书提取病毒DNA,qRT-PCR检测病毒拷贝数。腺病毒qRT-PCR的引物和探针序列、循环条件分别参照文献[25,26]。引物、探针序列(表1)。配制qRT-PCR反应体系:HAdV-3:mix 10 μL,上游引物0.6 μL,下游引物1.2 μL,探针0.4 μL,DNA 2.0 μL,dd HO 5.8 μL,合计20 μL。HAdV-7:mix 10 μL,上游引物1.2 μL,下游引物0.6 μL,探针0.1 μL,DNA 2.0 μL,dd HO 6.1 μL,共计20 μL。qRT-PCR 反应程序:95 ℃3 min;95 ℃15 s;60 ℃1 min(重复44个循环)。
HAdV-3、HAdV-7感染A549细胞后,病毒拷贝数呈时间依赖性增加(<0.01,图2B-E),且HAdV-7的病毒拷贝数高于HAdV-3。转染siRNA-CD46后6、12、24 h,HAdV-3、HAdV-7 病毒滴度均下降(HAdV-3:6 h,<0.05;12、24 h,<0.0001;HAdV-7:2 h,<0.01;6 h,<0.001,12、24 h,<0.0001,图2B、C)。在各时间点,与HAdV-3、HAdV-7组相比,siRNA-CD46 Nc组的病毒拷贝数无明显变化。与HAdV-3、HAdV-7组相比,siRNADSG2 Nc组的病毒拷贝数与病毒组差异无统计学意义(>0.05),而干扰DSG2 后2、6、12、24 h 显著降低了HAdV-3、HAdV-7的病毒拷贝数(<0.0001,图2D~E)。沉默CD46、DSG2,HAdV-7的拷贝数降低比例均大于HAdV-3:沉默CD46,HAdV-7的拷贝数在2、6、12、24 h分别减低75.54%、72.36%、81.97%、88.18%,HAdV-3的拷贝数在2、6、12、24 h 分别减低65.71%、69.16%、67.09%、73.71%;沉默DGS2,HAdV-7感染后2、6、12、24 h 的拷贝数分别降低88.42%、87.17%、86.38%、87.78%,HAdV-3 的拷贝数在对应时间点分别降低55.85%、77.57%、78.10%、73.56%。
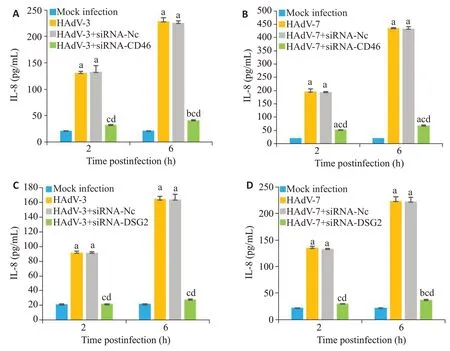
2.3 转染siRNA-CD46、siRNA-DSG2抑制腺病毒感染诱导的IL-8产生
HAdV-3、HAdV-7感染A549细胞后2、6 h,与非感染Mock infection组比较,炎症因子IL-8随时间延长释放增加(<0.0001,图3);且HAdV-7感染后较HAdV-3产生更高水平IL-8。siRNA干扰CD46后降低HAdV-3、HAdV-7 感染诱导的IL-8 释放(<0.0001,图3A、B)。同时,转染siRNA-DSG2 后,IL-8 的产生也明显下降(<0.0001,图3C、D)。
3 讨论
人腺病毒是儿童呼吸道感染最常见的病毒病原之一,而3、7型腺病毒通常与重症感染和严重暴发有关。腺病毒纤毛蛋白与其受体结合启动了病毒感染靶细胞的过程,B亚属的3、7型腺病毒主要是纤毛蛋白通过与受体CD46、DSG2 结合作用进入宿主细胞。课题组前期研究发现HAdV-7和HAdV-3基因序列差异主要在纤毛蛋白上。为此,本研究从病毒与受体结合角度进一步探讨沉默受体CD46、DSG2对3、7型腺病毒感染的影响。
免疫荧光实验结果显示在腺病毒感染早期,HAdV-3、HAdV-7与其主要粘附受体CD46、DSG-2结合后,腺病毒在胞浆、胞核共定位均增加,胞浆尤为明显,表明HAdV-3、HAdV-7 与细胞表面受体CD46、DSG-2结合是腺病毒内化的关键步骤。由于病毒受体不存在变异的特性,阻断宿主细胞受体与病毒的结合以及抑制病毒蛋白的入胞可能是一个有效的治疗靶点。在其他病毒研究中发现,连花清瘟可能通过阻断病毒与宿主受体结合发挥抗病毒作用;CXCR 拮抗剂Plerixafor(AMD3100)能够阻断HIV 与其共受体CXCR4相互作用而抑制HIV感染;抗精神病药物,尤其是吩噻嗪类药物,可以显著阻断SARS-CoV-2 与ACE2的结合可能是防治SARS-CoV-2感染的有效药物。本研究通过特异性的siRNA干扰实验,有效沉默A549细胞膜表面的受体CD46、DSG2后感染HAdV-3、HAdV-7,研究显示无论是使用siRNA-CD46 还是siRNA-DSG2 后,腺病毒拷贝数较沉默前均明显下降,结果说明siRNA-CD46、siRNA-DSG2 有效阻断HAdV-3、HAdV-7 与其受体结合,从而使病毒入胞减少。腺病毒感染靶细胞同时还启动了炎症反应,在某些情况下,过度的细胞因子释放,如IL-6、IL-8或TNF-α,可引起严重的全身炎症反应甚至多器官功能障碍。本研究中,HAdV-3、HAdV-7感染A549细胞后,病毒拷贝数及IL-8 的产生明显增加,且HAdV-7 感染后在A549中病毒拷贝数及IL-8的水平高于HAdV-3,这与我们前期发现HAdV-7比HAdV-3感染更易引起重症肺炎和严重的细胞因子反应及研究报道的HAdV-7感染人支气管上皮细胞系BEAS-2B细胞诱导产生的IL-8比HAdV-3多一致。本研究发现沉默CD46、DSG2后能够显著抑制HAdV-3、HAdV-7诱导的IL-8产生;另外,沉默CD46、DSG2后,HAdV-7干扰组产生IL-8水平仍较HAdV-3 干扰组高,这一结果可能有助于解释HAdV-7感染后病情重于HAdV-3感染这一临床现象。
目前关于腺病毒的研究中临床研究占大多数,对于其基础实验的研究报道较少,以往对抗腺病毒的研究主要在对腺病毒早期基因和晚期基因的干扰方面,而腺病毒与受体结合是感染的第一步,针对病毒进入的抗病毒药物可以从源头上防止病毒感染细胞,而且还避免了细胞内药物输送的需要,防止腺病毒与受体结合可以有效阻止病毒感染、细胞损伤和后续的细胞因子释放。本研究通过A549细胞系实验,证明阻断腺病毒结合的受体从而阻止病毒进入细胞并降低炎症因子的产生,由此,可针对siRNA或者其他分子干预阻断腺病毒与宿主细胞的结合设计抗腺病毒药物;同时,病毒蛋白中的受体结合区相对不变,也可以对其设计或改进疫苗作为预防感染的靶点。然而,这些防治方法亟需我们更深入地了解病毒与受体的相互作用机制,包括确定复杂的蛋白质结构等仍待深入研究。此外,缺乏体内实验也是本研究的局限性之一,这主要是由于人腺病毒感染宿主具有高度的种属特异性,只能在自然宿主细胞中进行有效复制,而人腺病毒的复制和表达在其他种属细胞中往往受到限制。故缺乏可支持腺病毒感染/致病的动物模型也是抗腺病毒药物研究及致病机制研究进展缓慢的主要原因之一。近年来有中国树鼩以及一些人类细胞、组织和干细胞人源化小鼠作为允许感染动物模型进行人腺病毒相关研究。本课题组也在积极构建人源化CD46小鼠肺部感染模型,本实验结果仍待运用动物模型进一步验证。
1.针对人员分工控制不合理,对于物资采购和验收这两个岗位,要建立岗位责任制,采购人员的具体工作,采购人员和用户的责任和权利,保护学校和设备用户的权益。
综上所述,本研究通过体外实验证明沉默CD46、DSG2表达后阻断了HAdV-3、HAdV-7的病毒侵入以及感染诱导的IL-8释放,以期为选择抗病毒药物靶点、设计新型疫苗提供参考思路。