DNAM-1通过IL-2/STAT-5通路调节I型调节性T细胞的增殖和功能
2022-10-02王一晗姜朋涛吕明华胡志芳
Ⅰ型调节性T细胞(Tr1 cell)在免疫应答负调控和维持机体免疫耐受中发挥重要作用,是CD4T细胞的一类特殊细胞亚群,此类细胞诱导形成于外周免疫器官,以共表达CD49b和LAG-3、高水平分泌抑制性细胞因子白细胞介素(IL)-10、不表达调节性T 细胞(Treg)特异性转录因子叉头盒蛋白3 转录因子P3(Foxp3)为主要特点,此外,Tr1细胞免疫抑制功能也与颗粒酶B(GZMB)和转化生长因子-β1(TGF-β1)的分泌相关,其数量降低或功能异常与肿瘤、自身免疫性疾病、感染和移植排斥反应等多种疾病发生密切相关。
黏附分子DNAM-1分子(CD226)组成性表达于多种免疫细胞表面,为Tr1细胞重要表面标记分子之一,DNAM-1与配体CD155和CD112相互作用介导T细胞的分化和活化、NK细胞的杀伤、血小板的活化聚集、单核巨噬细胞与内皮细胞的粘附等多种免疫活动。研究表明DNAM-1可通过活化自身反应性T淋巴细胞、抑制Treg的活化增殖参与多种自身免疫性疾病发生发展,且证实了阻断DNAM-1对于移植后免疫耐受重建和治疗自身免疫性疾病具有重要意义。有研究证实DNAM-1高表达于人Tr1细胞上,Tr1 细胞杀伤活性依赖于DNAM-1分子的参与,表达于Tr1细胞的DNAM-1与表达于骨髓细胞上的配体CD155的特异性结合介导了Tr1 细胞激活和脱颗粒,可见DNAM-1对于Tr1 细胞细胞毒性靶标特异性是十分必要的,但DNAM-1是否参与Tr1细胞的分化、增殖和抑制功能却未见报道。本课题组前期实验发现应用单克隆抗体阻断DNAM-1或敲除小鼠DNAM-1后,CD4T细胞分泌IL-10明显升高,推测DNAM-1影响Tr1细胞生物学功能。IL-2/信号传导及转录激活蛋白(STAT)-5是控制CD4T细胞亚群分化和增殖的重要信号通路,DNAM-1是否通过影响IL-2/STAT-5通路参与Tr1细胞分化和增殖尚不明确。因此,本研究利用DNAM-1基因敲除小鼠(KO小鼠),通过Tr1 细胞分离技术或体外诱导技术,探讨DNAM-1分子对Tr1细胞分化、增殖和功能的影响及其相关分子机制。
1 材料和方法
1.1 实验动物
SPF级野生型(WT)C57BL/6小鼠(第四军医大学实验动物中心),6~8周龄,体质量18~22 g。SPF级纯合子DNAM-1 KO 小鼠(背景为C57BL/6,南京大学),SPF级动物房内饲养并将WT小鼠与纯合子DNAM-1 KO小鼠合笼从而获得Dnam-1F1代杂合子小鼠,随后继续在F1代小鼠间合笼以获得F2代小鼠,通过鼠尾DNA基因鉴定筛选出DNAM-1 KO小鼠为本实验所用,所有动物实验操作均已通过本校动物实验伦理审批(审批编号:NO.XJYYLL-20144433)。
经改造的对辊粉碎机生产的玉米与配合料的粒度达到蛋鸡理想粒度,有效减少原料粒度差异,混合更均匀,提高营养利用率,避免挑食,提供均衡营养。采用本生产工艺的蛋鸡料,能够显著地提高蛋鸡养殖效果和养殖效率,从而能够提高养鸡场的收益。
1.2 主要试剂
小鼠淋巴细胞分离液(达科为),LEAFTM Purified anti-mouse CD28(Biolegend),LEAFPurified antimouse CD3ε(Biolegend),MojosortMouse CD4T细胞磁珠分离试剂盒(Biolegend),新生牛血清(Gibco),红细胞裂解液(Sigma),Cell Activation Cocktail(with Brefeldin A)(Biolegend)RPMI 1640 培养基(HyClone),Percp anti-mouse CD4(Biolegend),APC anti-mouse DNAM-1(Biolegend),FITC anti-mouse CD49b,DNA Marker(Takara),琼脂糖(Biowest),PE anti-mouse LAG-3(Biolegend),APC anti-mouse CD25(Biolegend),PE anti-mouse p-STAT5(eBioscience),PE anti-mouse IL-10(Biolegend),Fixation/Permeabilization Dilulent(Biolegend),Permeabilization Buffer(Biolegend),CFSE cell division tracker kit(Biolegend),Recombinant TGF-β1(PeproTech),Recombinant IL-2(Biolegend),Recombinant IL-27(Biolegend),RNAiso Plus(TaKaRa),MACS separation buffer(Miltenyi Biotec),反转录试剂盒(Takara),qRT-PCR反应试剂盒(Takara)。
1.3 研究方法
对于矿工而言,如果不存在奖励(贿赂)的情况下,是否添加攻击者进行的交易获得的奖励是相同的,因此攻击者在步骤3只需要较少奖励即可诱使矿工在主链中不加入这笔交易。攻击者在整个攻击过程中,只需要贿赂金额小于商品金额即可攻击成功。
1.3.4 流式细胞术检测胞内分子 检测Tr1细胞胞内磷酸化的信号传导及转录激活蛋白(p-STAT5)表达水平,首先将收集的Tr1 细胞培养于含10% FBS 的RPMI 1640 培养液中,在37 ℃细胞培养箱中静置1 h后,按照实验需求给予IL-2刺激(5 ng/mL或10 ng/mL)30 min,收集细胞,按照1.3.1方法完成胞膜分子染色后进行固定和破膜,加入荧光标记抗体PE anti-mouse p-STAT5进行胞内分子染色,室温避光孵育20 min后洗涤悬浮,流式细胞术上机检测后应用FlowJo 软件进行分析。
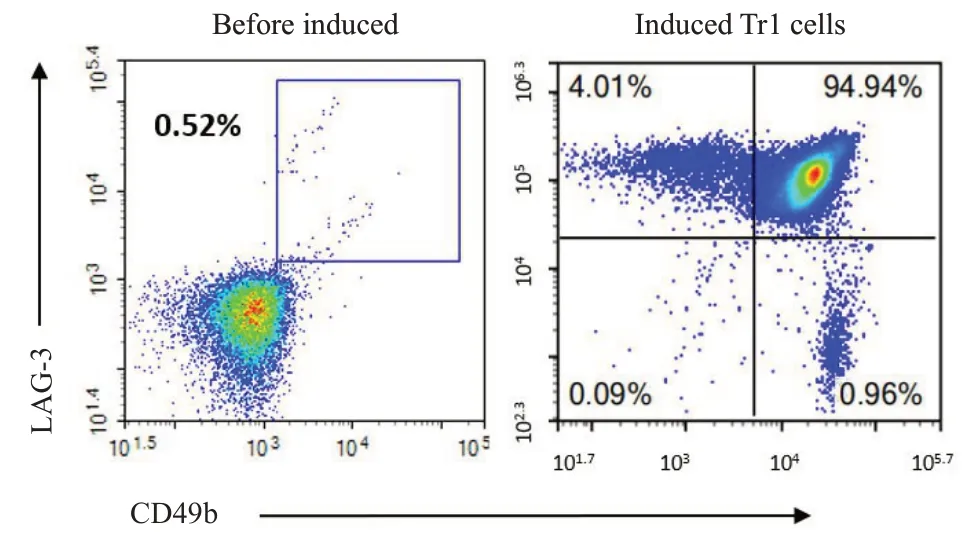
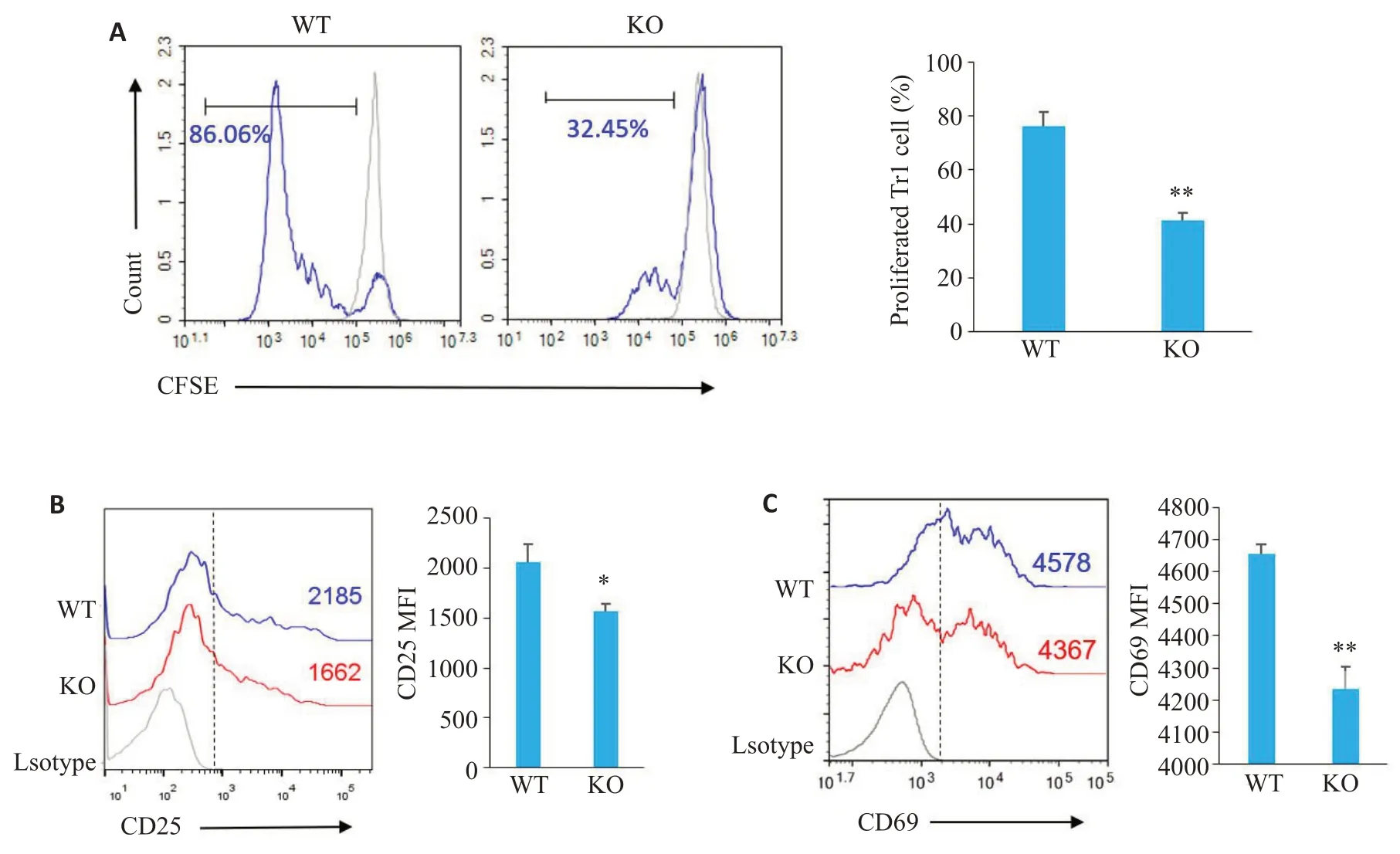
分离WT 小鼠和KO 小鼠脾脏初始CD4T 细胞(纯度≥95%,图3),在体外环境下诱导Tr1细胞(纯度≥90%,图4),使用CFSE工作液(5 μmol/L)标记诱导型Tr1细胞,活化增殖3 d后流式细胞术检测其增殖能力。FlowJo软件分析Tr1细胞增殖结果显示:与WT小鼠相比,KO 小鼠Tr1 细胞增殖比例明显降低(41.16%±3.08%76.21%±5.12%,<0.01,图5A)。为明确DNAM-1分子敲除之后是否影响Tr1细胞的活化功能,我们检测了两组小鼠Tr1 细胞CD25 和CD69 表达水平。结果显示WT小鼠Tr1细胞CD25分子MFI值为2057±185.1,KO 小鼠Tr1 细胞表达量降低,为1566±71.7,差异具有统计学意义(<0.01);WT小鼠Tr1细胞CD69分子MFI值为4656±28.27,KO小鼠Tr1细胞表达量降低(4234±69.34),差异具有统计学意义(<0.01)。
1.3.3 流式细胞术检测胞膜分子和检测胞内细胞因子根据实验需要,收集脾脏单个核细胞或体外诱导获得的Tr1细胞,将每管细胞数调整为(1.0~1.2)×10,150 μL PBS重悬细胞;按照说明书推荐剂量加入相应的细胞膜分子流式抗体:Percp anti-mouse CD4、FITC anti-mouse CD49b、PE anti-mouse LAG-3、APC antimouse DNAM-1,4 ℃放置30 min;加入流式细胞术缓冲液重悬后离心洗剂两次,加入固定液重悬细胞,流式细胞仪(ACEANovoCyte 3130)检测。
胞内细胞因子检测按以下流程操作:收集待检测细胞,加入Cell Activation Cocktail(with Brefeldin A)(1×10细胞加入1 μL)刺激6 h,按照实验需要在刺激过程中选择加入或不加IL-2(5 ng/mL),刺激完成后PBS重悬后离心、弃上清、胞膜分子染色,每管加入500 μLFixation缓冲液固定细胞25 min,加入Permeabilization 洗涤缓冲液2 mL重悬细胞破膜,在细胞中加入荧光标记抗体PE anti-mouse IL-10进行胞内细胞因子染色,室温避光孵育20 min后Permeabilization 洗涤缓冲液重悬细胞并离心,加入固定液以重悬细胞上机检测。
流式细胞术分别检测脾脏总CD4T细胞和Tr1细胞(CD4CD49bLAG-3)刺激前和刺激后DNAM-1分子表达水平,结果显示静息状态CD4T 细胞表达DNAM-1比例为28.90%±1.10%;激活状态表达比例为43.03%±4.90%,激活状态的CD4T细胞表达DNAM-1水平升高(<0.05,图1A)。静息状态Tr1 细胞表达DNAM-1比例为35.25%±2.75%;激活状态表达比例为43.43%±1.16%,激活状态的Tr1细胞表达DNAM-1水平明显升高(<0.05,图1B)。
加点准则Cpof(·)选择在可行性概率最大的地方添加试验点,选取可行试验点的效率非常高。基于两目标约束应对策略和加点准则ISCbi的代理优化算法(称为EI-PoF算法)的具体流程如图1所示。
1.3.5 CFSE标记法检测Tr1细胞增殖能力 使用antimouse CD3(3 μg/mL)包被96孔U型细胞培养板,4 ℃冰箱中放置过夜;制备CFSE工作液(5 μmol/L)并重悬Tr1细胞,使细胞密度大于1×10/mL,置于37 ℃细胞培养箱中8 min后取出,加入等体积含20%胎牛血清的RPMI 1640培养液冰浴5 min以终止染色,在离心管中加入2倍体积以上的PBS充分洗涤染液,离心后加入含有10%胎牛血清的细胞培养基悬浮细胞,将细胞浓度调整至1×10/mL,加入anti-mouse CD28抗体(5 μg/mL)并加入到已包被的96孔细胞培养板中培养;培养1 d后即可观察到细胞培养板底有克隆团出现,3~5 d收集细胞,流式细胞术检测FITC通道的激发光信号,FlowJo软件分析细胞增殖能力。
检测佛波酯(PMA)和离子霉素混合物在加入或不加IL-2刺激前后,Tr1细胞分泌IL-10水平(图6A)。相比较静息状态,两组Tr1细胞在接受PMA/离子霉素刺激后,IL-10分泌水平升高(<0.0001);WT组在PMA/离子霉素和IL-2共同刺激后,IL-10分泌水平明显高于单纯PMA/离子霉素刺激(<0.01),而KO 组在接受PMA/离子霉素和IL-2共同刺激后,IL-10分泌水平与单纯PMA/离子霉素刺激相比无明显差异(>0.05)。分离两组小鼠Tr1细胞,提取RNA后检测发现KO 小鼠Tr1细胞Il-10 mRNA和Gzmb mRNA表达水平均低于WT小鼠(图6B、C)。
1.3.1 分离小鼠脾脏单个核细胞 脱颈处死小鼠,无菌条件下取出脾脏置于200目筛网上并剪碎,加入小鼠淋巴细胞分离液进行研磨,收集研磨液并在液面上缓慢加入0.5~1 mL RPMI 1640培养基,800×离心30 min,吸取白膜层细胞,加入红细胞裂解液裂解5 min,重悬、300×离心5 min、弃除上清,重复操作充分洗涤细胞;细胞计数后待用。

1.4 统计学分析
应用GraphPad Prism 6.0软件进行数据统计学分析,定量资料以均数±标准差表示,组间比较采用独立样本检验,<0.05为差异具有统计学意义。
2 结果
2.1 激活状态CD4+T细胞和Tr1细胞高表达DNAM-1
In March of 2014,when Russia annexed Crimea into its territory,the EU announced economic and diplomatic sanctions on Russia,which included restrictions to the energy exploiting technologies,equipment and services,as well as the restrictions to financial services on Russian companies and banks.

2.2 敲除DNAM-1不影响小鼠Tr1细胞数量和比例
流式细胞术鉴定KO小鼠脾脏CD4T细胞和Tr1细胞表达DNAM-1情况结果显示:KO小鼠基本不表达DNAM-1 分子(图2A),基因敲除小鼠构建成功。以CD4CD49bLAG-3为Tr1细胞鉴定表型,检测KO小鼠和同窝WT 小鼠脾脏Tr1 细胞比例和数量,结果显示KO小鼠Tr1细胞比例和数量无明显改变(>0.05,图2B)。
③Seymour M.Lipset,American Exceptionalism:A double-edged Sword,New York:W.W.North and Company,1996,p.31.

2.3 敲除DNAM-1后Tr1细胞活化和增殖能力降低
1.3.2 体外诱导Tr1细胞 PBS稀释anti-mouse CD3抗体至3 μg/mL,按照100 μL/孔加入到96孔U型细胞培养板中,4 ℃过夜。分离脾脏单个核细胞悬液并计数,300×离心5 min 后弃上清,使用MojosortMouse CD4 Naïve T Cell Isolation Kit 分离小鼠脾脏初始CD4T细胞(naïve CD4T cell,Tn)并计数,使用流术细胞术鉴定细胞纯度,本实验所用Tn细胞纯度≥95%。在Tn细胞中加入含有10%胎牛血清的RPMI 1640 培养基培养,依次加入anti-mouse CD28(5 μg/mL)、TGF-β1(5 ng/mL)、IL-27(30 ng/mL)和IL-2(2 ng/mL)刺激培养;培养1 d后可观察到培养板底出现细胞克隆团,培养3 d后收集细胞待用。

2.4 敲除DNAM-1降低小鼠Tr1细胞抑制性免疫分子分泌水平
1.3.6 qRT-PCR检测 Trizol法提取RNA,吸出RNA溶液1 μL,使用微量核酸蛋白浓度测定仪(NanoDrop)检测RNA溶液浓度,保证实验所用RNA/比值在1.8~2.0。按照Takara反转录试剂盒操作进行操作,反转录条件:37 ℃15 min,85 ℃5 s,4 ℃不限时,cDNA产物保存于-20 ℃。使用Primer Premier 5.0软件进行引物设计,引物委托上海生工生物公司合成,引物序列见表1。按照Takara qRT-PCR反应试剂盒操作说明进行qRT-PCR操作,cDNA 1 μL,Forward Primer 0.5 μL,Reverse Primer 0.5 μL,SYBR Premix Ex Taq Ⅱ5 μL,ddHO 3 μL,总量10 μL,设置3个复孔,使用实时定量PCR仪(Bio-Rad CFX96)进行扩增反应,条件为:95 ℃预变性5 min,95 ℃变性10 s,60 ℃退火30 s,共35个循环;以Gapdh作为内参照,使用GraphPad Prism统计软件进行数据分析并绘制统计图表。

2.5 敲除DNAM-1分子通过抑制IL-2/STAT-5通路影响Tr1细胞功能
分别用5 ng/mL和10 ng/mL IL-2刺激WT 小鼠和KO小鼠Tr1 细胞30 min,流式细胞术检测p-STAT5表达水平,结果显示5 ng/mL IL-2刺激后,WT小鼠Tr1 细胞p-STAT5表达水平(6.42±0.53)%高于KO小鼠Tr1细胞表达水平(3.63±0.65)%,差异有统计学意义(<0.05);10 ng/mL IL-2 刺激后,WT 小鼠Tr1 细胞p-STAT5表达水平(7.36±0.30)%高于KO小鼠Tr1 细胞表达水平(4.46±0.59)%,差异有统计学意义(<0.05,图7)。

3 讨论
Tr1细胞是一类具有免疫抑制功能的CD4T细胞亚群,在维持自身免疫耐受和抑制病理性免疫应答反应中发挥的重要作用,多种跨膜免疫分子参与Tr1细胞活化和增殖过程。DNAM-1为T细胞活化共刺激分子,其与LFA-1交联参与T细胞激活免疫突触形成和活化信号转导,研究表明DNAM-1高表达于Tr1细胞上并被视为Tr1 细胞标志性分子,本研究旨在探明DNAM-1是否参与Tr1细胞分化、增殖和抑制功能。
在旅游服务类,洪江古商城的实景表演、导游讲解及古装拍照增加旅游体验的趣味性与知识性。黔阳古城的风味小吃,如春卷、绿豆粉是其显著特色。高椅古村傩堂戏、黑米等特色民俗和物产为旅游者带来新鲜体验。荆坪古村的农家乐、棋牌娱乐活动丰富了旅游者旅游体验。
DNAM-1分子高表达于激活状态的CD4T细胞,并参与Th细胞亚群的分化和增殖过程。研究表明DNAM-1与淋巴细胞功能相关抗原(LFA)-1共同参与T细胞活化信号转导过程,并在T活化状态的淋巴细胞中表达上调。本课题组在前期发现激活状态CD4T细胞和Tr1细胞DNAM-1分子MFI值升高,DNAM-1分子参与调节性T细胞分化增殖过程。本研究发现DNAM-1分子在激活状态的CD4T细胞和Tr1细胞中表达升高,此结果与文献报道的DNAM-1高表达于激活状态的效应性T细胞并促进T细胞的活化过程相一致。CD25为IL-2受体(IL-2R)α亚单位,主要表达于激活状态的T细胞和调节性T细胞;细胞活化标记分子CD69 是T 细胞激活后最早表达的膜表面分子之一。我们发现缺少DNAM-1的Tr1细胞体外增殖能力降低,细胞活化标记分子CD96和CD25表达降低,此结果说明DNAM-1参与了Tr1细胞的活化和增殖过程,文献报道DNAM-1 参与CD4初始T 细胞的发育和分化过程,并促进Th1细胞的极化而抑制Th2细胞极化,本结果为补充DNAM-1参与Tr1细胞这一特殊CD4+T细胞亚群活化和增殖过程提供依据。为明确DNAM-1是否参与Tr1细胞的免疫功能,我们检测了KO小鼠Tr1细胞分泌IL-10和表达Gzmb情况,结果表明Tr1细胞DNAM-1分子缺如后,其抑制性细胞因子IL-10分泌水平和与细胞毒作用效应分子Gzmb表达均降低,这些结果虽为明确DNAM-1分子参与Tr1细胞功能提供了重要依据,但相关分子机制并不清楚。
Tr1细胞分化、发育和抑制功能与细胞因子信号密切相关。研究表明IL-2在促进T细胞活化和调控T细胞亚群分化中发挥重要作用,其可通过调控细胞因子受体、转录因子、染色质调节因子和效应性细胞因子影响T细胞转录命运和代谢过程。在IL-2信号刺激下,IL-2R与JAK酪氨酸激酶偶联继而激活STAT5等转录因子,以调节CD4T细胞的分化,参与CD4T细胞的激活、分化增殖和功能发挥。近年有研究结果表明IL-2促进Tr1细胞的分化与增殖过程,考虑到本实验中使用IL-2刺激后,KO小鼠Tr1细胞IL-10低分泌水平并未逆转,分析敲除DNAM-1可能影响了Tr1细胞的IL-2通路的下游胞内信号转导。为证实此推测,本研究进一步检测了IL-2刺激后Tr1细胞内p-STAT5变化,发现KO小鼠Tr1细胞p-STAT5表达水平低于WT小鼠Tr1细胞。由上述结果分析可知DNAM-1通过调控IL-2/STAT5通路参与Tr1细胞分化和功能,但其分子水平调控机制和交互作用尚需进一步研究和明确。
综上所述,DNAM-1分子参与Tr1细胞的活化、增殖和抑制功能,敲除DNAM-1分子影响Tr1细胞的活化水平、抑制体外增殖能力和分泌效应性免疫分子的能力,此调控作用可能是通过参与IL-2/STAT-5信号通路来实现的。在后期实验中,我们将继续探明DNAM-1分子参与Tr1细胞增殖和功能相关分子机制,为靶向DNAM-1分子治疗自身免疫性疾病等临床疾病提供理论与实验依据。