渤海自由生活海洋线虫体型特征及生物量谱❋
2022-09-30郭嘉宇刘晓收
郭嘉宇,何 蕾,刘晓收,2,华 尔❋❋
(1.中国海洋大学海洋生命学院,山东 青岛 266003;2.中国海洋大学海洋生物多样性与进化研究所,山东 青岛 266003)
自由生活海洋线虫(以下简称海洋线虫)是海洋中最丰富的后生动物类群,属于小型底栖动物的永久性成员。海洋线虫是底栖细菌、微藻的主要消费者,也是沉积物有机碎屑的分解者,是底栖生态系统食物网的重要环节[1]。海洋线虫身体外形通常细长且呈圆柱状,头部和尾部略尖,形态模式易于识别。然而,线虫众多的物种表现出非常广泛的形态适应范围,特别是其个体大小对不同环境的适应具有显著差异[2-6]。生物个体大小是一个重要的功能特征,它决定了各种生物学和生理过程,包括代谢速率、对化学胁迫/干扰的耐受性、移动或迁移的能力和对捕食的易受性[7-8]。此外,按照个体大小将生物划分为不同粒级进行群落生物量谱分析,通常可以提供关于能量流动方面的生态系统功能信息,可以促进对生态系统过程和功能的理解[9-10]。因此,线虫体型特征及生物量谱已成为描述其功能多样性和比较不同群落生态功能的有利工具[3,6,11-14]。
渤海位于中国大陆东岸,是中国最北端的一个半封闭的海域,通过渤海海峡与黄海相连。渤海地处北温带,夏季盛行东南风,天气炎热而多雨,平均海面温度为26.1 ℃;冬季以西北风为主,寒冷而干燥,平均海绵高度为0.4 ℃[15-16]。渤海具有重要的渔业价值,是多种鱼、虾、蟹和贝类栖息、生长发育、繁殖的良好场所,但也一直是中国受干扰最严重的海洋生态系统之一。渤海沿岸江河纵横,有、大小河流40余条,向渤海输入了大量的淡水、泥沙和污染物[16]。受河流排放和陆源污染的影响,渤海环境因子多表现为从近岸向离岸区域的显著变化[17-18]。
中国海域小型底栖动物研究最早始于渤海。在过去的40年里,渤海海洋小型底栖动物(包括海洋线虫)研究内容包括形态分类学、生物学及生态学研究。早期的研究主要以小型底栖动物的传统形态分类、数量和分布特征为主[19-20],其后的工作加强了小型底栖动物群落特征和多样性格局、时空变化规律及主要影响因子的分析[21-30]。近年来,小型底栖动物研究的重点逐渐发生转移,利用小型底栖动物(特别是海洋线虫)评价底栖生态系统健康状况,指示环境变化或人为扰动,已引起研究人员的高度重视[33-38]。已有研究显示,渤海海域海洋线虫群落分布及多样性特征受水深、盐度、沉积物粒度特征、含水率、有机质含量和叶绿素浓度等环境因素的影响,同时也受陆源污染物、重金属、扰动等人为因素的影响[20-24,27,31,39]。然而,对渤海海洋线虫体型及生物量谱特征的研究并不多见。郭玉清等[28]的研究测量了渤海12种海洋线虫优势种成体的体长和体宽,并在此基础上计算了线虫个体干质量,发现海洋线虫的个体干质量变化范围很大(0.06~2.08 μg),表明海洋线虫个体大小对渤海环境异质性具有适应性变化。此外,底栖动物生物量谱研究显示,渤海海洋线虫生物量谱波峰出现在-1粒级(平均干质量约为0.5 μg),其波峰位置相对于北黄海海洋线虫生物量谱波峰偏右,但较南黄海海洋线虫生物量谱波峰则偏左[40]。波峰出现的位置与沉积物物理扰动频率及环境状况有关[3,41]。由此推测,个体干质量及生物量谱特征的变化可能是渤海海洋线虫对环境变化响应的重要方面之一。但是,由于渤海海洋线虫个体大小或生物量谱的研究均有限,因此对海洋线虫从体型到生物量谱特征对渤海环境变化响应的认识仍有待深化。
本研究通过渤海中部13个站位海洋线虫个体体长、体宽的实际测量,分析海洋线虫体型特征,构建线虫群落生物量谱,分析线虫体型特征和生物量谱与渤海环境因素的相关关系。本研究目的是:(1)了解渤海海洋线虫体型及群落生物量谱特征是否存在空间差异;(2)探析影响海洋线虫体型及生物量谱特征的主要因素。本研究结果可以为海洋线虫群落对渤海环境变化的响应机制研究提供数据支持。海洋线虫个体大小及生物量谱提供的生态系统功能信息,将有利于准确评估海洋线虫在渤海海洋生态系统中的功能和作用。
1 材料与方法
1.1 采样航次与站位
研究样品由“东方红2号”科学考察船于2014年11月采自渤海中部13个站位(37°N—40°N,118°E—121°E),站位分布如图1所示。

图1 采样站位分布图
1.2 样品的采集
使用0.1 m2改进型Gray-O’Hara箱式采泥器进行采样,每个站位重复取样3次。在甲板上,利用由注射器改装的内径为2.9 cm的取样管从每一箱沉积物中采集一个芯样(芯样深度为8 cm),共获得3个重复芯样,用5%甲醛溶液进行固定。另外,每个站位再分别用相同的取样管采集2个重复芯样,装入封口袋,-20 ℃冷冻保存,带回实验室进行沉积物粒度特征、有机质含量以及叶绿素浓度分析。水深(WD)、底层水温度(简称底温)、底层水盐度(简称底盐)数据等由温盐深仪(CTD)现场测定。
1.3 室内分析及测定
海洋线虫的分选:在实验室,用虎红染液(0.1 g虎红染料溶于100 mL 5%甲醛溶液)对采集的沉积物样品进行染色。静置染色24~48 h后,利用0.5和0.031 mm孔径网筛过滤沉积物,0.5 mm孔径网筛用以去除大型底栖动物和砂砾。利用硅溶胶(Ludox-TM,相对密度为1.13 g/cm3)离心漂浮法对截留于0.031 mm孔径网筛的沉积物离心。离心3次,收集上清液,用自来水冲洗后,解剖镜下分选获得海洋线虫标本。分选获得的海洋线虫经酒精甘油(50%酒精∶甘油=9∶1)处理透明后,制成永久封片[42]。
环境因子的测定:利用Master Sizer 3000型激光粒度仪分析沉积物粒度特征。计算沉积物砂、粉砂、黏土的比例,以及累积50%对应的中值粒径(Md,μm)[42]。K2Cr2O7-H2SO4氧化法测定沉积物有机质含量(OM)[43]。利用荧光分光光度法,采用王荣[44]的修正公式,测定并计算沉积物叶绿素a(Chl-a)和脱镁叶绿酸a(Pheo-a)浓度。
1.4 海洋线虫体型特征指标及生物量谱
海洋线虫的测量及体型分类:利用AJ-VERT显微测量软件对每一条海洋线虫的体长(L,单位为μm)、体宽(即最大体宽,W,单位为μm)进行测量,计算体长-体宽比值(L/W),作为海洋线虫体型特征指标[4-5]。同时,将线虫按体长分为3组:体长不长于第一四分位数(≤Q1)归类为“短”;体长在第一和第三四分位数之间(Q1~Q3)归类为“中等”;体长不短于第三四分位数(≥Q3)归类为“长”[45]。将线虫按体宽同理分为“细”(≤Q1)、“中等”(Q1~Q3)和“粗”(≥Q3)三类[45]。
生物量谱绘制:通过公式
DW=530×L×W2×1.13×0.25[42,46]
计算得每条线虫的干质量(DW)。将个体干质量以log2转换为个体粒级,根据大小,线虫归入不同粒级。以粒级(即log2转换的个体干质量)为横坐标,以各粒级总生物量(单位为μg/10 cm2)为纵坐标,绘制生物量谱[40]。
1.5 数据处理与分析
应用Ocean Data View(ODV v5.3.0)绘制采样站位图。利用IBM SPSS Statistics 20.0(IBM Corp., Armonk, NY, USA)软件进行环境因子、海洋线虫体长、体宽等观测变量的One-way ANOVA差异检验。
利用PRIMER v7软件对生物数据及环境数据进行多元分析[47]。对环境因子计算欧氏距离矩阵,并进行主坐标分析(Principal coordinates,PCO),评估各站位间环境特征的总体差异。线虫生物量组成数据进行四次方根转换,计算Bray-Curtis相似性矩阵。在相似性矩阵基础上进行非度量多维标度排序(Non-metric Multi-dimensional scaling, nMDS)以及SIMPROF检验(在5%的显著性水平),识别不同的站位组。利用PERMANOVA附加软件包,进行置换多元方差分析(Permutational multivariate analysis of variance,PERMANOVA),检验参数在各站位组之间的差异;进行分散均匀性检验(Tests of homogeneity of dispersions,PERMDISP),确定显著的PERMANOVA结果是否由样品在组内分散的不均匀性引起。应用基于距离的线性模型(Distance-based linear models,DISTLM)分析环境变量与线虫体型特征及生物量谱组成之间的关系[48]。DISTLM模型的构建基于欧氏距离矩阵(由单变量指数导出)和Bray-Curtis相似性系数(由线虫丰度导出),采用前进(Forward)选择程序,以调整后的R2评估模型拟合的优度。
2 结果
2.1 沉积环境特点
研究海域13个站位环境因子结果见表1。13个站位平均水深(WD)为(23±6)m,B53站位水深值最大(35 m),B68站位水深值最小(13 m)。各站位底温差异较小,平均温度为(12.4±0.6)℃。底盐变化也不明显,平均值为30.5±0.5,最大值出现在B53站位,最小值在B68站位。多数研究站位沉积物以黏土质粉砂为主,局部站位为粉砂质砂(B49、B51、B53)、粉砂(B70)、砂质粉砂(B41)和砂-粉砂-黏土(B50)。其中,B47站位粉砂黏土含量最高,达到99.6%;B49站位粉砂黏土含量最低,仅为39.3%。沉积物平均含水率为(38.8±7.1)%,B45和B62站沉积物含水率较低(<30%),B47含水率最高(53.4%)。B70站位Chl-a浓度最高,达到0.766 μg/g,B50站位Pheo-a浓度最高(3.553 μg/g)。B47站位Chl-a浓度最低(0.074 μg/g),且Pheo-a浓度也最低(0.881 μg/g)。B50站位沉积物有机质含量最高,其值是最低值站位(B49站位)有机质含量的10倍,分别为2.35%与0.23%。
受测环境因子PCO分析结果显示,研究站位环境因子特征差异较大,2个主坐标(PCO轴)累计可解释环境变量的64.3%(见图2)。总的来讲,研究站位沿PCO1轴可分为二组:A组由B41、B43、B45、B47、B49、B50、B51、B53、B57、B62等10个站位组成;B组由近黄河口和莱州湾口的B66、B68、B70等3个站位组成(见图2)。与A组相比,B组站位水深浅,底温、底盐、沉积物中值粒径、有机质含量、Pheo-a浓度较低,但沉积物粉砂黏土含量、含水率和Chl-a浓度较高(见表1)。PERMANOVA结果显示,2个站位组的环境因子特征差异极显著(t=2.199 8,p=0.003)。水深、底盐、底温、Pheo-a及沉积物有机质含量与PCO1轴的相关性高,是引起两组环境特征差异的主要原因。
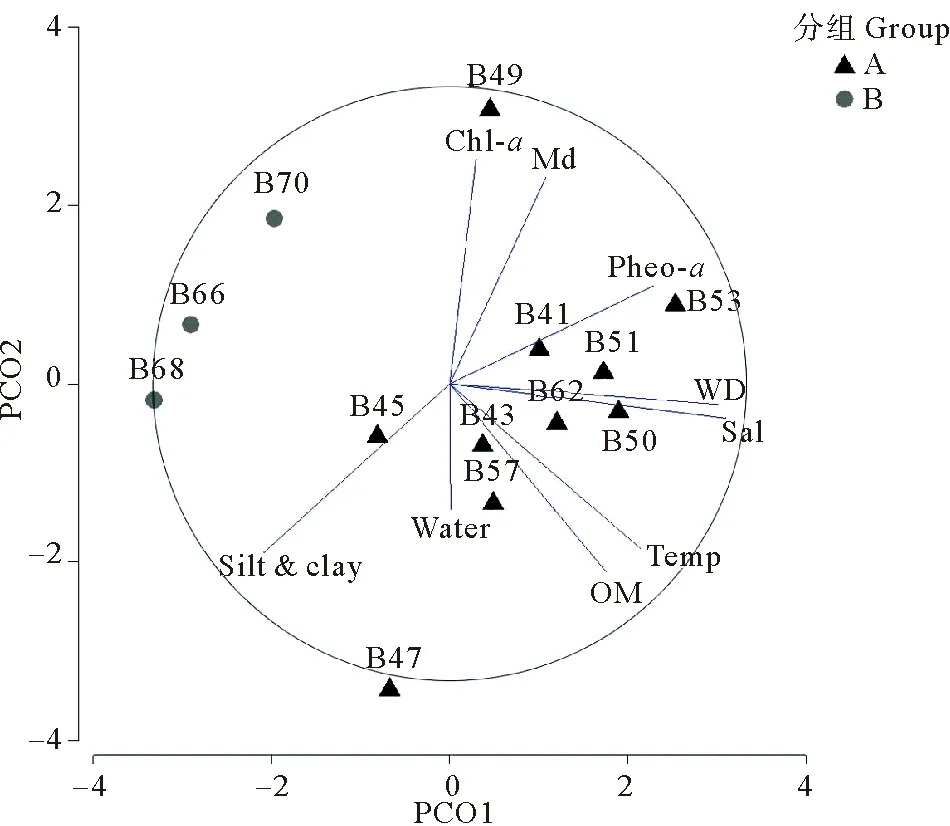
(WD:水深;Temp:底层水温度;Sal:底层水盐度;Chl-a:叶绿素a;Pheo-a:脱镁叶绿酸a;silt & clay:粉砂黏土含量;Md:中值粒径;Water:沉积物含水率;OM:有机质。黑色圆圈和蓝直线为叠加向量。向量长度反映了该变量与这两个特定主坐标轴的相关性。WD:Water depth; Temp: Bottom water temperature; Sal: Bottom water salinity; Chl-a: Chlorophyll-a; Pheo-a: Pheophytin-a; silt&clay%: Silt and clay content; Md: Sediment medium particle diameter; Water: water content; OM: Organic matter.Black circle and blue lines are superimposed vectors.Vectors are the raw Pearson correlations of variables with the PCO axes.)

表1 研究站位主要环境变量
2.2 海洋线虫体型指标及体型分组
总共测量了5 645条海洋线虫的体长和体宽,体长、体宽及体长-体宽比值(L/W)频数分布见图3。体长变化范围为109.1~2 814.3 μm,平均为(531.7±273.4)μm;体长<400 μm的线虫丰度占总丰度的39.0%,绝大多数线虫体长200~1 000 μm(96.3%)。体宽变化范围为3.0~65.9 μm,平均为(15.2±8.2)μm;体宽<10 μm的线虫丰度占总丰度的32.9%,96.4%线虫体宽5~35 μm。平均L/W值为(37.4±14.3),96.3%的线虫L/W值为18~72,1.2%的线虫L/W<18,2.5%的线虫L/W>72。根据环境因子划分的站位组,A组海洋线虫平均体长为(486.5±259.0)μm,平均体宽为(13.3±7.1)μm,平均L/W值为39.1±15.4;B组线虫平均体长为(648.7±274.8)μm,平均体宽为(20.4±8.6)μm,平均L/W为(33.1±9.6)。One-way ANOVA结果显示,线虫体长(F=430.255,p<0.001)、体宽(F=1 012.456,p<0.001)、和L/W(F=207.515,p<0.001)在2个站位组间存在极显著的差异。

图3 海洋线虫体长、体宽、L/W频数分布图
根据所测线虫个体体长数据,将线虫按体长分为3类:≤Q1(334.4 μm)为“短”,介于Q1和Q3之间为“中等”,≥Q3(662.2 μm)为“长”(见图4)。将线虫按体宽同理分为“细”(≤Q1,9.1 μm)、“中等”(Q1~Q3)和“粗”(≥Q3,19.3 μm)三类(见图4)。“短而细”的线虫约占线虫总数的15.3%,“长而粗”线虫占17.4%。A组中:短、细线虫所占比例高;“短而细”的线虫约占总数的20.7%;“长而粗”线虫占12.2%(见表2)。B组中:长、粗线虫所占比例高;“短而细”的线虫仅占线虫总数的1.2%;“长而粗”线虫占30.9%(见表2)。相对于A组,B组线虫更粗壮。

(每一个圆圈表示一个个体。Q1:第一四分位,Q3:第三四分位数。Each individual measurement is represented by 1 data point.Q1 indicates the first quartile and Q3 indicates the third quartile calculated for all data.)

表2 基于线虫体长和体宽值的体型分组及每组线虫的相对贡献
2.3 海洋线虫生物量谱
各研究站位线虫生物量谱表现不同,绝大多数站位表现为单峰型,部分站位(如B68和B53站位)表现为阶梯状递增型,生物量谱峰出现在-4~-2粒级(见图5)。根据环境因子划分的站位组,A组波峰出现在-4粒级,相应线虫生物量为(24.3±8.1)μg/10 cm2;B组(B66、B68、B70)波峰出现于-2粒级,相应线虫生物量为(25.5±4.4)μg/10 cm2(见图5)。nMDS排序结果及SIMPEROF结果显示,B66、B68、B70站位线虫生物量谱组成与其他站位存在差异(见图6)。PERMONOVA检验结果显示,线虫生物量谱组成在不同站位组间差异极显著(Pseudo-F=5.963 2,p=0.008)。根据PERMDISP结果,线虫生物量谱组内差异不显著(F=4.097 8,p=0.349),线虫生物量谱在每个站位组内分布相似,证明线虫生物量谱存在组间差异。

(横坐标为粒级,即log2个体干质量(μg),纵坐标为各粒级总生物量(μg/10 cm2);B组包含站位B66、B68、B70,A组含其他站位。X axis is the body size class, that is, log2 of organism’s individual dry weight(μg).Y axis is total biomass(μg/10 cm2)per body size class.Group B includes station B66, B68, B70; group A includes other study stations.)

图6 研究站位海洋线虫不同粒级生物量组成nMDS标序图
2.4 海洋线虫体型特征指标及生物量谱与环境因子的相关分析
基于受测环境因子的DISTLM分析结果,环境因子对线虫体长、体宽、L/W值及生物量谱特征具有重要影响(见表3)。海洋线虫体宽与底盐、有机质含量、Pheo-a和Chl-a浓度相关;体长与底温、Pheo-a、中值粒径和底盐相关;L/W值与沉积物粉砂黏土含量、有机质含量和含水率相关;线虫生物量谱特征则与底盐、底温、Pheo-a、粉砂黏土含量相关。其中:底盐对线虫体宽和生物量谱特征的影响显著;底温和Pheo-a对线虫体长的影响显著;粉砂黏土含量和有机质含量对L/W值的影响显著(见表3)。
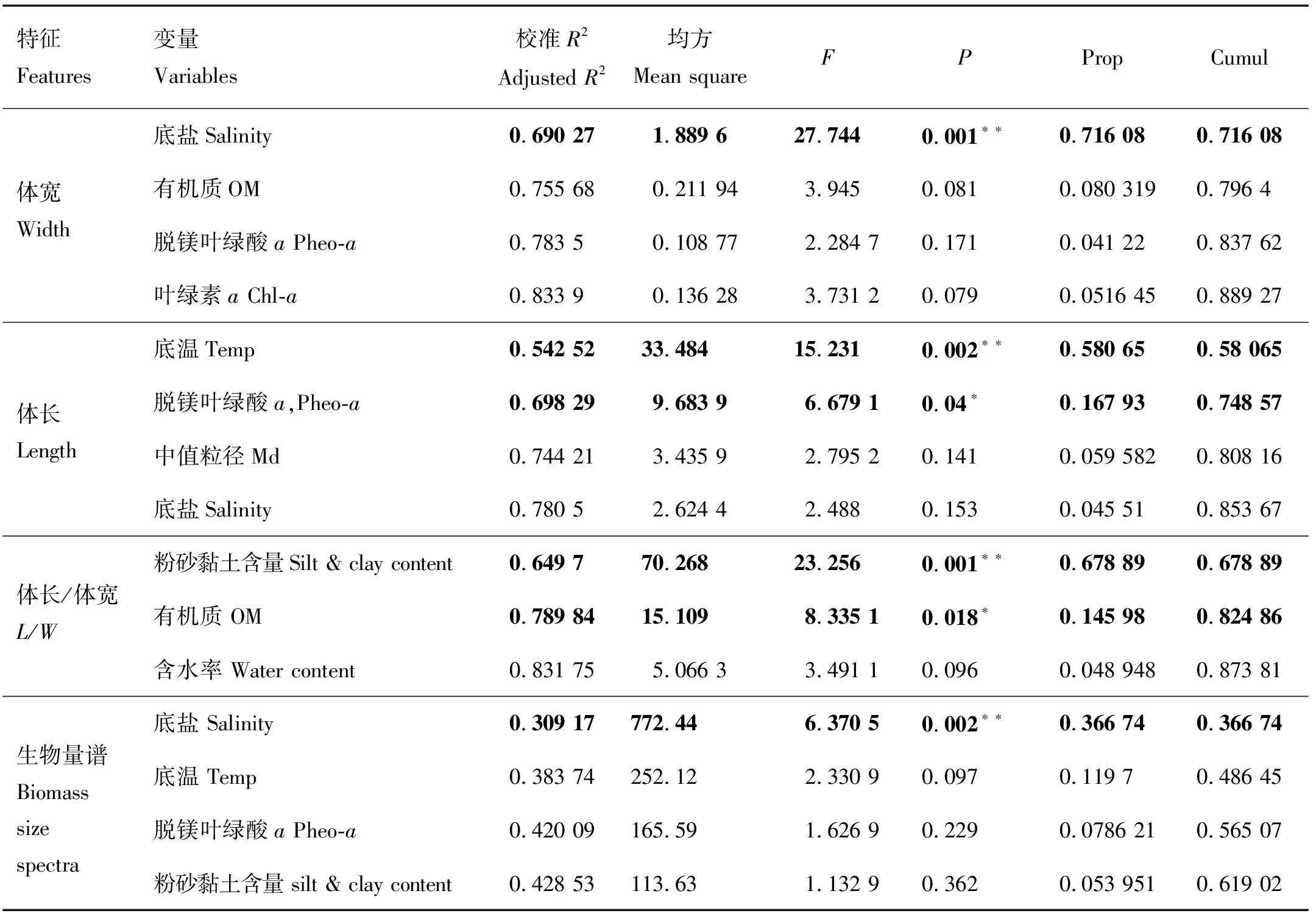
表3 海洋线虫体型特征及生物量谱DISTLM检验结果
3 讨论
本研究结果显示,渤海海洋线虫体长、体宽、L/W值、生物量谱结构均存在空间差异。与其他研究站位相比,近黄河口及莱州湾口站位的海洋线虫体长、体宽值较高,L/W值较低,海洋线虫生物量谱在更高粒级出现波峰(即波峰右移),线虫表现为更加粗壮,生物量更高。已有研究证实,渤海海洋线虫群落结构及多样性常常受环境因素和人为因素的影响而具有显著的空间差异[20-24,27,39]。何蕾[36]对本研究涉及的13个站位海洋线虫群落结构及多样性开展的调查研究显示,近黄河口及莱州湾口站位的海洋线虫群落种类组成与其他站位的相似性低,而底层水温度和粉砂黏土含量是引起研究站位海洋线虫群落种类组成空间差异的主要原因。由此可见,海洋线虫体型特征与环境变化导致的线虫群落种类组成有关,基于线虫个体大小的体型特征及生物量谱分析,在检测渤海海洋线虫群落变化方面具有敏感性。
环境因素,例如食物的可获性、沉积物粒径、溶解氧浓度、温度、及其他环境因素,在决定线虫的个体大小和体型方面起着关键作用[2,4,6,49]。事实上,近黄河口及莱州湾口站位环境特征与其他研究站位显著不同,主要表现为水深浅、底层水温度和盐度低、沉积物Pheo-a及有机质含量低、沉积物粉砂黏土含量高。本研究结果发现,海洋线虫体长、体宽及L/W值的变化与沉积物粒度特征、底温、底盐、Pheo-a和Chl-a浓度、以及有机质含量存在不同程度的相关性,表明它们是引起渤海海洋线虫体型特征差异的主要环境因素。同时,本研究结果显示,底温、底盐、Pheo-a和粉砂黏土含量等环境因素也与海洋线虫生物量谱结构密切相关,对海洋线虫体型特征的影响最终表现为生物量谱的差异。
沉积物粒度特征通常是影响线虫体型的直接因素。本研究中,沉积物粒度特征(粉砂黏土含量或中值粒径)与线虫L/W值和体长相关,特别是与L/W值极显著相关,表明沉积物粒度特征是影响线虫体型的主要环境因子之一。通常,砂质沉积物中,海洋线虫多为个体较小的砂间生活种(体宽<32 μm);在泥质沉积物中,沉积物颗粒很细,易于搬运,出现个体较大的(体宽>32 μm)的线虫[2,50]。本研究中,近黄河口及莱州湾口站位沉积物颗粒较细,平均粉砂黏土含量为93.5%,高于其他研究站位的平均值(73.8%)。因此,近黄河口及莱州湾口站位线虫则表现为平均体宽、体长值大,粗个体和长个体线虫比例高于其他研究站位,特别是“长而粗”线虫所占比例较高。其他研究站位则相反,粉砂黏土含量低,细个体和短个体线虫所占比例高,尤其是“短而细”线虫所占比例较高。“短而粗”和“长而细”线虫在研究站位所占比例均极低。以上结果表明,2个站位组间线虫体型差异可能是对沉积物粒度大小的一种适应性变化。
海洋线虫的体长、体宽差异也与温度和盐度变化有关。本研究中,海洋线虫的体长、体宽差异也与温度和盐度变化有关,其中温度、盐度、水深互为正相关,表现了研究海域秋季近岸向离岸的温、盐变化特点。海洋动物的呼吸速率受温度的直接影响,在适宜温度范围内,温度升高会使代谢速率加快,呼吸速率升高。而呼吸速率与生物体的个体大小成反比[2]。因此,线虫个体大小受温度影响,表现为离岸高温、高盐站位的线虫短而细,近岸低温、低盐站位的线虫长而粗。
食物资源也是影响线虫体型特征的重要因素之一。海洋线虫主要以底栖硅藻和有机碎屑等为食,因此沉积物Chl-a、Pheo-a浓度及有机质含量往往用来代表海洋线虫的食物来源。由于个体小,能量消耗低,能更好地适应持续的食物匮乏,因此,在贫营养沉积物中,海洋线虫个体通常较小[45,51]。但是,本研究中,海洋线虫体长、体宽与Pheo-a及有机质含量显著负相关。特别是B50站Pheo-a和有机质含量最高,但海洋线虫个体体长、体宽值却最小。事实上,秋季研究海域底栖微藻、有机碎屑等并不匮乏,甚至有些站位极丰富。因此,食物资源可能不是引起研究海域秋季线虫个体大小空间差异的直接因素。Soetaert等[4]也曾表示,食物并不是直接作为一种限制因素影响线虫个体大小,而是通过沉积物生物地球化学过程间接产生影响。有机质含量增加,使沉积物表面氧气含量降低、加速消耗,海洋线虫维持较细的体宽和较高的表面积-体积比,可增加其吸收氧气的能力。因此,在有机质含量高的情况下,线虫体型的变化主要是对有机质分解耗氧导致含氧量下降的适应结果。
此外,也有研究显示线虫个体大小也是对来自捕食者的捕食压力的适应[4,7]。某些大型底栖动物,例如小型甲壳类、鱼类和食肉性多毛类以海洋线虫为食[52]。在长期进化中,海洋线虫对捕食/被捕食关系产生了两种体型适应:一种是利用纤细的体型迅速移动,躲避捕食者;另一种是通过粗壮的体型降低其可食性,抵御捕食者[4]。李乃成[53]对本研究涉及的13个站位大型底栖动物群落功能的研究发现,2014年11月,肉食性大型底栖动物密度百分比高,这意味着海洋线虫的被捕食压力可能较大。因此,研究海域海洋线虫以纤细型为主,也可能是海洋线虫对被捕食压力的一种适应结果。
值得指出的是,本研究结果与渤海海洋线虫历史研究[23,40]相比,生物量谱波峰发生转移,由2008年的-3~-1粒级左移为-4~-2粒级,表明海洋线虫个体体型变小。首先,不可排除线虫体长、体宽测量方法带来的误差。本研究海洋线虫的测量借助显微测量软件进行测量,历史研究则采用描图仪描图后,用地图测量仪测量。其次,采样站位的不同可能会导致研究结果的差异。本研究与历史研究均以渤海为研究海域,但无重叠的采样站位。因此也无法忽略空间差异导致的生物量谱结果的不同。再次,采样季节不同也可导致结果的差异。线虫的生长繁殖情况和年龄结构具有季节差异,进而可以影响线虫个体大小,幼龄个体、小个体海洋线虫所占比例则高[28,54-56]。历史研究[23,40]的采样时间为8月,本研究采样时间为11月,不同季节的线虫生长繁殖情况及年龄结构有区别。因此,与渤海夏季结果相比[23,28],本研究海洋线虫个体较小,个体平均干质量较低。除了以上提到的方法、空间及季节原因,也不能忽略全球变暖背景下,渤海海洋线虫体型的小型化趋势。已有研究[57]表明,渤海大型底栖动物的体型出现变小的趋势。有关海洋线虫个体小型化的推测,仍有待验证,需要结合更大的时间尺度数据予以证明。
4 结语
综上所述,研究海域海洋线虫体型特征及生物量谱存在显著的空间差异,与其他站位相比,近黄河口及莱州湾口站位的海洋线虫更粗壮,其体长、体宽值均较高,但L/W值较低,生物量谱波峰出现于较大粒级。本研究结果发现,粉砂黏土含量、底温和底盐等非生物因素与海洋线虫体长、体宽、L/W值等的相关性显著,在粉砂黏土含量高的沉积物和低温、低盐的近岸水域中,“长而粗”线虫比例增加。此外,线虫体型的变化也是对有机质分解耗氧导致含氧量下降的一种适应结果,维持较细的体宽和较高的表面积与-体积比,可增加其吸收氧气的能力。由此可见,基于线虫个体大小的分析方法在检测线虫群落变化方面具有敏感性,可以为了解海洋线虫群落对环境变化的响应提供有价值的信息。据此,本文作者建议,人类应该在更广的范围选择不同生境、针对不同功能类群,开展海洋线虫体长、体宽的测量,分析其体型特征,深入了解其在生态系统功能分析中的重要价值。
