无机离子对磷硫修饰DNA的碘催化断裂反应的显著影响❋
2022-09-30胡坤灵汤若冰梁兴国
胡坤灵,汤若冰,安 然,2,梁兴国,2❋❋
(1.中国海洋大学食品科学与工程学院,山东 青岛 266003;2.青岛海洋科学与技术试点国家实验室 海洋药物与生物制品功能实验室,山东 青岛 266237)
磷硫修饰是一种常用的核酸化学修饰方式,广泛应用于核酸药物开发[1-3]。磷硫修饰DNA(Phosphorothioate DNA,PT-DNA,见图1A)是硫原子取代了DNA骨架上磷酸基团中非桥接氧原子。相对于天然DNA,PT-DNA较难被核酸酶消化,可以提高药物在体内的稳定性,延长核酸药物的半衰期[4-6]。磷硫修饰可用两种方法制备,一是用硫修饰的dNTP(α-磷酸处一个氧原子被硫原子取代)为原料,由DNA聚合酶引入[7];二是通过化学合成法将带有硫修饰的活性单体引入到DNA序列的指定位置[8]。Zhou和Deng的研究小组在二十世纪八十年代后期意外发现了一种奇怪的现象,即一些微生物(如变铅青链霉菌)的基因组相对于其他微生物很容易断裂[9]。经过十几年的研究他们发现,这些微生物的基因组中含有易于断裂的磷硫修饰[10]。深入研究表明,生物体内只存在R-构型(Rp)而不存在S-构型(Sp)的PT-DNA[11]。虽然PT-DNA被认为具有抗氧化、消灭外来入侵基因组的功能,但其机制及生物学意义还亟待进一步阐明[12-14]。

(A:PT-DNA同非修饰DNA的结构比较;B:Tris、HEPES、磷酸的结构。A:Structural comparison between PT-DNA and unmodified DNA; B:Structures of Tris、HEPES and Phosphoric acid.)
为开发新的测序技术,Gish等于1988年以待测序DNA或RNA为模板生成PT-DNA或PT-RNA,并通过对其进行适当断裂后的电泳分析来读取序列信息[15]。他们发现2-碘乙醇或环氧丙烷等烷基化试剂可使PT-DNA断裂,并提出了烷基化PT-DNA脱硫和断裂的机理,但未提供证据[16]。随后,Blanusa等发现可用碘溶解在乙醇中的新鲜溶液(碘/乙醇)代替2-碘乙醇,并指出断裂收率达70%左右[17]。但有关碘/乙醇断裂PT-DNA的收率的数据却无法在相应的文献中找到。之后大家都引用Nakamaye等的论文,并认为碘/乙醇也是通过形成2-碘乙醇,然后使PT-DNA进行烷基化而断裂。2014年Cao等人开始使用碘和碘化钾的混合溶液(不可能生成2-碘乙醇),并发现与碘/乙醇有同样的效果[18]。
最初,PT-DNA断裂使用生物反应常用的Tris-HCl缓冲溶液[15]。Tris(tris-(hydroxymethyl)-aminomethane)、HEPES(4-羟乙基哌嗪乙磺酸,2-[4-(2-hydroxyethyl)piperazinyl]ethanesulfonic acid)及Phosphate等有pH调节功能的分子结构如图1B所示。2014年Cao等开始使用磷酸缓冲溶液代替Tris-HCl,并认为应有同样的效果[18-20]。一般认为缓冲液是保证反应过程中pH稳定,很难想到会对核酸断裂反应产生影响。不可思议的是,Cao等推测Tris可能参与了断裂反应[21]。但他们在反应体系中并未特意加入Tris,只是认为可能是前期样品处理过程中没有被除净的Tris造成的副反应。这些结果提示我们,可能缓冲溶液本身以及各种阳离子对于PT-DNA的断裂有较大影响,甚至直接参与了反应。显然,深入研究以解释这些相互矛盾的结果可以减少它们对于研究者造成的诸多误解和困惑。
本研究探究了在Tris-HCl、磷酸钠和HEPES三种缓冲溶液中碘断裂PT-DNA的情况,并考察了Na+、Mg2+、Ca2+以及精胺等阳离子对断裂的影响。结果发现缓冲溶液对PT-DNA断裂影响显著,且会对单链和双链状态PT-DNA产生明显不同的影响。最后,我们根据反应结果提出了碘在不同缓冲溶液下断裂PT-DNA的碘氧化机理,并从氧化反应的角度讨论了其在生物体内可能起到的功能作用。
1 实验方法
1.1 试剂与材料
DNA序列由生工生物工程股份有限公司(中国,上海)合成(见表1)。实验中所用化学试剂,除碘购自上海麦克林生化科技有限公司外,其他化学试剂(KI、Na2HPO4、NaH2PO4、NaOH、NaCl、MgCl2、CaCl2、Tris、HCl、精胺)均来自国药集团化学试剂有限公司(中国,上海)。聚丙烯酰胺(PAGE)电泳所需试剂购自白鲨生物技术有限公司(中国,合肥)。

表1 本研究中使用的寡核苷酸序列
1.2 碘溶液的制备
实验中所使用的碘溶液是I2/KI溶液(碘溶解在碘化钾的新鲜溶液),具体制备方法:将固体碘溶于1.0 mol/L KI水溶液中至终浓度为200 mmol/L,60 ℃加热溶解固体碘,充分溶解后,所得溶液在4 ℃避光保存,2周之内使用。在与PT-DNA反应之前,用无菌水将I2/KI溶液稀释到所需的浓度。稀释后的I2/KI溶液需在12 h内使用。
1.3 碘断裂PT-DNA反应
在20 μL总反应体系中包括如下物质:1.0 μmol/L D1S-90(单链)或同时有1.0 μmol/L互补链D-30(双链),0.1 mmol/L I2/KI溶液,20 mmol/L缓冲溶液(Tris-HCl或磷酸钠或HEPES;pH=8.0,25 ℃测定);上述物质混合均匀后加入碘。使用PCR仪(将样品管放入控温的PCR仪中)控制反应温度。除了研究温度对断裂反应的收率影响时采用4种反应温度(0、25、37和65 ℃)外,如无特殊指出,一般反应温度为25 ℃,反应时间为30 min。反应至指定时间后,加入2 mmol/L二硫苏糖醇(DTT)以破坏未反应的碘,并在4 ℃条件下保存样品,直到样品进行电泳检测。断裂反应的产物通过变性12%聚丙烯酰胺凝胶电泳(6.25 mol/L甲酰胺、8.0 mol/L尿素、1×TBE电泳缓冲液)进行检测。
对于研究盐离子对碘断裂PT-DNA影响的实验,只是在上述反应体系中,在碘加入前加入不同浓度的盐离子(NaCl:1.0~3 000 mmol/L,MgCl2:0.01~200 mmol/L,CaCl2:0.01~100 mmol/L,精胺:0.01~0.2 mmol/L),其他条件与上述断裂反应相同。
1.4 丙烯酰胺凝胶电泳分析断裂收率
碘断裂反应后,将样品与1×上样缓冲液(10 mmol/L Tris-HCl(pH=7.6)、0.03%溴酚蓝、0.03%二甲苯氰FF、60%甘油、60 mmol/L EDTA)混合,用含6.25 mol/L甲酰胺的12%变性聚丙烯酰胺凝胶进行电泳分析。电泳结束后用GelRed染色,底物和断裂产物将通过Gel Doc XR+成像系统(Bio-Rad)和Image lab软件v3.0(Bio-Rad)定量。断裂收率(生成断裂产物与反应底物的比值)计算公式如下:
断裂收率=(P1+P2)/(S+P1+P2)×100%。
式中:S为底物(D1S-90)的条带亮度;P1及P2分别为断裂后的两段产物(51和39 nt)的条带亮度。每个实验至少重复3次取平均值;实验中条带亮度的定量误差在5%以内。
1.5 统计学分析
使用SPSS 24.0统计软件进行分析,其中对含有单链及双链状态下两组的组间比较采用双侧曼-惠特尼U检测(Two tailed Mann-Whitney U test)。
2 结果与讨论
2.1 Tris-HCl条件下碘高效断裂PT-DNA
三羟甲基氨基甲烷(Tris)作为一种最常用的生物反应缓冲溶液,在2-碘乙醇断裂PT-DNA研究中经常被使用。考虑到单链和双链DNA结构中磷酸二酯键空间结构的差异可能影响PT-DNA的断裂效率,我们首先研究了各种缓冲溶液下碘对单链和双链状态PT-DNA的断裂情况。单链反应体系采用含有单个磷硫修饰的90 nt长单链DNA(D1S-90),具体序列如表1所示。在硫修饰位点断裂后会产生长度为51和39 nt的两个DNA片段(见图2A)。双链反应体系采用D1S-90和D-30(30 nt长互补单链)退火杂交,杂交后形成长度为30 bp的双链结构(硫修饰位点处于双链部分的中间位置,见图2B)。
在Tris-HCl缓冲条件下,碘断裂PT-DNA的结果显示单链断裂率在70%左右(见图2A)。有趣的是,当反应温度为0 ℃时断裂收率最高,达到76%(见图2A的泳道2),这表明断裂反应非常高效。温度较低断裂效率反而有所升高这一反常现象可能是由于碘在造成PT-DNA断裂的同时还会发生脱硫反应[16,22],而低温抑制了脱硫有利于提高断裂反应与脱硫反应的比例。相比单链体系,双链体系断裂率稍高,可达75%~80%(见图2B)。

(A:单链PT-DNA结构示意图及变性胶电泳分析;B:双链PT-DNA结构示意图及变性胶电泳分析。图中红色字体S表示磷硫修饰的位置。泳道1为对照组D1S-90。泳道2~5分别为反应温度为0、25、37、65 ℃的反应结果。A: Structure of single-stranded PT-DNA and results of eletrophoertic analysis; B: Structure of double-stranded PT-DNA and results of eletrophoertic analysis.The red font S in the figure indicates the position of PT-modification.Lane 1 represents D1S-90 as a control group.Lane 2~5 represent the results at reaction temperatures of 0、25、37、65 ℃, respectively.)
2.2 盐离子对Tris-HCl缓冲溶液中PT-DNA断裂的影响
为进一步探究各种盐离子对Tris-HCl缓冲溶液中碘断裂PT-DNA的影响,分别研究了在NaCl、MgCl2、CaCl2及精胺的条件下单链和双链状态PT-DNA的断裂效率。电泳后经定量分析所得的断裂收率与离子浓度的关系如图3所示。上述盐类物质在很低的浓度范围内(1~10 mmol/L)就可以显著降低单链断裂的收率。随着盐浓度的增加,收率逐渐降低并达到饱和,如加入1.0 mol/L NaCl后D1S-90单链的断裂收率从72%下降到58%。加入100 mmol/L的MgCl2和CaCl2后,单链PT-DNA的断裂收率分别下降到53%和47%,Mg2+和Ca2+二价阳离子对断裂反应的影响更大,这可能是由于阳离子同DNA上带负电的磷酸基团结合对断裂反应产生了阻碍作用,而二价阳离子的结合能力更强。如这一猜想正确,可以预测多聚阳离子精胺(每个精胺分子含有两个氨基和两个亚氨基)会产生更为显著的阻碍作用。见图3D显示,很低浓度(小于50 μmol/L)的精胺即可显著降低断裂收率;当精胺浓度达到100 μmol/L时,断裂率甚至降低至40%以下。在实验中我们发现,当体系中含有100 μmol/L以上精胺时,电泳染色效果显著降低,这是由于精胺结合DNA后影响了染料的结合,造成难以染色。有趣的是,在仅有精胺的对照组中,我们也发现了约40%的断裂收率。这一结果表明,在Tris不存在的情况下,精胺本身也能促进硫修饰DNA的断裂,但其反应的详细机理有待进一步研究。

图3 盐离子对Tris-HCl条件下碘断裂PT-DNA的影响
意外的是,随着Na+、Mg2+和Ca2+等金属阳离子的浓度的升高,双链状态PT-DNA的断裂反应的收率稳定在81%~84%之间,并没有显著下降(见图3)。这表明与单链状态不一样(p<0.05),在Tris-HCl缓冲溶液中双链状态PT-DNA的断裂反应基本不受这些阳离子的影响。这可能是单链和双链DNA同Tris分子作用受其他阳离子的影响不同造成的。而精胺使双链状态PT-DNA断裂收率也显著降低(见图3D)。这可能因为精胺对双链DNA的结合能力极强,阻碍了阴离子定向攻击磷酸二酯键处的磷原子。精胺存在下染色剂对双链DNA更难染色也说明其对双链DNA的超强结合能力[23-25]。这也表明精胺通过这种相互作用保护DNA。
2.3 阳离子通过同Tris竞争对单链DNA的结合以影响碘断裂PT-DNA
Tris的分子结构中含有三个羟基和一个氨基(见图1B),这一结构既有助于同DNA结合又可能参与DNA水解断裂所需的亲核反应。我们推测有可能是Tris分子中因质子化而带正电荷的氨基与带负电的PT-DNA相互吸引,而Tris的羟基可进攻磷硫修饰位点而发生断裂。加入阳离子后可能与Tris形成了对DNA结合的竞争关系,聚集在PT-DNA周围的这些阳离子影响了带正电荷的Tris离子的接近,从而使断裂收率降低。
为验证金属阳离子同Tris对PT-DNA结合的竞争作用,我们重点研究了Tris的浓度为20和100 mmol/L两种情况下,MgCl2浓度对断裂收率的影响(见图4)。结果表明,当Tris的浓度为20 mmol/L时,加入10 mmol/L MgCl2后单链PT-DNA的断裂率从初始的72%下降至56%。当Tris浓度为100 mmol/L,单链PT-DNA的断裂率同样随着MgCl2浓度的增加呈下降趋势,且高浓度MgCl2可显著降低单链PT-DNA的断裂率。上述结果表明,阳离子确实影响了Tris与PT-DNA的结合,进而影响了PT-DNA的断裂反应。
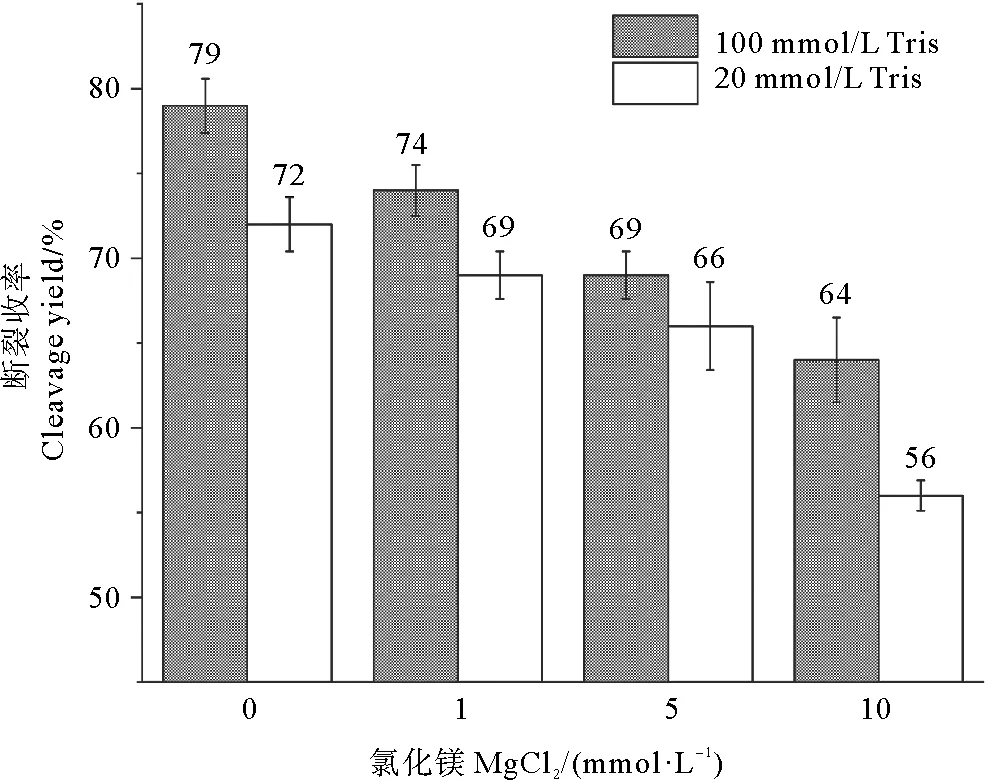
图4 Mg2+与Tris的竞争影响单链的断裂收率
2.4 磷酸钠/HEPES缓冲溶液中PT-DNA的断裂及盐离子的影响
磷酸钠(Sodium phosphate)曾被用于代替Tris-HCl作为PT-DNA断裂反应的缓冲溶液[18]。为进一步研究各种离子对PT-DNA断裂的影响,我们探究了在带负电荷的磷酸根离子和电中性的HEPES分子作为缓冲溶液的反应情况。有趣的是,相比Tris-HCl作缓冲溶液,无论是单链还是双链PT-DNA的断裂收率都显著下降(见图5)。当HEPES作为缓冲溶液时,单双链体系断裂收率无明显差别(见图5的泳道3、泳道5,收率约为30%);当磷酸钠作为缓冲溶液时,双链体系的断裂收率(见图5的泳道6,收率为39%)是单链体系(见图5的泳道4,收率为16%)的2倍以上。不同缓冲条件造成了断裂收率有差异,这也从侧面验证了Tris-HCl可能不仅是保持体系pH的缓冲溶液,而且极有可能作为反应物参与了断裂反应。而磷酸钠及HEPES不同于Tris,不能直接参与PT-DNA的断裂反应。这一结果表明,PT-DNA的断裂效率不只决定于断裂试剂碘和反应溶液的pH,其他分子可能对其也有很大的影响。

(泳道1为对照组D1S-90及D30。Lane 1 represents D1S-90 and D30 as a control group.)
前面已经证实阳离子对Tris-HCl条件下的单链断裂反应有显著的抑制作用,而对双链几乎没有作用,那对于磷酸钠和HEPES这两种缓冲溶液是否有类似的结果呢?如表2所示,当HEPES作为缓冲溶液时,1.0 mol/L NaCl使单链和双链PT-DNA的碘断裂收率均有所下降(见表2)。更有趣的是,磷酸钠作为缓冲溶液时,同Tris-HCl作为缓冲溶液的情况相反,1.0 mol/L的NaCl反而使双链状态PT-DNA的断裂收率显著提高(由39%提高至61%)。对于单链PT-DNA,1.0 mol/L的NaCl未造成收率的明显变化(分别是20%和16%)。

表2 不同缓冲溶液条件下加入1.0 mol/L NaCl的断裂收率
为了进一步确认阳离子对磷酸盐缓冲溶液中PT-DNA断裂的作用,我们研究了NaCl浓度对收率的影响(见图6)。结果显示,NaCl浓度对单链PT-DNA的断裂影响不大,且断裂收率都很低(16%~20%)。对双链PT-DNA的断裂,随NaCl浓度(≤1.0 mol/L)升高而收率升高(收率由40%升高到60%左右)。当NaCl浓度达到1.0 mol/L时,进一步升高NaCl浓度,断裂收率则基本保持不变。

图6 NaCl对磷酸钠条件下碘断裂PT-DNA的影响
实际上,与HEPES分子呈电中性不同,磷酸盐在水中电离时带有一个或两个负电荷。考虑到高浓度盐离子可以增加磷酸钠条件下双链状态PT-DNA的断裂收率,我们猜测磷酸缓冲溶液中,磷酸或许也能参与断裂反应。如果确实如此,磷酸钠浓度也会影响断裂收率。因此我们研究了磷酸钠浓度对PT-DNA断裂的影响(见图7)。结果显示,对于双链PT-DNA,当磷酸钠浓度(pH保持不变)由5 mmol/L增加至100 mmol/L,断裂收率由17%提高到56%(见图7的泳道3~7)。虽然单链PT-DNA断裂收率依旧不高(<25%),但可明显看出随着磷酸盐缓冲的溶液浓度增加,单链PT-DNA断裂收率由12%提升至24%(见图7的泳道8~10)。

图7 磷酸钠缓冲溶液的浓度对碘断裂PT-DNA的影响
综上,盐离子对PT-DNA断裂有着复杂的影响。在三种不同的缓冲溶液中盐离子对于单链和双链PT-DNA断裂的影响不同(促进/阻碍),即在PT-DNA分子周围的离子环境显著影响了其断裂反应。
2.5 碘断裂PT-DNA的机理推测


图8 碘断裂PT-DNA的机制推测
除了缓冲溶液,PT-DNA的构象对断裂效率也可能产生影响,而这种影响在高浓度盐离子的作用下可能更加明显。在Tris-HCl缓冲溶液中,盐离子与Tris竞争结合PT-DNA进而影响了断裂反应。特别是对于单链PT-DNA,Tris对于PT-DNA的结合能力较弱,更容易受到阳离子的影响。虽然盐离子对单链断裂显示出较明显的影响,但是即使很高的阳离子浓度下,单链PT-DNA的断裂收率也仍有50%左右。而对于双链DNA,由于DNA双螺旋结构的小沟中有较强的疏水性,在疏水作用和离子结合的双重作用下,Tris可能同DNA结合更紧密,很难被阳离子替代。因此,盐离子很难影响Tris-HCl缓冲溶液中碘对双链PT-DNA的断裂反应。

目前的研究认为,天然的磷硫修饰DNA通过抗氧化或类似限制性修饰(Restriction modification)系统保护细菌自身而提高生存竞争力[26-27]。我们的研究表明,细菌可能通过这种磷硫修饰来保护DNA分子的氧化。特别是当其他抗氧化系统存在漏洞,让具有氧化能力的分子可以接触到DNA时,磷硫修饰可减少DNA碱基的氧化。总之,PT-DNA可以有效吸引弱氧化剂以免其对DNA造成难以修复的破坏。细菌可通过指定位点(磷硫修饰处)的结构变化或断裂而产生抗氧化响应,最大限度地保持基因的稳定性。同时也引发了我们对带有磷硫修饰的核酸药物在体内代谢方式的思考,它们很可能是由于氧化作用引发的断裂而后被进一步代谢或是脱硫后被核酸酶分解。此外,这种磷硫修饰DNA或RNA已被用于开发核酸药物、重金属离子检测和核酸检测等生物技术[28-30]。因此,本研究结果及推测的机理有助于核酸药物的开发与优化。
3 结语
本研究表明,缓冲溶液及盐离子可影响PT-DNA的断裂收率,特别是Tris通过直接参与反应的方式使PT-DNA发生高效断裂,最高收率可达80%。在HEPES或磷酸钠缓冲条件下,断裂收率较低(一般低于60%)。研究还发现,PT-DNA所形成的二级结构(单链或双链)对断裂也产生了很大的影响。具体表现在,Tris作为缓冲溶液时,阳离子会使单链PT-DNA的断裂收率显著下降,但不影响双链状态PT-DNA的断裂反应。金属阳离子的存在会使得磷酸钠缓冲溶液条件下双链状态PT-DNA易受羟基(OH-)进攻,进而断裂收率得到显著提高;而对于单链PT-DNA体系,虽然断裂收率也会随金属阳离子浓度升高而升高,但提升效果欠佳,最高收率仅达24%。本研究可为深入理解磷硫修饰DNA的生物学功能及开发相应的生物技术提供重要参考。
