桦褐孔菌总三萜提取物的纯化及其体外抗肿瘤活性研究Δ
2022-09-30邵骏菁杨颖马大龙吕志强田景振张晓平山东中医药大学药学院济南25055济宁医学院山东济宁272067青岛大学附属医院药品调剂科山东青岛266000山东中医药大学青岛中医药科学院山东青岛2662
邵骏菁,杨颖,马大龙,吕志强,田景振,张晓平,4#(.山东中医药大学药学院,济南 25055;2.济宁医学院,山东 济宁 272067;.青岛大学附属医院药品调剂科,山东 青岛 266000;4.山东中医药大学青岛中医药科学院,山东 青岛 2662)
宫颈癌主要由人乳头瘤病毒引起,是一种会严重危害女性健康的生殖系统恶性肿瘤[1]。据统计,宫颈癌的发病率和病死率均居全球第4位,且近年来呈年轻化的趋势[2]。中医药在我国肿瘤患者的防治中发挥着重要作用,调查发现,大多数肿瘤患者的诊疗过程都有中医药的参与[3-4]。中药治疗具有多途径、多靶点、副作用小等特点,目前已经成为临床治疗肿瘤不可或缺的手段之一[5-6]。
桦褐孔菌Inonotus obliquus为多孔菌科、褐卧孔菌属的药食两用真菌,味微苦、性偏凉,以扶正为主,兼以祛邪,具有益气养血、滋阴生津、疏肝解郁等作用[7-9]。动物实验和长期临床实践表明,桦褐孔菌具有良好的抗肿瘤、降血糖和降血脂等药理活性,且尚未发现其明显的不良反应[10]。笔者前期已对桦褐孔菌的抗肿瘤谱和抗肿瘤活性部位进行了筛选,发现三萜类成分为其发挥抗肿瘤作用的主要有效部位之一,且对人宫颈癌细胞HeLa具有良好的抑制效果,但作用机制尚不清晰[10]。此外还发现,桦褐孔菌提取物中总三萜含量较低。基于此,本研究拟先对桦褐孔菌总三萜进行纯化,再对纯化后的总三萜进行抗肿瘤活性探讨,为进一步阐明桦褐孔菌抗肿瘤作用的物质基础及具体机制提供实验依据。
1 材料
1.1 主要仪器
本研究所用主要仪器包括UV-6000型紫外-可见分光光度计(上海元析仪器有限公司),FA2014型十万分之一电子天平(上海舜宇恒平科学仪器有限公司),HF90型CO2恒温培养箱(上海力申科学仪器有限公司),ULH100HG型荧光显微镜(日本Olmypus公司),Primaide型倒置显微镜(日本Hitachi公司),Epoch2T型酶标仪(美国BioTek公司)。
1.2 主要药品与试剂
桦褐孔菌药材购自神农金康(湖南)原生态茶业有限责任公司,经山东中医药大学药学院张晓平讲师鉴定为真品。桦褐孔菌醇对照品(批号B50360,纯度≥95%)和顺铂对照品(批号B24462,纯度≥98%)均购自上海源叶生物科技有限公司;AB-8型大孔吸附树脂和X-5型大孔吸附树脂(批号分别为A875381、X875377)均购自上海麦克林生化科技有限公司;D101型大孔吸附树脂(批号20200624)购自国药集团化学试剂有限公司;MTT试剂(批号EZ6789C126)购自德国BioFroxx公司;AnnexinⅤ-FITC流式凋亡检测试剂盒(批号BMS500FI-100)购自美国Invitrogen公司;AO/EB试剂盒(批号BB-4132-100T)购自上海贝博生物科技有限公司;磷酸盐缓冲液(PBS)和二甲基亚砜(批号分别为21036449、EZ6789C15 0)均购自兰杰柯科技有限公司。
1.3 细胞株
人宫颈癌细胞株HeLa购自上海启达生物科技有限公司。
2 方法与结果
2.1 桦褐孔菌总三萜粗提物的制备
经过前期正交实验,优化出桦褐孔菌总三萜的最佳提取工艺如下:取桦褐孔菌粉末适量,置圆底烧瓶中,加12倍量(mL/g,下同)95%乙醇加热回流2次,每次80 min,合并滤液,回收乙醇至无醇味,冷冻干燥得到桦褐孔菌总三萜粗提物,提取率约为2.136%。
2.2 桦褐孔菌总三萜的含量测定
2.2.1 对照品溶液的配制 精密称取桦褐孔菌醇对照品,加无水乙醇配制成质量浓度为0.16 mg/mL的对照品溶液。
2.2.2 供试品溶液的配制 精密称取桦褐孔菌药材粉末5 g,按照“2.1”项下方法提取,冷冻干燥至50 mL,即得。
2.2.3 检测方法 精密量取“2.2.2”项下供试品溶液50 μL,置10 mL具塞试管中,100℃下水浴蒸干,加入0.2 mL新配制的香草醛-冰醋酸溶液(质量浓度0.05 g/mL)和0.8 mL高氯酸,摇匀,70℃下水浴保温反应15 min,冷却至室温,加乙酸乙酯定容至5 mL,并利用紫外-可见分光光度计检测其在550 nm波长处的吸光度。
2.2.4 方法学考察 按2020年版《中国药典》(四部)“分析方法验证指导原则”进行方法学考察。结果显示,桦褐孔菌醇的回归方程为Y=0.058 9X-0.063 2(R2=0.999 7)(式中Y为吸光度,X为待测物质量浓度),线性范围为3.20~17.60 μg/mL;精密度、重复性、稳定性试验的RSD分别为0.71%、1.27%、0.89%(n=6);平均回收率为97.82%,RSD为2.35%(n=6)。考察结果均符合《中国药典》规定。
2.2.5 桦褐孔菌总三萜粗提物的含量测定 精密称取“2.1”项下桦褐孔菌总三萜粗提物粉末2 mg,用无水乙醇溶解并定容至10 mL,按“2.2.3”项下方法处理后测定吸光度,代入回归方程计算质量浓度,再计算得桦褐孔菌总三萜粗提物中总三萜的含量为34.36%。
2.3 桦褐孔菌总三萜的纯化
2.3.1 大孔吸附树脂的预处理 将大孔吸附树脂用95%乙醇浸泡24 h,然后装柱,用95%乙醇以5 mL/min的流速洗脱至洗脱液澄清,再用蒸馏水洗脱至无醇味即可。
2.3.2 大孔吸附树脂种类的筛选 取预处理后的AB-8型、X-5型、D101型大孔吸附树脂分为7组,分别为单用组、两两等比例混合的联用组以及三者等比例混合的混用组,分别加至具塞锥形瓶中,各加入桦褐孔菌总三萜粗提物溶液20 mL(溶剂为水,质量浓度为2.0 mg/mL,总三萜含量约为0.687 mg/mL,下同),振荡24 h(25℃、110 r/min,下同),过滤,取续滤液按“2.2.3”项下方法处理后测定吸光度,代入回归方程计算质量浓度。另将过滤后的大孔吸附树脂加至具塞锥形瓶中,加乙醇20 mL,振荡24 h,按上述方法计算其中总三萜的质量浓度。按下列公式计算吸附量、吸附率和解析率(表1):吸附量=V(c0-ce)/m,吸附率=(c0-ce)/c0×100%,解析量=V1c1/m,解析率=V1c1/[V(c0-ce)]×100%,式中c0、ce、c1分别为桦褐孔菌总三萜的加入质量浓度、平衡质量浓度、解析后质量浓度,V和V1分别为吸附液(桦褐孔菌总三萜粗提物溶液)及解析液(乙醇)体积,m为大孔吸附树脂质量。结果显示,AB-8型大孔吸附树脂的吸附量和吸附率最高,解析率仅略低于X-5型大孔吸附树脂。综合考虑,最终选用AB-8型大孔吸附树脂纯化桦褐孔菌总三萜。

表1 不同类型大孔吸附树脂对桦褐孔菌总三萜吸附、解析的影响
2.3.3 静态吸附曲线的绘制 精密称取预处理后的AB-8型大孔吸附树脂5 g(湿质量,下同),置具塞锥形瓶中,加桦褐孔菌总三萜粗提物溶液20 mL,振荡24 h进行吸附,每小时测定溶液中桦褐孔菌总三萜的含量,并计算吸附量和吸附率,绘制静态吸附曲线(图1)。图1显示,在吸附5 h后吸附量趋于平衡,最终吸附率为93.48%,表明AB-8型大孔吸附树脂对桦褐孔菌总三萜具有较好的吸附性能,在吸附5 h时基本达到吸附饱和。
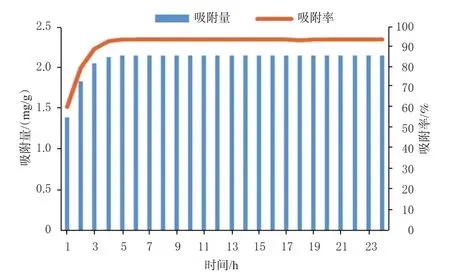
图1 AB-8型大孔吸附树脂对桦褐孔菌总三萜的静态吸附曲线
2.3.4 动态吸附曲线的绘制 精密称取预处理后的AB-8型大孔吸附树脂25 g,平行7份,湿法装柱(2.0 cm×30 cm,径高比为2∶11),用2.0 mg/mL的桦褐孔菌总三萜粗提物溶液上样,上样速率为1.0 mL/min,每流出20 mL流出液测定1次桦褐孔菌总三萜的质量浓度,绘制动态吸附曲线(图2)。图2显示,第7份流出液中桦褐孔菌总三萜质量浓度为0.063 75 mg/mL,接近初始上样液质量浓度的1/10,即认为吸附饱和[11],故选择上样体积为140 mL。
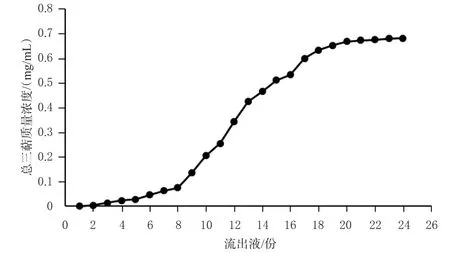
图2 桦褐孔菌总三萜在AB-8型大孔吸附树脂中的动态吸附曲线
2.3.5 上样液质量浓度对动态吸附的影响 同“2.3.4”项下方法装柱,上样速率为1.0 mL/min,上样体积为140 mL,考察不同质量浓度(0.5、1.0、1.5、2.0、2.5、3.0、3.5 mg/mL)的桦褐孔菌总三萜粗提物上样溶液对吸附率的影响。结果显示,上述上样液的吸附率分别为98.61%、96.55%、95.63%、94.74%、89.38%、74.69%、65.82%,可见当桦褐孔菌粗提物溶液的质量浓度为0.5~2.0 mg/mL时,吸附率均大于90%,考虑到生产周期和成本,最终选择上样液质量浓度为2.0 mg/mL。
2.3.6 上样流速对动态吸附的影响 同“2.3.4”项下方法装柱,用2.0 mg/mL的桦褐孔菌总三萜粗提物溶液上样,上样体积为140 mL,考察不同上样速率(1.0、2.0、3.0、4.0 mL/min)对吸附率的影响。结果显示,上述上样速率下的吸附率分别为93.59%、90.52%、88.21%、84.68%,可见当上样速率为1.0 mL/min时,吸附率最高,最终选择上样流速为1.0 mL/min。
2.3.7 洗脱剂体积分数对洗脱效果的影响 同“2.3.4”项下方法装柱、上样,吸附饱和后用200 mL的7种不同体积分数(20%、30%、40%、50%、60%、75%、95%)的乙醇进行洗脱,测定洗脱液中桦褐孔菌总三萜的质量浓度,按解析率公式计算洗脱率。结果显示,上述体积分数乙醇洗脱液的洗脱率分别为15.27%、19.05%、33.40%、40.14%、57.77%、61.26%、98.16%,可见洗脱率和乙醇体积分数呈正相关。以体积分数<50%的乙醇洗脱后经浓缩冻干得到的固体呈深褐色,可见杂质较多;体积分数为60%和70%的乙醇洗脱率较低;以体积分数为95%的乙醇洗脱后经浓缩冻干得到的固体呈淡黄色,且洗脱率最高。因此本实验最终确定先用50%的乙醇进行洗脱,弃去非目标部分,然后用95%的乙醇进行洗脱,收集目标部分。
2.3.8 洗脱剂用量对洗脱效果的影响 同“2.3.4”项下方法装柱、上样,吸附饱和后先用50%的乙醇40 mL除杂,再用95%的乙醇以1.0 mL/min流速进行洗脱,每流出20 mL洗脱液测定1次洗脱率,考察20~240 mL的95%乙醇对洗脱率的影响。结果显示,第1~12份洗脱液的洗脱率分别为39.94%、15.35%、13.88%、6.42%、6.19%、4.05%、3.33%、2.97%、1.24%、1.09%、0.73%、0.62%,可见第9~12份洗脱液的洗脱率很低,且差异不大,表明此时大孔吸附树脂吸附的总三萜成分已被充分洗脱,故选择洗脱剂用量为160 mL。
2.3.9 洗脱流速对洗脱效果的影响 同“2.3.4”项下方法装柱、上样,吸附饱和后先用50%的乙醇40 mL除杂,再用95%的乙醇160 mL以不同流速进行洗脱,考察1.0、2.0、3.0、4.0 mL/min的流速对洗脱率的影响。结果显示,上述流速下的洗脱率分别为84.67%、87.49%、92.29%、70.12%,可见当流速为3.0 mL/min时,洗脱率最高,故选择流速为3.0 mL/min。
2.3.10 纯化工艺验证 称取同一批桦褐孔菌总三萜粗提物3份,按照最佳纯化工艺条件进行纯化,即选用AB-8型大孔吸附树脂,上样液质量浓度为2.0 mg/mL,上样体积为140 mL,上样流速为1.0 mL/min;洗脱时先用50%的乙醇40 mL除杂,再用95%的乙醇160 mL洗脱,洗脱流速为3.0 mL/min,考察纯化前后桦褐孔菌总三萜粗提物的质量和总三萜质量分数(表2)。表2显示,与纯化前相比,总三萜质量分数明显升高,纯化后总三萜质量分数的RSD为1.05%(n=3),说明本纯化工艺合理、可行。
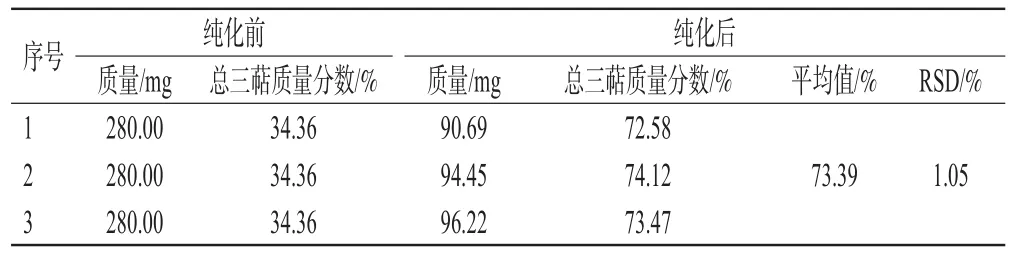
表2 桦褐孔菌总三萜粗提物纯化的验证试验结果
2.4 桦褐孔菌总三萜纯化物的体外抗肿瘤活性研究
2.4.1 供试品溶液的制备 精密称取桦褐孔菌总三萜纯化物适量,置EP管中,加二甲基亚砜涡旋溶解,加RPMI1640细胞维持液稀释至二甲基亚砜的体积分数为0.1%,涡旋混匀,经0.22 μm微孔滤膜过滤,即得供试品溶液,质量浓度为1 mg/mL。
2.4.2 阳性对照药物溶液的制备 精密称取顺铂适量,置EP管中,按“2.4.1”项下方法制成阳性对照药物溶液,质量浓度为0.4 mg/mL。
2.4.3 细胞增殖实验 HeLa细胞经3次传代后,用乙二胺四乙酸-0.25%胰酶消化至游离状态,进行细胞计数,稀释细胞液至1×106个/mL。将细胞接种于96孔板中,每孔100 μL,培养至细胞铺满孔80%时即可使用。实验设置对照组、顺铂组和桦褐孔菌总三萜组。取上述供试品溶液和阳性对照药物溶液,均二倍比稀释制得8个梯度浓度,然后接种于细胞长至80%以上的96孔板中,培养48 h,每个浓度设6个复孔。采用MTT染色法测定490 nm波长处的光密度,计算得桦褐孔菌总三萜纯化物和顺铂对HeLa细胞的半数抑制浓度(IC50)分别为184.20、20.10 μg/mL,可见桦褐孔菌总三萜纯化物对HeLa细胞具有一定的抑制作用。
2.4.4 细胞迁移实验 实验设置对照组、顺铂组和桦褐孔菌总三萜低、中、高剂量组,对照组细胞加入含2%胎牛血清和0.5%双抗的RPMI1640培养基,药物组细胞加入含100、150、200 μg/mL供试品溶液(或20 μg/mL阳性对照药物溶液)、2%胎牛血清和0.5%双抗的RPMI1640培养基,每个浓度设3个复孔,采用倒置显微镜分别记录培养0 h和48 h的划痕间距(图3),使用Image J V1.53c软件计算细胞迁移率,并使用GraphPad 8.0.2软件进行统计学分析,计量资料以±s表示,多组间比较采用单因素方差分析,组间两两比较用LSD检验。结果显示,对照组、顺铂组和桦褐孔菌总三萜低、中、高剂量组的细胞迁移率分别为(43.04±1.60)%、(12.64±0.40)%、(26.99±0.73)%、(16.32±0.34)%、(9.78±0.41)%,RSD分别为3.71%、3.17%、2.72%、2.07%、4.22%(n=3),可见细胞迁移率随着桦褐孔菌总三萜纯化物质量浓度的升高而降低。与对照组相比,各药物组的细胞迁移率均显著降低(P<0.01)。

图3 桦褐孔菌总三萜纯化物对HeLa细胞划痕间距的影响(×40)
2.4.5 细胞凋亡实验 (1)采用AnnexinⅤ-FITC流式凋亡检测试剂盒进行检测。按“2.4.4”项下分组、加药,培养48 h,收集细胞,PBS清洗,重悬计数,参照AnnexinⅤ-FITC流式凋亡检测试剂盒说明书操作,采用流式细胞仪分析细胞早期、晚期凋亡率(表3、图4)。与对照组相比,各药物组细胞的晚期凋亡率均显著升高(P<0.01)。
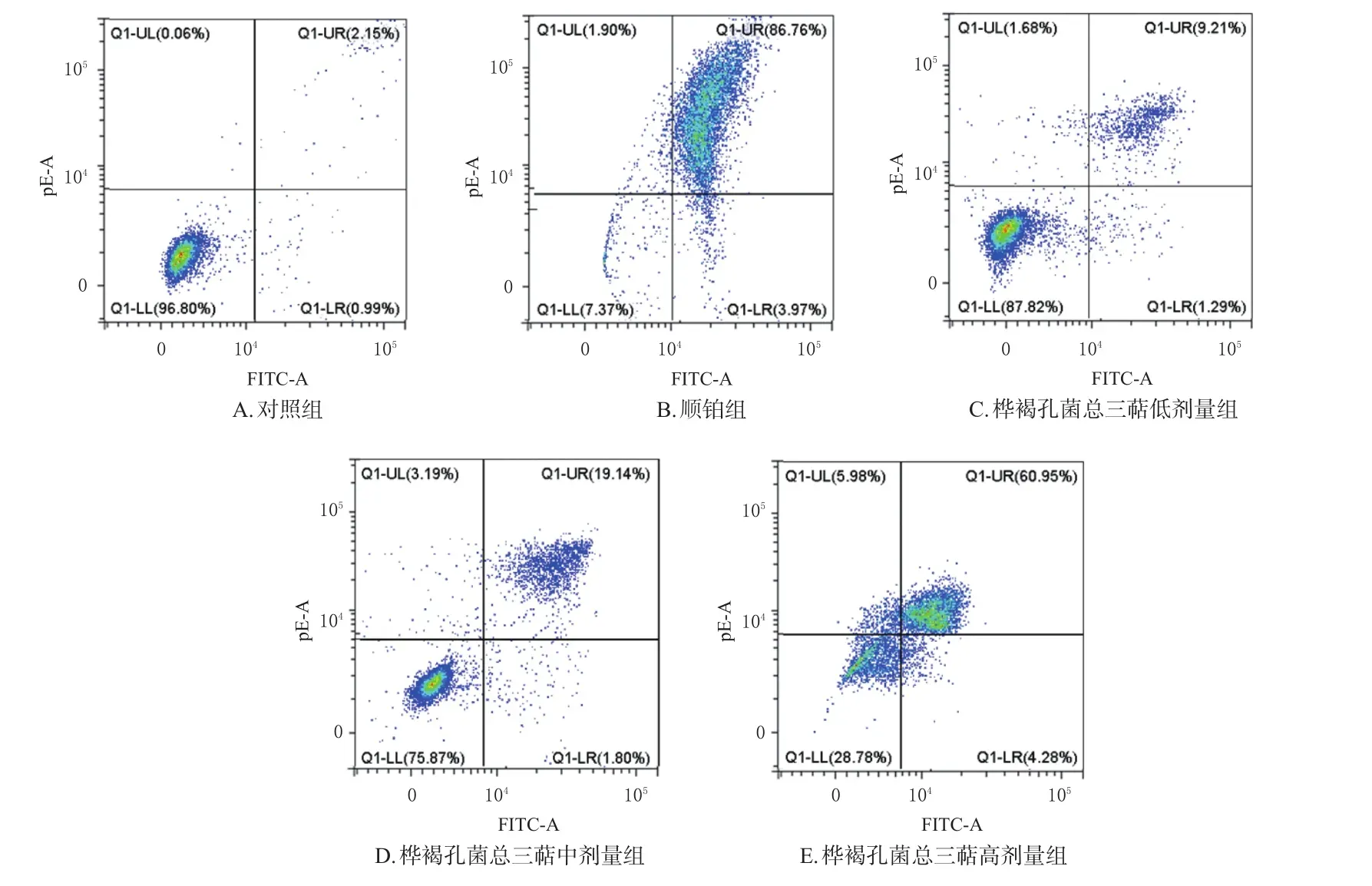
图4 桦褐孔菌总三萜纯化物对HeLa细胞凋亡影响的流式细胞图
(2)采用AO/EB试剂盒进行检测。按“2.4.4”项下分组、加药,培养48 h,收集细胞,PBS清洗,调整细胞在1×106个以内,参照AO/EB试剂盒说明书操作,采用荧光显微镜观察染色结果(图5,绿色为正常活细胞或早期凋亡细胞,橙红色为晚期凋亡细胞),使用Image J V1.53c软件进行荧光定量计数,计算细胞凋亡率(表3)。与对照组相比,各药物组的细胞凋亡率均显著升高(P<0.05或P<0.01)。
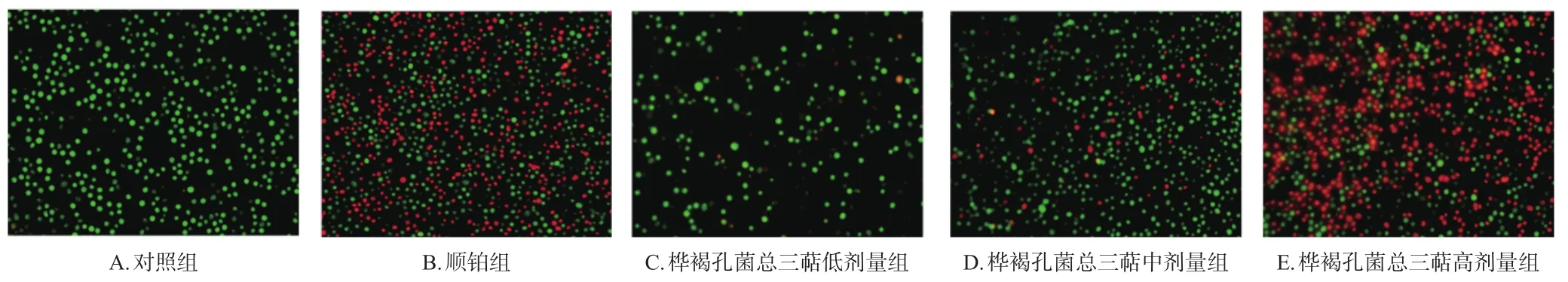
图5 桦褐孔菌总三萜对HeLa细胞凋亡影响的荧光染色图(×30)
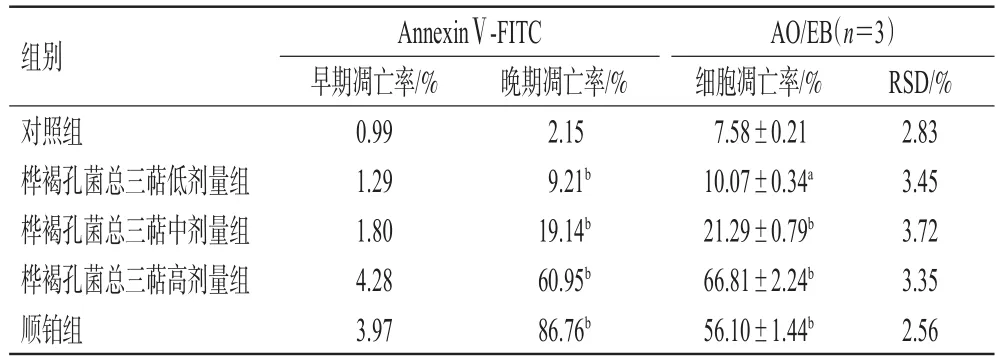
表3 桦褐孔菌总三萜纯化物对HeLa细胞凋亡率的影响
3 讨论
目前桦褐孔菌总三萜的纯化手段以大孔吸附树脂纯化为主[12]。考虑到总三萜类成分极性较小,因此本实验筛选了AB-8型、D101型、X-5型3种极性较小的大孔吸附树脂。通过对其吸附和解析能力进行考察,最终选用AB-8型大孔吸附树脂进行桦褐孔菌总三萜纯化。经过单因素实验考察,筛选出最佳纯化工艺为:AB-8型大孔吸附树脂,上样液质量浓度为2.0 mg/mL,上样体积为140 mL,上样流速为1.0 mL/min;洗脱时先用50%的乙醇40 mL除杂,再用95%的乙醇160 mL洗脱,洗脱流速为3.0 mL/min。
笔者前期实验研究发现,三萜类成分是桦褐孔菌抗肿瘤的有效活性部位之一,对肝癌细胞HepG2、宫颈癌细胞HeLa、黑色素瘤细胞A375、胃癌细胞AGS、乳腺癌细胞T47D均具有良好的抑制效果,其中对HeLa细胞的抑制效果最优。因此本实验采用HeLa细胞作为体外实验研究对象,观察桦褐孔菌总三萜纯化物的抗肿瘤活性。结果显示,桦褐孔菌总三萜纯化物可抑制HeLa细胞增殖和迁移,促进其凋亡,主要促进肿瘤细胞晚期凋亡。
综上所述,本研究建立了桦褐孔菌总三萜提取物的纯化工艺,其纯化物可抑制HeLa细胞增殖和迁移,促进其凋亡。但是其诱导凋亡的具体机制尚不清楚,下一步仍需要深入研究。
