松材线虫微滴式数字PCR检测体系的建立
2022-09-30于海英赵冰峰唐贵婷吴朝君王旭祎
苏 宇,于海英,赵冰峰,蒋 欢,唐贵婷,张 勇,吴朝君,王旭祎
(1.重庆市渝东南农业科学院,重庆 涪陵 408000;2. 国家林业和草原局森林和草原病虫害防治总站,沈阳 110034)
【研究意义】松材线虫(Bursaphelenchusxylophilus)是引起松树萎蔫病(PWD)的病原线虫。截至2020 年底,全国共有18个省(区、市)726个县级行政区被列为松材线虫病疫区,仅2020年就新增60个县级疫情发生区和1181个乡(镇)级疫情发生区。为防止该病进一步蔓延,国家林业局印发的《松材线虫病疫区和疫木管理办法》中督促强化检疫执法,要求建立检疫追溯体系,严防疫情传出疫区。因此,林业植物检疫部门急需一个高效、准确、高通量的松材线虫检测系统,应用于松材线虫检疫。【前人研究进展】目前,松材线虫的检测方法主要有形态学检测法[1-2]、生物化学检测法[3]和分子生物学检测法[4-16]。其中SCAR、RT-qPCR、LAMP等分子生物学检测方法因具有快速、准确、操作简便的优势,已成为松材线虫的主要检测手段。数字PCR作为一种新型的核酸定量检测技术,以其特有的优势越来越受到关注,但目前尚无数字PCR用于松材线虫检测的相关报道。数字PCR的原理最先由Sykes等[17]和Vogelstein等[18]提出,该技术不需建立标准曲线即可实现绝对定量。美国Bio-Rad公司将该技术发展为微滴式数字PCR并将其应用于医学诊断、病毒检测和转基因检测等多个研究领域[19-22]。该技术在检测精密度和重复性方面具有明显的优势,特别适合复杂基质样品中核酸分析和浓度差异微小的样品分析。【本研究切入点】本研究拟将微滴式数字PCR检测体系应用于松材线虫检测,以期丰富现有的松材线虫检测技术,为松材线虫的分子检测提供一个更高效、精确的技术手段。同时,对不同发病时期松树的线虫量、同一株树不同部位的线虫量可以做到定量检测,为研究松材线虫的发生及传播规律提供可靠的试验数据。【拟解决的关键问题】设计松材线虫特异性引物探针序列,优化PCR反应条件,明确数字PCR检测体系的有效性。
1 材料与方法
1.1 材料与仪器
1.1.1 供试线虫及松木样品 本试验选取18株采自不同地区的松材线虫及其相近种线虫虫株,其中松材线虫6株,拟松材线虫3株,泰国伞滑刃线虫3株,十二齿小蠹伞滑刃线虫1株,大连伞滑刃线虫1株,异腐生滑刃线虫1株,红松滑刃线虫2株,松柱形垫刃线虫1株(表1)。感病松木样品和健康松木样品采自重庆市涪陵区龙桥街道汤家院村林场。

表1 供试线虫基本信息
1.1.2 主要试剂及仪器 基因组DNA提取试剂盒购自爱思进(Axygen)有限公司;生化试剂购自索莱宝(北京)有限公司;数字PCR反应试剂2×SuperMix、微滴生成油、微滴发生卡、PCR反应板等数字PCR相关耗材试剂及QX200型微滴式数字PCR仪、PCR仪C1000 Thermal Cycler等均购自美国Bio-Rad公司。
1.2 试验方法
1.2.1 供试线虫及松木样品DNA提取 人工饲养的线虫使用无菌水在平板上洗脱,将洗脱的线虫悬液加入到1.5 mL离心管3000 r/min离心10 min,弃上清,收集管底线虫。将收集到的线虫放入液氮速冻1 min后沸水浴5 min。加入350 μL PBS缓冲液,使用基因组DNA提取试剂盒按照说明书操作步骤提取基因组DNA。
林间取回的松木样品,参照苟大平等[23]所采用的Chelex-100 DNA提取方法,并略作改动。将当年死亡的马尾松伐倒,在树干中部截取厚5 cm左右的圆盘,带回实验室。使用电钻钻取树皮以内、芯材以外部位,收集木屑。称取50 mg松木屑样品,放入2 mL离心管中,加入异硫氰酸胍提取缓冲液[3 mol/L CH5N3HSCN5,50 mmol/L Tris-HCl(pH 8.0),20 mmol/L EDTA(pH 8.0),1%TritonX-100]400 μL,搅拌均匀,冰上放置5 min,沸水浴5 min,然后加入5%(W/V)Chelex-100 200 μL,搅拌均匀,沸水浴8 min,吸取上清液用于数字PCR检测。
1.2.2 引物及探针设计 利用南京金斯瑞生物科技有限公司的在线引物设计工具(https://www.genscript.com/tools/real-time-pcr-taqman-primer-design-tool)在松材线虫16S rDNA序列上设计一组特异性引物和探针。
1.2.3 松材线虫微滴式数字PCR检测体系建立及评价 Bio-Rad微滴式数字PCR检测平台反应总体积为20 μL,包括:2×SuperMix 10 μL,上游引物0.9 μL(10 μmol/L),下游引物0.9 μL(10 μmol/L),探针0.2 μL(10 μmol/L),样品DNA 5 μL,去离子水3 μL。将PCR反应退火温度设置为8个温度梯度(49.9~65.0 ℃),筛选最佳退火温度,优化数字PCR反应体系。
以松材线虫基因组DNA为模板,利用设计的特异引物和探针进行数字PCR反应。具体操作步骤:将配制好的20 μL反应液加入到微滴发生卡的Sample孔位中,在微滴发生卡的oil孔位内加入70 μL微滴生成油,将微滴发生卡放入到微滴生成仪中生成微滴。微滴生成后,将生成的微滴移至96孔板中,封膜后进行PCR扩增。扩增反应完成后,将96孔板放入微滴读取仪中进行微滴读取和数据采集,通过软件生成的散点图判定反应最佳退火温度。
1.2.4 检测体系的特异性检测 以1.2.1所述的18株供试线虫的基因组DNA为模板,以优化得到的数字PCR反应体系及程序进行PCR检测,根据试验结果判定所建立的数字PCR体系的特异性。
1.2.5 检测体系的灵敏度检测 以松材线虫基因组DNA的10倍稀释液为模板,设8个浓度梯度(Sample 1~Sample 8),以优化好的反应体系及程序进行数字PCR检测,根据试验结果判断数字PCR的最低检出下限。
1.2.6 检测体系的重复性检测 以3个不同浓度的松材线虫基因组DNA为模板,按照上述优化好的反应体系及程序进行数字PCR检测。每个样品重复3次,根据试验结果计算每个样品的标准偏差(Standard deviation,SD)和变异系数(Coefficient of variation,CV)。根据变异系数判断数字PCR检测体系的重复性。
1.2.7 松木样品检测 取健康松木样品,每个取样50 mg,分别在其中加入1条、2条、4条、8条、16条松材线虫,共5个浓度梯度,制成模拟带虫样品。提取样品中的基因组DNA作为检测模板。
林间采集的枯死松树木样品16份,每份取样50 mg。提取总DNA为模板,按照优化后的数字PCR反应体系对上述样品进行检测。
2 结果与分析
2.1 松材线虫特异性引物探针设计
根据松材线虫16S rDNA序列设计了一组松材线虫特异性引物探针。P1904-F:CTACGTGCTGTTGTTGAG;P2057-R:TCCACCGGAGTAACTTAA;Prob e-1938:5′-FAM-CCGACAGATGAGA CCAGCCA-BHQ-3′。
2.2 数字PCR检测体系评价
松材线虫数字PCR反应最佳退火温度优化结果见图1,数字PCR反应最佳退火温度为55.0 ℃。从图2-A中可以看出,微滴可明显地分成两个部分,一部分的荧光值在4000~6000,另一部分的荧光值在0~500;从图2-B可以看出,阴性微滴的峰和阳性微滴的峰显著分开,中间没有干扰峰存在,说明本研究所建立的松材线虫微滴式数字PCR检测体系适用于松材线虫的检测。
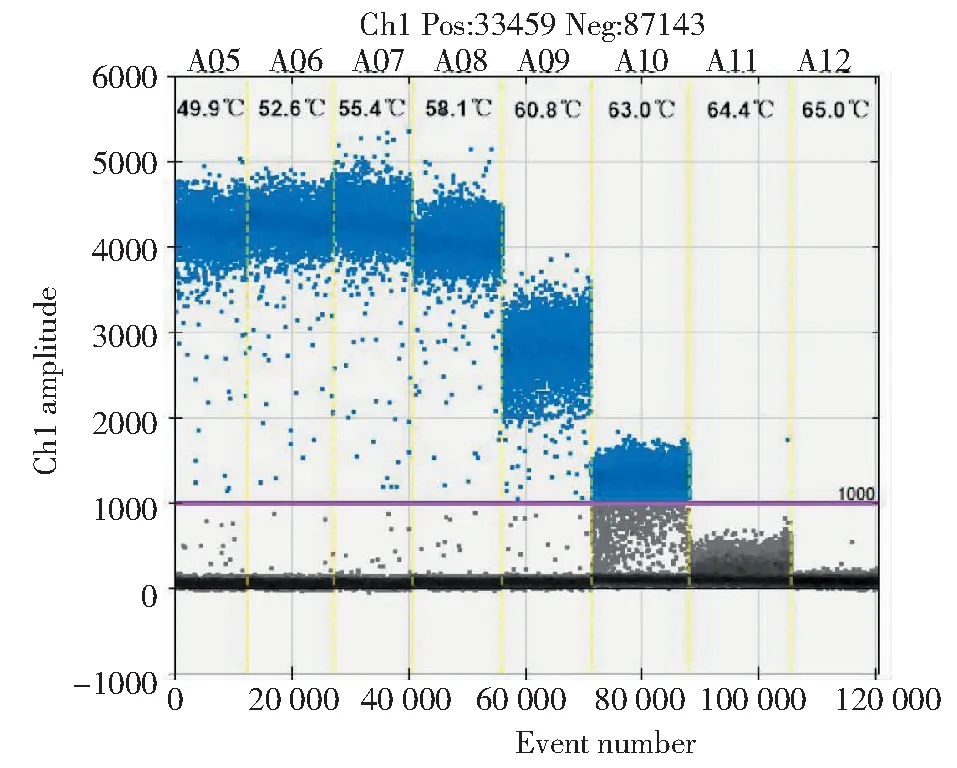
图1 数字PCR反应最适退火温度筛选Fig.1 Fluorescence amplitude plotted against annealing temperature gradient
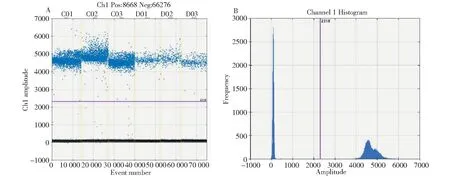
图2 松材线虫数字PCR一维散点图(A)和二维直方图(B)Fig.2 Representative 1-D plot(A) and 2-D plot(B) of dd-PCR reactions
2.3 松材线虫微滴式数字PCR的特异性检测结果
如图3所示,松材线虫样品检测结果均为阳性,而其他种线虫的样品检测结果都为阴性。本研究所建立的松材线虫检测体系可以特异地检出松材线虫,而对其他种属的线虫无扩增,满足特异性检出松材线虫的需要。
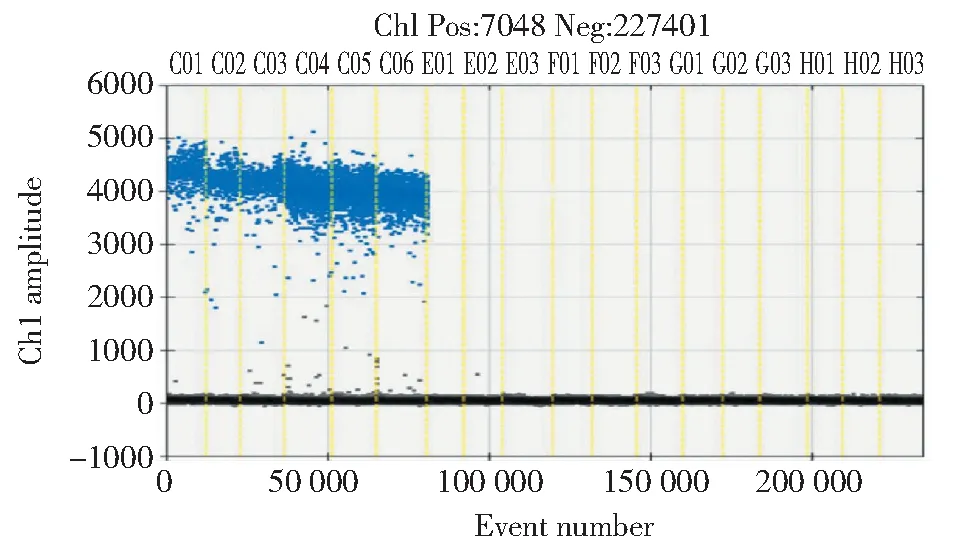
C01.BX-01;C02.BX-02;C03.BX-03;C04.BX-04;C05.BX-05;C06.BX-06; E01.BM-01;E02.BM-02;E03.BM-03;F01.BT-01;F02.BT-02;F03.BT-03;G01.BS-01;G02.AD-01;G03.AS-01;H01.AR-01;H02.AR-02;H03.CP-01图3 数字PCR检测体系的特异性检测Fig.3 Specificity test of dd-PCR detection system
2.4 数字PCR检测体系的灵敏度检测结果
松材线虫数字PCR灵敏度检测结果如图4所示,可以看出数字PCR对松材线虫基因组DNA的检出下限为0.51 copies/μL。根据上述数值,折算成每20 μL反应10.07个拷贝。
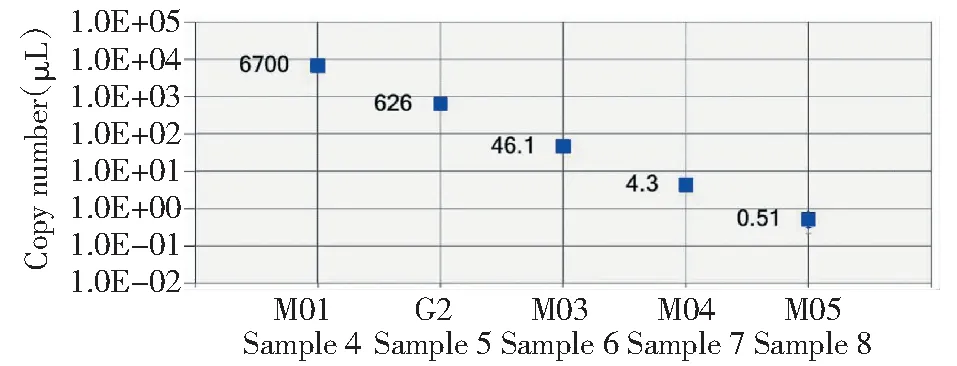
图4 数字PCR检测体系的灵敏度检测Fig.4 Sensitivity detection of dd-PCR detection system
2.5 数字PCR检测体系的可重复性检测
数字PCR检测体系的可重复性检测结果见表2,样品浓度越高,变异系数越低,但3个样品的变异系数(CV)均小于10%,说明数字PCR具有极高的可重复性。

表2 数字PCR检测体系的可重复性检测
2.6 微滴式数字PCR检测模拟带线虫松木样品
利用建立的松材线虫微滴式数字PCR检测体系检测了5份模拟加入线虫的健康松木样品,结果如图5所示。模拟带线虫的样品检测结果均为阳性,并且随着加入线虫数量增多呈现递增趋势;阴性对照样品和空白对照样品均显示为阴性。以上结果表明本研究所建立的松材线虫检测体系可以用于松木样品中松材线虫的检测。
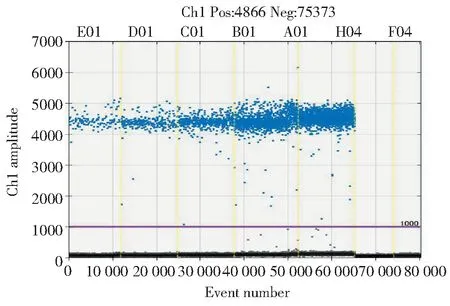
E01.1条线虫;D01.2条线虫;C01.4条线虫;B01.8条线虫;A01.16条线虫;H04.阴性对照;F04.空白对照E01.1 nematode;D01.2 nematodes;C01.4 nematodes;B01.8 nematodes;A01.16 nematodes;H04.Negative control;F04.No template control图5 模拟带线虫样品的数字PCR检测Fig.5 Detection of simulated samples with nematode by digital PCR
2.7 微滴式数字PCR检测林间病木样品
为了进一步验证本研究所建立的松材线虫检测体系的有效性,对林间采回的16份枯死松树样品进行检测,结果如图6所示。3号样品、9号样品、阴性对照和空白对照的检测结果呈阴性,其余样品均呈阳性。
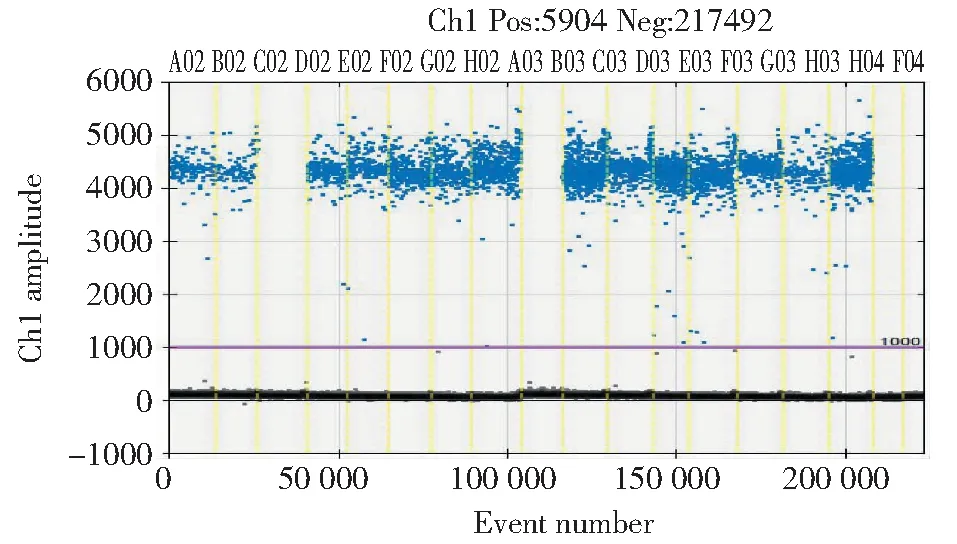
A02.1号样品;B02.2号样品;C02.3号样品;D02.4号样品;E02.5号样品;F02.6号样品;G02.7号样品;F02.8号样品;A03.9号样品;B03.10号样品;C03.11号样品;D03.12号样品;E03.13号样品;F03.14号样品;G03.15号样品;H03.16号样品;H04.阴性对照样品;F04.空白样品A02.Sample No.1;B02.Sample No.2;C02.Sample No.3;D02.Sample No.4;E02.Sample No.5;F02.Sample No.6;G02.Sample No.7;F02.Sample No.8;A03.Sample No.9;B03.Sample No.10;C03.Sample No.11;D03.Sample No.12;E03.Sample No.13;F03.Sample No.14;G03.Sample No.15;H03.Sample No.16;H04.Negative control;F04.No template control图6 林间枯死松树样品检测Fig.6 Dd-PCR amplification of PWN nematodes from wood samples
3 讨 论
微滴式数字PCR是数字PCR的一种,与传统PCR和实时荧光定量PCR不同。微滴式数字PCR在扩增前对反应管中的样品进行微滴化处理,将含有核酸分子的反应体系分成数万个纳升级的油包水微滴。每个微滴作为一个独立的PCR反应器,微滴在PCR管内经扩增仪扩增后,利用微滴检测仪对每个微滴进行检测,最后根据泊松分布原理及阳性微滴的个数,计算出靶分子的绝对起始拷贝数及浓度,从而实现样品中核酸的精确定量。自该核酸定量系统推出以来,已广泛应用于多个生物学研究领域,包括基因表达、表观遗传学及基因组学研究,动物疫病检查,水体生态研究和转基因成分检测分析等。目前,应用微滴式数字PCR系统对农林业有害生物的检测研究还较少。Zhao等[24]、Zhong等[25]和田茜等[26]分别建立了柑橘溃疡病、柑橘黄龙病、水稻细菌性条斑病和水稻白叶枯病的微滴式数字PCR检测体系,均取得了良好的检测效果。
本研究通过优化反应条件,建立了松材线虫微滴式数字PCR检测体系,通过检测松材线虫和其他线虫样品确定了该检测体系的特异性。在对该体系灵敏度检测时我们发现,在0.5个拷贝/μL浓度下,数字PCR显示为阳性,而在同一样品浓度下RT-qPCR的检测数值为36.5。在使用RT-qPCR检测松材线虫时,Ct值大于35即判定为阴性。由此可见,利用该体系检测松材线虫,可降低假阴性产生的几率。该检测体系在对低浓度样品定量时,能够直观地显示样品中的靶标分子拷贝数,因此该方法能够对样品中的靶基因进行精确定量。本研究进行的可重复性试验发现,3个样品中变异系数(CV)最高仅为9.12%,证明该体系除了能够精确测定出样品中靶基因的浓度外,还具有较高的重复性。再使用数字PCR对模拟加入线虫的松木样品和林间采回的枯死松木样品进行检测,检测结果可精确地反映样品中待测靶标的浓度。以上试验结果证明,该方法可用于对松材线虫的特异性检测。由于数字PCR具有可精确定量特性,本研究所建立的松材线虫检测体系亦可用于研究松材线虫在自然界中的分布、扩散规律、生活习性及其与传播媒介昆虫的互作。在研究中发现,当反应体系中靶标基因浓度大于20 000个拷贝/μL时,数字PCR即达到饱和,因而在对高浓度样品进行定量检测时,样品稀释是十分必要的。
4 结 论
本研究所建立的松材线虫微滴式数字PCR检测体系,具有特异性高、精确度高、可重复性好、能够进行精确定量等优点,尤其是在检测低浓度样品时,能够有效降低假阴性结果的出现。松材线虫目前是我国乃至全世界对松林危害最严重的病原物,本检测体系的建立为提高松材线虫控制水平、防止病害传播扩散、保护我国林业资源提供了一个新的可靠技术手段。
