自溶对双孢菇多糖体外抗氧化和抗肿瘤活性的影响
2022-09-30孙晓燕余君彤张广文彭喜春
孙晓燕,郭 慧,余君彤,张广文,彭喜春
(暨南大学理工学院,广东 广州 510000)
在食用菌中,双孢菇()是世界上种植最广泛也是消费最广泛的品种,被认为是一种重要的食用蘑菇,其具有高蛋白、低脂肪以及丰富的维生素和多糖。新鲜的双孢菇在贮存过程中会发生自溶,释放一些内源性酶来分解双孢菇多糖(polysaccharides,ABP),降解后的多糖具有不同的生物学活性。ABP是双孢菇中的主要生物活性化合物,具有抗氧化、抗肿瘤、降血糖和免疫调节的功能。用各种溶剂萃取的不同ABP均表现出强大的1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基和超氧化物清除能力、金属螯合能力和还原能力。Jeong等报道了ABP组分能抑制人乳腺癌细胞和鼠肉瘤细胞的生长。Zhang Yanqing等证实ABP可以促进RAW264.7细胞的增殖并改善脾脏指数和胸腺指数,说明ABP具有良好的免疫调节能力。
分子质量、溶解度、构象和化学修饰对于多糖的活性至关重要。研究发现,并非所有天然多糖都具有生物活性。改变多糖的分子质量可以增强其生物活性,酶法修饰是改变多糖分子质量的主要方法之一,通过酶催化多糖主链降解,使其分子质量降低。其中,内源性和外源性酶在多糖结构中起着重要作用。
目前的研究认为引起食用菌菌体自溶的主要原因有两个:第一是细菌作用于菌体组织引起自溶;第二是菌体组织内的自溶酶引起自溶。食用菌自溶过程中,细胞壁及细胞膜被破坏,一旦膜结构遭到破坏,细胞器的独立性被打破,其自身的酶被释放出来,与底物相互接触,迅速发生酶促反应。自溶酶引起的自溶与微生物的繁殖是相互促进关系,自溶导致组织发生破坏,汁液外流,引起微生物的大量繁殖,微生物的繁殖又进一步促进自溶过程。双胞菇子实体由于含水量较高,组织十分细嫩,且菌盖表面没有明显的保护结构,导致其易受病菌侵染和机械损伤等而发生自溶。自溶过程中双胞菇细胞的细胞壁、细胞膜等发生破裂,其自身的蛋白酶、聚糖酶及核酸等水解酶等被释放出来,将自身的蛋白、多糖及核酸降解,导致多糖等大分子物质的分子质量及聚合度等发生变化。自溶过程受到温度、自溶时间等的影响。
目前,微生物自溶作用的研究主要集中在酵母和霉菌属,酵母的自溶作用已在啤酒生产中得到广泛应用。然而,双孢菇菌体自溶是引起其采后损伤的主要原因,严重影响其食用品质和产品价值,可能带来巨大的经济损失。其自溶后活性物质的转化尚未得到深入的研究,尤其是多糖成分。因此,对双孢菇自溶后多糖生物活性的研究有利于促进双孢菇的利用,提高其商业价值。本实验以ABP为研究对象,探究自溶对ABP体外抗氧化和抗肿瘤活性的影响,以期为ABP的利用提供更多参考。
1 材料与方法
1.1 材料与试剂
双孢菇购自广州市天河区石牌蔬菜市场。
人宫颈癌细胞HeLa细胞株和人肝癌细胞HepG2细胞株由中国科学院昆明细胞库提供。
铁氰化钾 天津科密欧化学试剂有限公司;抗坏血酸、水杨酸 天津大茂化学试剂厂;DPPH 东京化成工业株式会社;CCK-8试剂盒 美国Abmole Bioscience公司;单糖标准品(包括葡萄糖、半乳糖、阿拉伯糖、甘露糖、鼠李糖、岩藻糖、木糖、核糖、葡萄糖醛酸和半乳糖醛酸) 上海源叶生物技术有限公司。
1.2 仪器与设备
FA1140电子天平 上海精密科学仪器有限公司;DGX-9053B-1电热鼓风干燥箱 上海福玛实验设备有限公司;4111水套式二氧化碳培养箱、UV-2600紫外全波段扫描仪、NanoDrop 2000紫外-可见分光光度计、Countess II细胞计数仪、Multiskan MK3全自动酶标仪 美国Thermo Fisher公司;HH-4恒温水浴锅 江苏金坛宏华仪器厂;GR60DR全自动高压灭菌锅 致微(厦门)仪器有限公司;GT16-3台式离心机 北京时代北利离心机有限公司;Axio Vert.A1倒置荧光显微镜 德国Carl Zeiss公司;DBS-100自动部分收集器 上海沪西分析仪器厂;2424蒸发光散射检测器、2695高效液相色谱(high performance liquid chromatography,HPLC)泵 美国Waters公司;1200 HPLC仪 美国Agilent公司。
1.3 方法
1.3.1 双孢菇的自溶作用和粗多糖的提取
实验分3 组,分别为空白组(不自溶)、45 ℃自溶组和50 ℃自溶组。将双孢蘑菇切碎后,加3 倍体积超纯水匀浆。调节pH值至6.5,使其在45 ℃下自溶4、8、12、16 h,在50 ℃下自溶4、8 h和12 h。每个条件制备4 个平行样品。自溶后100 ℃加热10 min使酶失活。采用热水浸提法提取多糖,100 ℃浸提两次,每次2 h,通过双层纱布过滤和真空抽滤收集粗多糖。将滤液浓缩至其原始体积的1/3备用。
1.3.2 多糖的制备
调节各组粗多糖溶液质量浓度均为25 mg/mL。在各组多糖溶液加入适量无水乙醇至溶液乙醇终体积分数为70%,4 ℃静置24 h,4 000 r/min离心15 min,得到70%乙醇醇沉的大分子多糖,用少量超纯水溶解后得到大分子多糖溶液。取上清液加适量无水乙醇至溶液乙醇终体积分数为80%,按照上述操作,进一步沉淀上清液,得到中分子多糖溶液。最后取剩余上清液加适量无水乙醇至乙醇终体积分数为90%,按照上述操作得到小分子多糖溶液。3 个组分分别命名为hABP---70、hABP---80和hABP---90,其中hABP表示自溶后的多糖组分,表示自溶温度/℃,表示自溶时间/h。ABP-Con-70/80/90分别代表空白组(未经过自溶的)多糖样品的3 个不同分子质量组分。将终质量浓度为0.4 g/100 mL木瓜蛋白酶加入多糖溶液中,50 ℃酶解2 h,4 000 r/min离心15 min除去酶沉淀。使用Sevag试剂((正丁醇)∶(氯仿)=1∶5)去除蛋白质。重复7 次Sevag试剂处理,直到完全去除白色絮状物。将每个组分溶解在ddHO中,并用孔径为0.22 μm的膜过滤,以除去细菌和杂质,得到多糖溶液样品。用蒽酮硫酸法测定每个样品的多糖质量浓度。以蒸馏水为对照,利用紫外全波段扫描仪在波长范围190~350 nm区间,设置扫描间距为1 nm,对多糖溶液进行扫描,观察除蛋白及核酸结果。
1.3.3 体外抗氧化活性测定
1.3.3.1 还原能力的测定
化合物的抗氧化活性与其还原能力呈正相关,可以通过测定样品的还原能力来反映抗氧化活性。铁氰化钾法是通过抗氧化剂将K[Fe(CN)]中Fe还原为Fe的原理来测定样品的还原能力。样品溶液稀释至0.3 mg/mL,将1 mL样品溶液与2.5 mL磷酸盐缓冲液(0.2 mol/L,pH 6.6)和2.5 mL 1 g/100 mL K[Fe(CN)]溶液混合均匀,50 ℃水浴反应20 min。迅速取出冷却后加入2.5 mL质量分数10%三氯乙酸溶液,混匀后3 500 r/min离心10 min。将3 mL上清液与0.6 mL 0.1% FeCl溶液和3 mL蒸馏水混合,并在700 nm波长处测定光密度,以此来表征还原能力。以蒸馏水作为空白对照,VC溶液作为阳性对照。
1.3.3.2 DPPH自由基清除率的测定
DPPH自由基是一种稳定的自由基,其清除率被广泛用于评价天然产物的抗氧化活性。抗氧化剂可将紫色的DPPH自由基还原为黄色的非自由基形式,使溶液的吸光度降低。DPPH自由基清除率的测定采用Lagouri等报道的方法稍作修改。取1 mL不同质量浓度样品溶液和3 mL DPPH-乙醇溶液(60 μmol/L)混匀后室温下避光反应30 min,在517 nm波长处测定吸光度。以VC溶液作为阳性对照。通过式(1)计算DPPH自由基清除率。
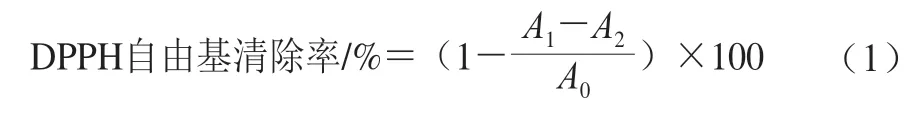
式中:表示样品溶液的吸光度;表示用无水乙醇代替DPPH-乙醇溶液的吸光度;表示用蒸馏水代替样品溶液的吸光度。
1.3.3.3 ABTS阳离子自由基清除率测定
2,2’-联氮-双(3-乙基苯并噻唑啉-6-磺酸)(2,2’-azinobis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)阳离子自由基清除能力通常被认为是评估样品抗氧化活性的另一个指标。ABTS与KSO溶液反应形成蓝绿色的ABTS阳离子溶液后,抗氧化活性物质与ABTS阳离子溶液反应导致颜色和吸光度发生变化,可以通过在734 nm波长处的吸光度来反映样品的抗氧化能力。ABTS阳离子自由基清除能力的测定根据Miliauskas等的方法稍作改动。首先制备ABTS母液:将3.848 g ABTS和0.662 g KSO溶于水后混合定容至1 L,使ABTS溶液终浓度为7 mmol/L、KSO溶液终浓度为2.45 mmol/L。在室温下避光反应12~16 h,得到ABTS母液。将ABTS母液用磷酸盐缓冲液(0.01 mol/L、pH 7.4,下同)稀释,使其在734 nm波长处的吸光度为0.70±0.02,得到ABTS工作液。将0.2 mL样品溶液和3.8 mL ABTS工作液混匀在室温下避光反应6 min,并在734 nm波长处测定吸光度。VC作阳性对照。通过公式(2)计算ABTS阳离子自由基清除率。并计算清除50%自由基所需的样品质量浓度(concentration for 50% of maximal effect,EC)。

式中:表示样品溶液的吸光度;表示用蒸馏水代替ABTS工作液的吸光度;表示用蒸馏水代替样品溶液的吸光度。
1.3.4 体外抗肿瘤活性测定
通过CCK-8法分析比较自溶前后双孢菇不同多糖组分对HepG2及HeLa细胞的毒性作用。将多糖浓缩物稀释至3 mg/mL后备用。HepG2和HeLa细胞在DMEM完全培养基(含10%(体积分数,下同)胎牛血清、1%青霉素链霉素溶液)中于37 ℃、5% CO的培养箱中静置培养。选取对数期的细胞接种到96 孔板上孵育24 h后,样品组用10 μL ABP溶液处理肿瘤细胞24 h。同时设置对照组(加入等体积不含多糖样品的细胞培养液)和空白组(加入等体积不含细胞的培养液),每个样品设置4 个复孔。处理结束后,弃去培养基,并用磷酸盐缓冲液洗涤细胞。随后每孔加入100 μL含10% CCK-8的DMEM培养基孵育3 h。测定每个孔在450 nm波长处的吸光度,并通过公式(3)计算细胞活性抑制率。并计算半抑制浓度(the half maximal inhibitory concentration,IC),即细胞活性抑制率为50%时所需的样品质量浓度。

式中:、、分别代表样品组、对照组和空白组的吸光度。
1.3.5 ABP的分离与纯化
将ABP溶液稀释至质量浓度为3 mg/mL。取5 mL溶液通过0.45 μm滤膜过滤,将其沿着柱壁缓慢滴加到平衡好的DEAE-52纤维素离子柱(3.0 cm×40 cm)中分离样品溶液中的hABP组分,依次用超纯水和系列浓度的NaCl溶液(0.1、0.2、0.3 mol/L和0.5 mol/L)洗脱,流速为1.0 mL/min。浓缩并收集主要洗脱液成分,然后在Sephadex G-100葡聚糖凝胶色谱柱(3.0 cm×40 cm)上用超纯水以0.5 mL/min的流速洗脱,收集多糖的洗脱组分,真空浓缩并透析。冷冻干燥备用。
1.3.6 ABP分子质量的测定
依照Cui Wuwei等的方法通过高效尺寸排阻色谱(high performance size exclusion chromatography,HPSEC)法测定hABP的分子质量。色谱条件:选用TSKgel G5000PWXL、TSKgel G3000PWXL二柱串联,同时配保护柱TSK PWXL Guard Column,以超纯水作为流动相等度洗脱,蒸发光散射检测器(evaporative light scattering detector,ELSD)漂移管温度设置为100 ℃,流速为1.0 mL/min,柱温40 ℃,进样量10 μL,分析时间为50 min。校准曲线绘制使用葡聚糖标准品(分子质量分别为1 000、5 000、12 000、50 000、150 000、270 000、670 000 Da)。根据已建立的葡聚糖标准品标准曲线方程计算出各组分的分子质量。
1.3.7 ABP的单糖组成分析
取0.2 mL 3 mg/mL样品溶液于水解管中,加入4 mol/L三氟乙酸1 mL,于120 ℃烘箱中水解2 h。取出后,氮气吹干。向吹干后的样品中加1 mL 0.5 mol/L 1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methylpyrazole-5-one,PMP)-甲醇溶液以及0.5 mL 0.3 mol/L NaOH溶液,70 ℃水浴60 min,冷却,加入0.5 mL 0.3 mol/L HCl溶液和0.5 mL氯仿振荡摇匀后静置20 min,弃去下层,萃取3 次,取水层过膜通过HPLC分析。混合单糖标准品用PMP标记后以相同方法进行HPLC分析。
色谱条件:SHISEIDO C柱(4.6 mm×250 mm,5 μm);柱温25 ℃;流动相:A相为0.1 mol/L KHPO溶液(pH 6.8),B相为乙腈,A相与B相的体积比为82∶18;流速为1.0 mL/min;检测器波长为250 nm;进样量10 μL。
1.4 数据统计与分析
所有实验均重复3 次以上。采用Origin 9.0软件绘制图形,SPSS 19.0软件进行单因素方差分析及EC和IC的计算,各组数据使用平均值±标准差表示,两组间比较采用检验,<0.05表示差异显著,<0.01表示差异极显著。
2 结果与分析
2.1 自溶对ABP聚合度的影响
如表1所示,与ABP-Con对比,45 ℃/50 ℃自溶后,70%乙醇醇沉得到的大分子多糖质量浓度显著下降;80%乙醇醇沉得到的中分子多糖质量浓度显著上升;90%乙醇醇沉得到的小分子多糖质量浓度无显著变化。推测双孢蘑菇在45 ℃及50 ℃条件下自溶过程中,其大分子多糖发生了一定程度的降解,一部分降解为中分子多糖(80%乙醇醇沉),所以导致自溶后70%乙醇醇沉得到的大分子多糖含量显著下降,中分子多糖可能降解成小分子多糖,但其发生降解的多糖含量总体少于大分子多糖降解所得到的中分子多糖含量,所以80%乙醇醇沉得到的中分子多糖质量浓度显著上升。
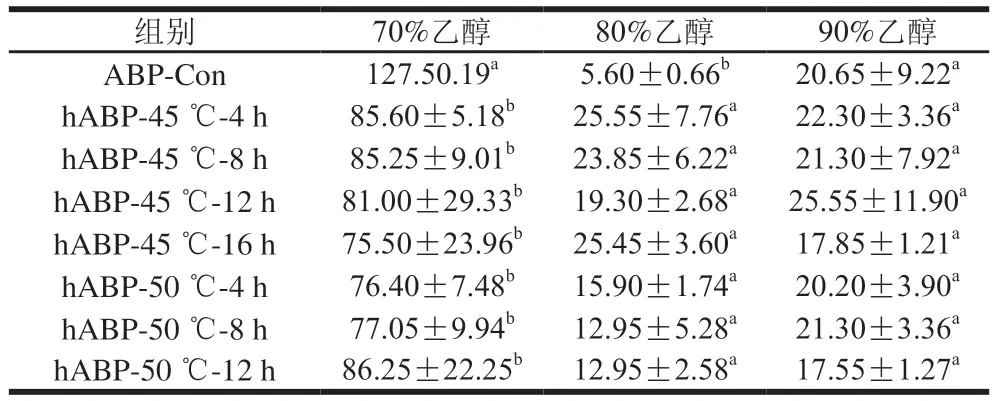
表1 不同自溶温度、时间及不同体积分数乙醇醇沉所得多糖质量浓度Table 1 Concentrations of polysaccharides obtained by ethanol precipitation after different periods of autolysis at differenttemperatures mg/mL
在45 ℃/50 ℃条件下,自溶不同时间后得到的大分子多糖、中分子多糖和小分子多糖质量浓度之间无显著性差异。推测自溶过程中的降解主要发生在自溶的前4 h,4 h后内源性酶无法进一步降解ABP,或只能轻微降解,所以未造成自溶不同时间段间多糖含量的显著性差异。考虑到时间、人力、经济等成本,后续实验的自溶时间全部采用4 h。对自溶4 h的各组分进行紫外扫描,结果见图1,各组分在260 nm和280 nm波长处均无吸收峰,证明多糖中已不含蛋白质和核酸。
图1 双孢菇大分子多糖(A)、中分子多糖(B)、小分子多糖(C)的紫外全波长扫描光谱Fig. 1 UV absorption spectra of polysaccharide samples of large- (A),medium- (B), and small-molecular-mass polysaccharides (C) from Agaricus bisporus
2.2 自溶对ABP体外抗氧化活性的影响
2.2.1 ABP的还原能力
由图2可知,与ABP-Con-90相比,hABP-45 ℃-90和hABP-50 ℃-90的还原能力显著增加(<0.05)。质量浓度为0.3 mg/mL时,相同自溶条件下70%乙醇醇沉得到的hABP还原能力最低,90%乙醇醇沉得到的hABP还原能力最高。
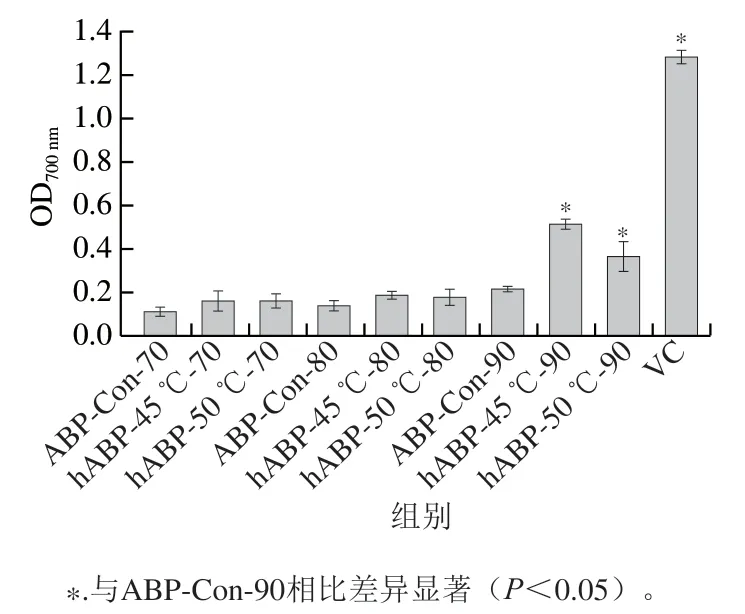
图2 不同温度自溶后hABP的还原能力Fig. 2 Reducing power of hydrolyzed ABP obtained after different periods of autolysis at different temperatures
2.2.2 DPPH自由基清除能力
不同质量浓度的阳性对照VC溶液及自溶前后的ABP溶液对DPPH自由基清除率的影响如图3所示,其EC如表2所示。在实验质量浓度范围内,各ABP对DPPH自由基都有较强的清除效果,且样品的质量浓度越大,对DPPH自由基的清除率越高。即所有ABP样品清除DPPH自由基都存在剂量依赖关系,且所有样品对DPPH自由基的清除能力都不及VC强。从表2可以看出,自溶后小分子多糖中hABP-45 ℃、hABP-50 ℃的EC相比ABP-Con显著减小,说明自溶后小分子多糖清除DPPH自由基的能力显著增强;中分子多糖中ABP-50 ℃的EC显著大于ABP-Con,ABP-45 ℃的EC略大于ABP-Con,说明50 ℃自溶后中分子多糖清除DPPH自由基的能力显著减弱,45 ℃自溶后清除DPPH自由基的能力则无显著变化;大分子多糖hABP-45 ℃的EC相比ABP-Con显著减小,而hABP-50 ℃与ABP-Con相比无显著差异,说明自溶45 ℃后大分子多糖清除DPPH自由基的能力显著增强。综上,45 ℃自溶4 h后的双孢菇各多糖组分清除DPPH自由基的效果较未自溶时总体有所增强,50 ℃自溶4 h后的双孢菇大分子多糖组分清除DPPH自由基的能力无明显增强,且小、中分子多糖组分清除DPPH自由基能力也比45 ℃自溶4 h低。
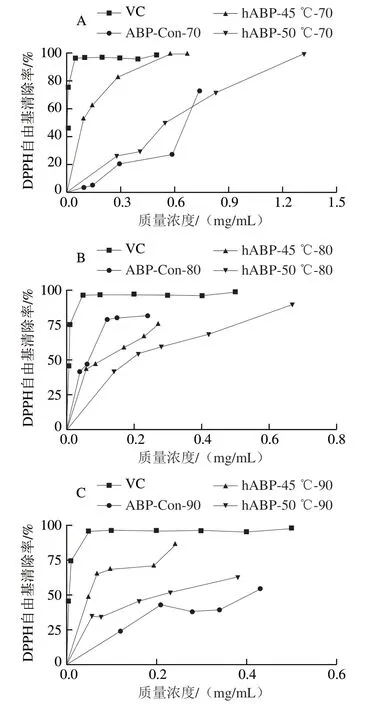
图3 双孢菇大分子多糖(A)、中分子多糖(B)、小分子多糖(C)对DPPH自由基的清除能力Fig. 3 1,1-Diphenyl-2-picrylhydrazyl radical scavenging capacity of large- (A), medium- (B), and small-molecular-mass polysaccharides (C)from Agaricus bisporus
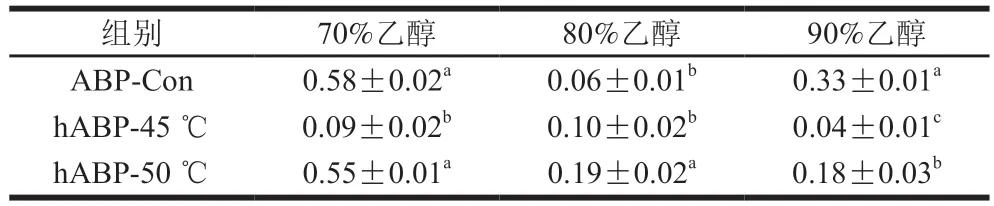
表2 DPPH自由基清除活性的EC50Table 2 Concentration for 50% of maximal effect for 1,1-diphenyl-2-picrylhydrazyl radical scavenging activity mg/mL
2.2.3 ABTS阳离子自由基清除活性
从图4可以看出,在实验质量浓度范围内各ABP对ABTS阳离子自由基都有较强的清除效果,且样品的质量浓度越大,对ABTS阳离子自由基的清除率越高。从表3可以看出,自溶后双孢菇小分子多糖ABTS阳离子自由基清除能力显著增强,自溶后中分子多糖ABTS阳离子自由基清除能力则显著下降;45 ℃自溶后大分子多糖ABTS阳离子自由基清除能力显著提高,而50 ℃自溶后大分子多糖清除能力反而显著下降。
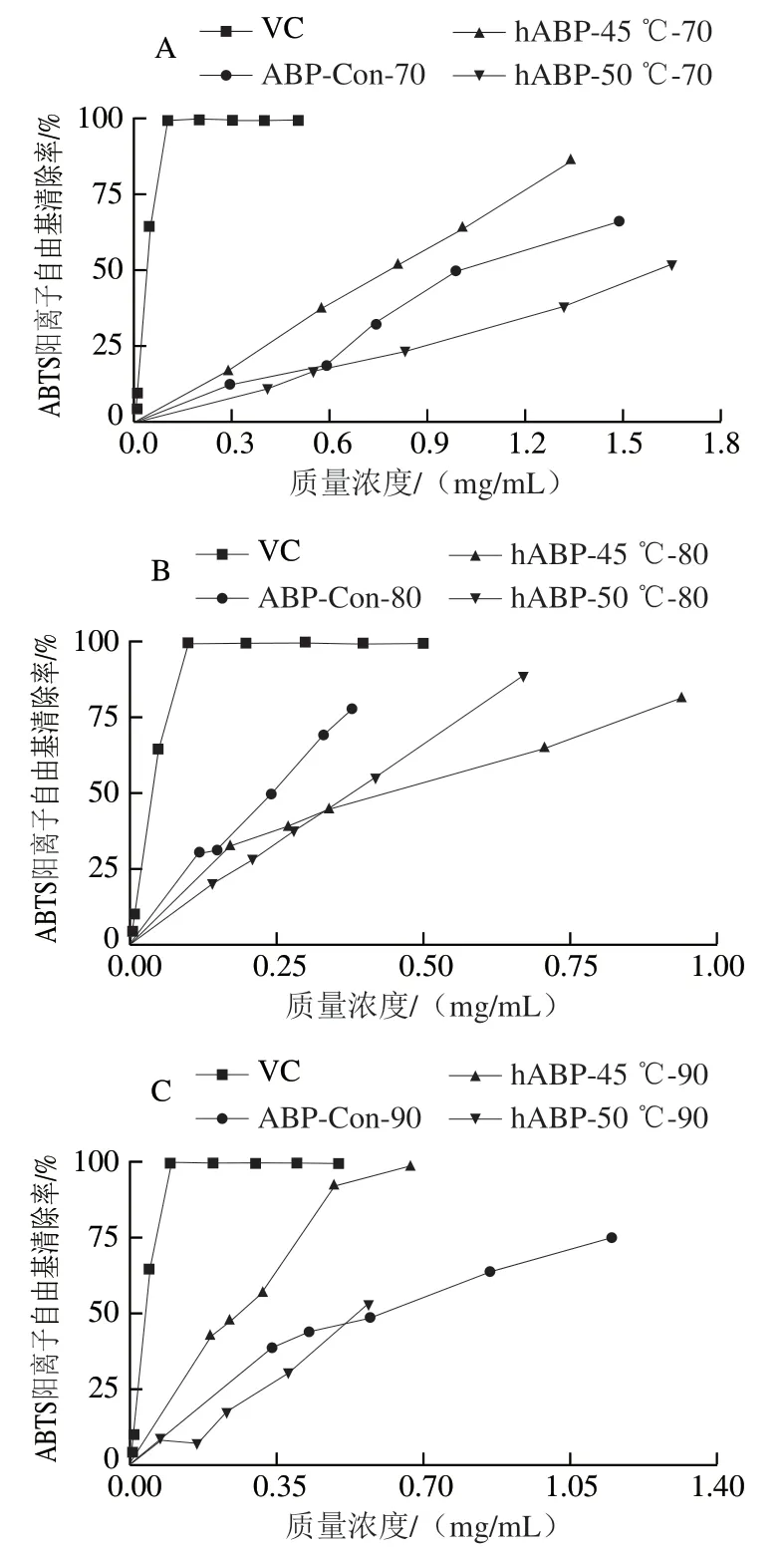
图4 双孢菇大分子多糖(A)、中分子多糖(B)、小分子多糖(C)对ABTS阳离子自由基的清除能力Fig. 4 2,2’-Azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) cation radical scavenging capacity of large- (A), medium- (B), and smallmolecular-mass polysaccharides (C) from Agaricus bisporus
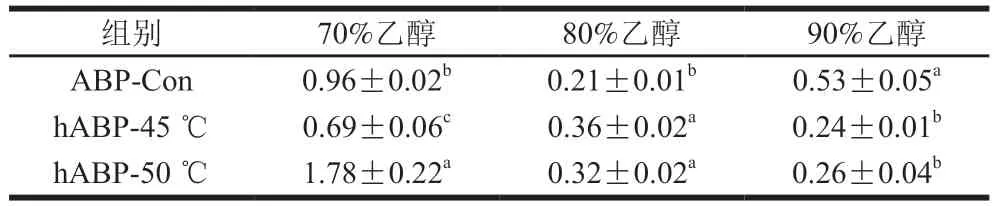
表3 ABTS阳离子自由基清除活性的EC50Table 3 EC50 values for 2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) cation radical scavenging activity mg/mL
2.3 自溶对ABP体外抗肿瘤活性影响
在9 种不同组分中,ABP-Con-70和hABP-45 ℃/50 ℃-70对两种肿瘤细胞的抑制作用均较弱,抑制率低于15%(图5),因此这3 个组分未在后续研究中继续使用。由图5可知,ABP-Con-80/90、hABP-45 ℃/50 ℃-80/90表现出对HepG2及HeLa细胞较强的抑制作用,抑制率均高于75%。如表4、5所示,自溶后,hABP-45 ℃/50 ℃-90对HeLa细胞抑制作用的IC显著降低(<0.05);hABP-45 ℃-80、hABP-45 ℃/50 ℃-90对HepG2细胞的IC显著降低(<0.05)。综合来看,自溶后hABP-45 ℃-90对HeLa和HepG2细胞具有最强的抑制活性。
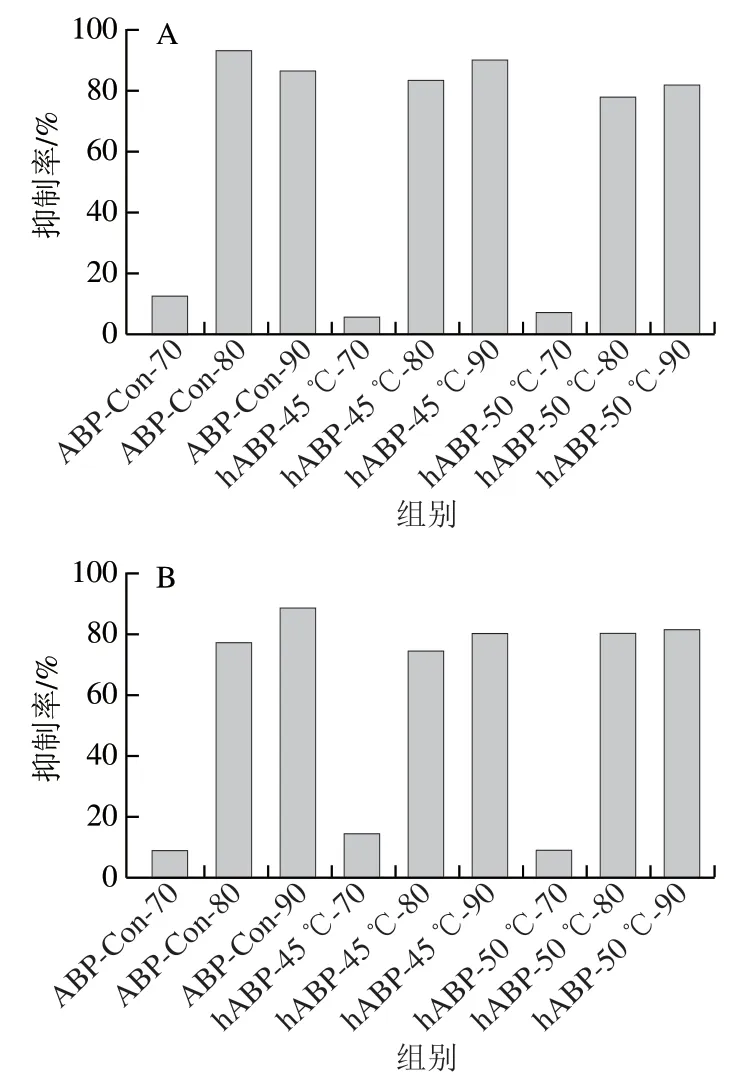
图5 各ABP对HeLa(A)、HepG2(B)细胞增殖的体外抑制作用Fig. 5 In vitro anti-proliferation effects of Agaricus bisporus polysaccharides on HeLa cells (A) and HepG2 cells (B)

表4 ABP对HeLa细胞体外抗增殖作用的IC50Table 4 IC50 values for in vitro anti-proliferation effects of Agaricus bisporus polysaccharides on HeLa cells mg/mL

表5 ABP对HepG2细胞的体外抗增殖作用的IC50Table 5 IC50 values for in vitro anti-proliferation effects of Agaricus bisporus polysaccharides on HepG2 cells mg/mL
2.4 ABP的分离纯化结果
选择具有良好抗氧化和抗肿瘤活性的组分hABP-45 ℃-80和hABP-45 ℃-90以及具有较差抗肿瘤活性的组分hABP-50 ℃-70进行分离纯化。所有组分分别通过纤维素DEAE-52阴离子交换柱分离。hABP-50 ℃-70的2 个组分(hABP-50 ℃-70-1和hABP-50 ℃-70-2)、hABP-45 ℃-80的1 个组分(hABP-45 ℃-80-1)和hABP-45 ℃-90的一个组分(hABP-45 ℃-90-1)通过超纯水和不同浓度NaCl溶液连续洗脱分别获得(图6)。在Sephadex G-100色谱柱上分离上述洗脱组分,每种组分进一步洗脱得到一个单一的洗脱峰,分别编号为hABP-50 ℃-70-11、hABP-50 ℃-70-22、hABP-45 ℃-80-11、hABP-45 ℃-90-11(图7)。

图6 不同ABP醇沉样品的DEAE-52洗脱曲线Fig. 6 Elution curves of ABP on DEAE-52 column


图7 不同DEAE-52洗脱组分的Sephadex G-100洗脱曲线Fig. 7 Sephadex G-100 elution curves of each DEAE-52 elution fraction
2.5 自溶且分离纯化后的ABP分子质量
多糖分子质量通过HPSEC法进行测定。根据葡聚糖标准品的洗脱曲线(图8A),建立洗脱时间()与分子质量对数值(lg)的标准曲线,得到标准曲线方程:lg=-0.375 7+10.603,=0.982 2。hABP-50 ℃-70-11、hABP-50 ℃-70-22、hABP-45 ℃-80-11和hABP-45 ℃-90-11的HPSEC洗脱曲线分别如图8B~E所示,其分子质量根据标准曲线方程计算,分别为77 375.42、88 861.78、1 281.70、619.72 Da。
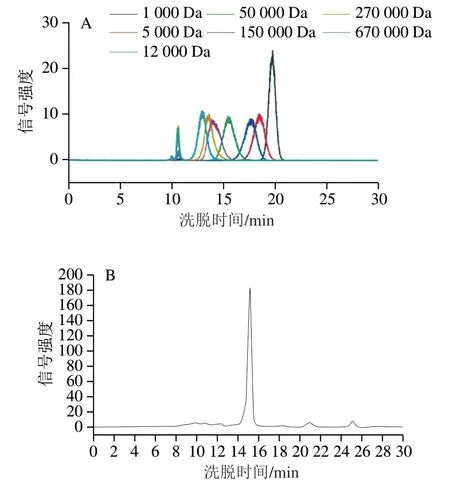

图8 葡聚糖和ABP组分的HPSEC-ELSD图谱Fig. 8 High performance size exclusion chromatography-evaporative light scattering detector profiles of dextran and hydrolyzed ABP
2.6 自溶后ABP的单糖组成
hABP-50 ℃-70和hABP-45 ℃-80均由甘露糖、核糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖和岩藻糖组成。对于hABP-50 ℃-70,葡萄糖和半乳糖的质量分数分别为42.49%和40.19%。hABP-45 ℃-80组分不仅含葡萄糖(67.54%)和半乳糖(10.00%),而且含较高比例的甘露糖(8.41%)和核糖(5.61%)。hABP-45 ℃-90中最主要的单糖是葡萄糖(60.09%)和半乳糖(10.68%),其他主要单糖是甘露糖(8.68%)、核糖(8.93%)和鼠李糖(9.16%)。此外,hABP-45 ℃-90不含岩藻糖(表6)。
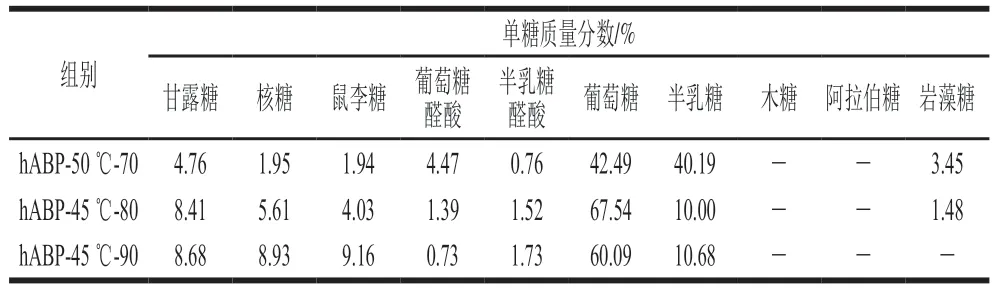
表6 hABP组分的单糖组成Table 6 Monosaccharide composition of hydrolyzed ABP fractions
3 讨 论
本实验通过探究自溶对ABP的体外抗氧化和抗肿瘤活性的影响,筛选具有强抗氧化性能和抗肿瘤能力的ABP组分,通过测定其分子质量和单糖组成,对不同的ABP组分进行对比研究。结果表明,在45 ℃或50 ℃自溶4 h后,高分子质量多糖的质量浓度显著下降,而中分子质量多糖的质量浓度显著增加(<0.05)。葡聚糖酶在食用真菌生命周期的所有阶段都具有活性,包括自溶阶段。而双孢菇的多糖提取物含有-(1,6)、-(1,4)连接的葡聚糖,-(1,6)连接的葡聚糖和甘露半乳聚糖。因此,推测葡聚糖酶类会降解ABP,从而导致多糖分子质量的降低。Feng Yuqin等总结了先前有关ABP的大量研究成果,发现通过不同提取方法获得的ABP平均分子质量不同。碱性多糖的分子质量为2.53×10~10.0×10Da;超声辅助提取多糖的分子质量为15.8×10Da,热水提取多糖的分子质量为4.7×10~20.0×10Da。而hABP-45 ℃-80-11和hABP-45 ℃-90-11的分子质量分别为1 281.70 Da和619.72 Da。这提供了ABP在自溶过程中降解的证据。
多糖自溶是一种内源性酶修饰作用,酶促修饰能够提高抗氧化活性、溶解性和抗菌活性。本实验结果表明,自溶后小分子质量和中分子质量多糖hABP的还原能力更强,大分子质量hABP的还原能力最弱;中、小分子质量多糖hABP的DPPH自由基和ABTS阳离子自由基清除率也高于大分子质量多糖。在自溶过程中,双孢菇释放内源性酶水解多糖,从而导致活性基团暴露和抗氧化能力的改变,多糖的分子质量降低并且抗氧化能力提高。这个结果与之前的报道一致。Li Shangshang等报道了双孢菇粗制水溶性多糖(crudepolysaccharide,CABP)对DPPH自由基清除率的EC为0.55 mg/mL。在本实验中,组分hABP-45 ℃-70、hABP-45 ℃-80和hABP-45 ℃-90对DPPH自由基清除能力的EC分别为0.09、0.10 mg/mL和0.04 mg/mL。抗氧化性能与EC呈负相关,因此hABP的DPPH自由基活性高于CABP。总之,由于自溶作用ABP的抗氧化活性得到提高。
双孢菇对部分癌症具有特定的预防作用,包括肉瘤、前列腺癌、乳腺癌和肝癌。本研究结果表明,ABP在45 ℃自溶4 h后,高分子质量多糖对HeLa和HepG2细胞活性的抑制作用较弱,而中分子质量和小分子质量多糖对HeLa和HepG2细胞活性的抑制作用较强。在45 ℃自溶4 h后,中、小分子质量hABP对两种肿瘤细胞的抑制作用明显增强。这与Tsai等的结果一致,表明自溶作用降低了多糖的分子质量并增强了抗肿瘤活性。特别是在45 ℃下自溶4 h后,小分子质量hABP的抗肿瘤活性得到显著改善。
He Jinzhe等报道CABP主要由甘露糖(36.68%),半乳糖(20.70%)和葡萄糖(34.85%)组成,还包含少量的阿拉伯糖(1.26%)、岩藻糖(1.10%)、鼠李糖(0.62%)、核糖(1.00%)和木糖(3.10%)。与CABP相比,本实验所提取的hABP还包含葡萄糖醛酸和半乳糖醛酸。hABP-45 ℃-90中核糖、鼠李糖和葡萄糖的质量分数远高于CABP,而半乳糖的质量分数较低,并且没有果糖。高糖醛酸含量多糖的抗氧化活性较强,这可能是—COOH的存在所致,糖醛酸残基可以改变相关共轭多糖的理化性质和溶解度。不同单糖含量的多糖表现出不同的生物活性,如鼠李糖含量较高的多糖可能生物活性更强;Su Yue等报道了草菇多糖的总抗氧化能力与岩藻糖和半乳糖含量呈显著负相关。因此,自溶作用可能通过从ABP中去除一些单糖(例如岩藻糖)来增强抗氧化活性。
综上所述,自溶过程使ABP发生降解,引起其分子质量的变化,提高了ABP的抗氧化和抗肿瘤活性。实验分离并纯化出具有最佳抗氧化活性和抗肿瘤活性的组分hABP-45 ℃-90-11,主要成分是葡萄糖、半乳糖和鼠李糖,其分子质量约为619.72 Da。本研究可为自溶ABP的利用提供一定的参考。
