Fe2+-PO42-混合溶液体系再生电池级FePO4工艺研究
2022-09-29方秀利朱玲玲杜进桥
张 祥,方秀利,朱玲玲,杜进桥
(1.江苏中天科技股份有限公司,江苏南通 226400;2.深圳供电局有限公司,广东深圳 440303)
2015 年起,磷酸铁锂电池因其综合性能优异而被广泛应用于电动车市场。随着近几年我国电动车行业市场占有量暴增,以及达到寿命年限的磷酸铁锂电池即将大规模退役[1],预计未来磷酸铁锂电池的报废量将持续上涨[2]。对磷酸铁锂正极材料中的Fe、Li 和P 等有价元素进行回收处理,不仅可以缓解资源短缺和浪费的问题,还可以避免因随意堆弃造成的二次环境污染,因此开发废旧磷酸铁锂正极材料的低成本、高效回收利用技术意义重大[3-5]。
目前常规的磷酸铁锂电池正极材料处理的方法有高温再生[6-7]、生物浸出[8]、湿法浸出[9-11]等方法,其中高温再生工艺能耗高、杂质含量影响较大、再生材料电化学性能差,生物回收技术不成熟、周期长且浸出条件难以控制。相比之下,湿法回收具有技术成熟、回收率高等优势,可实现较高的金属回收率,从而得到高纯度的前驱体材料[12]。但目前湿法处理废旧磷酸铁锂电池工艺均只选择性回收了有价元素Li,造成占电池质量35%以上的磷酸铁渣大量堆存,环境负荷较大,因此铁、磷资源化成为回收废旧磷酸铁锂电池材料的关键。分析原因,一方面是由于Fe、P 的回收价值不高,另一方面是处理过程中一般得到的是Fe 和P 的混合溶液,与传统制备FePO4过程中铁源和磷源分别加入反应体系不同,造成现有的FePO4制备工艺无法兼容。
基于此,本文在前期湿法浸出得到Fe2+-PO43-混合溶液的基础上,研究开发了以Fe2+-PO43-混合溶液为原料的FePO4制备技术(不同批次Fe2+-PO43-混合溶液成分稳定),并优化了相关工艺条件,所得FePO4达到了电池级要求,以其为原料制备的LiFePO4正极材料质量好、无杂相、容量高。
1 实验
1.1 实验材料
以前期湿法处理得到的Fe2+-PO43-混合溶液为原料,以NH4H2PO4为补充磷源,其中Fe2+-PO43-混合溶液各成分含量分别为Fe 113.28 g/L、PO43-56.35 g/L、Al 0.005 65 g/L、Cu 0.001 6 g/L、F 0.012 g/L。
1.2 实验方法
单滴法制备FePO4过程中,首先对Fe2+-PO43-混合溶液采取稀释处理,并按照铁磷比1∶1~1.05(摩尔比)计算补磷量,采用NH4H2PO4作为补充磷源进行补磷,使净化液中铁磷比维持在1∶0.97~1.02(cFe=0.6 mol/L)。
为避免引入其他杂质离子,实验过程中采用H3PO4控制体系pH,待体系pH 达到要求并稳定后,再加入H2O2促进Fe2+氧化成Fe3+,陈化一定时间后得到白色悬浊液,对悬浊液进行过滤、洗涤和干燥可得到白色产物,在650 ℃下煅烧4 h 得到FePO4产品。相关工艺的控制条件复杂,影响因素较多,因此本实验对其主要工艺参数(合成温度、铁离子浓度、体系pH、H2O2过量系数及滴加速度、搅拌速度、陈化时间)进行了实验研究,相关工艺流程如图1 所示。
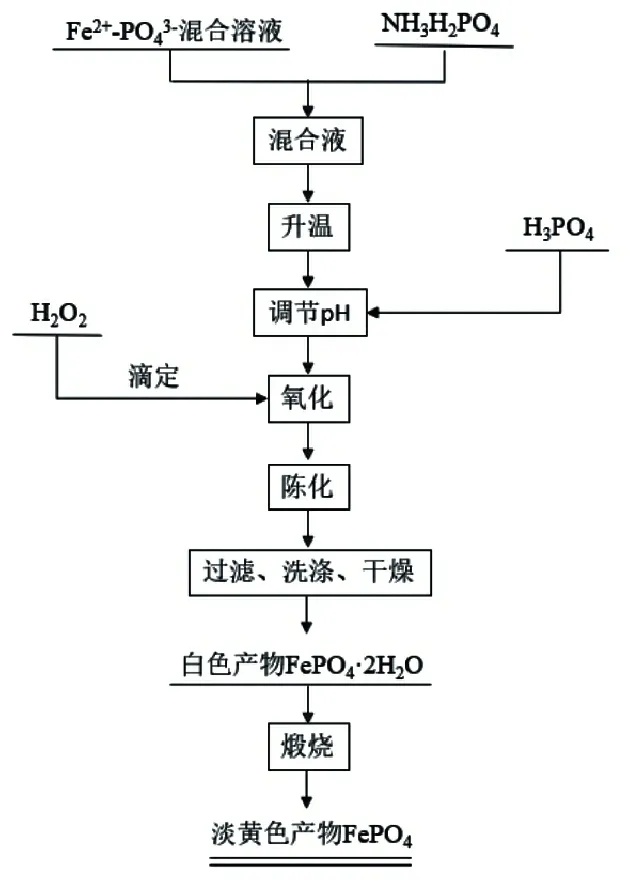
图1 单滴法制备FePO4前驱体工艺流程
1.3 分析方法
采用TESCAN MIRA3 型扫描电子显微镜和日本理学EMPYREN 型X 射线粉末衍射仪对产物的微观形貌和物相组成进行分析。采用SALD-2300 型粒度分析仪对不同实验条件下所得FePO4前驱体产品粉末的粒径分布进行测试。采用美国麦克ASAP2460 型比表面积分析仪测定不同实验条件所得产品颗粒的比表面积。采用汇美科LABULK 0335 型振实装置对所得产品进行振实密度测量实验,并通过公式ρbt=m0/V计算样品粉末的振实密度,式中:ρbt为振实密度,g/cm3;m0为粉体质量,g;V为振实后粉体的体积,cm3。采用FYL-YS-430L型锂离子电池充放电测试设备对FePO4产品制备的扣式电池的循环性能进行检测。
2 结果与讨论
2.1 单滴法制备FePO4过程条件优化
2.1.1 合成温度
单滴法制备FePO4的过程中,不同反应温度对Fe-P 沉淀率和产物铁磷比的影响如图2 所示。由图2 可知,Fe 和P 的沉淀率随着反应体系温度升高而升高,在温度升至90 ℃时达到峰值,此时Fe 和P 的沉淀率分别为98.21%和97.56%,且制备的FePO4铁磷比为0.974,符合实际生产的标准(铁磷比为0.965~0.985)。这是因为H3PO4为弱酸,反应温度的升高有利于解离过程,使溶液中的PO43-浓度增加,从而促进PO43-与Fe3+反应,加快FePO4的成核速度。
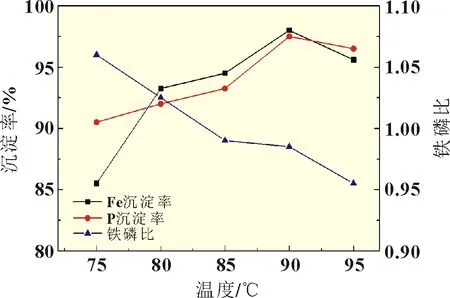
图2 反应温度对沉淀率及产物铁磷比的影响
2.1.2 体系浓度
净化液中主元素Fe 和P 的浓度分别约为2 和0.6 mol/L,共沉淀制备前,需要对净化液进行稀释和补磷,使Fe 浓度满足反应的要求,且对应P 元素以NH4H2PO4的形式补入。本文以Fe 浓度为参考,控制铁磷比维持在1∶0.97~1.02 范围,研究了不同反应体系浓度对共沉淀过程中晶核形成、长大的影响情况,实验结果如图3 所示。

图3 不同反应体系浓度下制备得到FePO4的SEM图
由图3 可知,当体系铁浓度较小时,达到过饱和度后,较低的铁浓度导致体系成核反应速率慢,晶核形成数量少,产物粒径均一性差,存在尺寸较小的纳米颗粒;随着体系浓度的过大,产物一次颗粒长大,团聚情况较严重。当反应体系浓度为0.6 mol/L 时,实验所得FePO4颗粒均匀,团聚情况良好。为进一步探究体系浓度对产物质量的影响,实验中对不同体系浓度下制备所得的FePO4进行了粒径分布、比表面积和振实密度测试,测试结果如表1 所示,由表中数据可知,在反应体系中Fe2+浓度为0.6 mol/L 时制备的FePO4振实密度最佳。
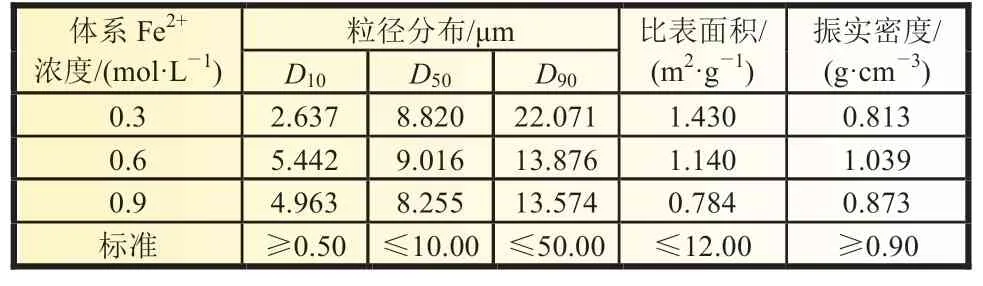
表1 不同浓度反应体系制备的FePO4 理化性能
2.1.3 体系pH
未经稀释处理的净化液在常温下pH 约为0.8~1.0,经稀释后升温至90 ℃时,体系pH 约为2.5~2.8。本文探究了反应体系pH 对产物微观形貌及理化性能的影响,结果如图4 和表2 所示,当体系pH 低时,颗粒表面溶蚀严重,体系pH 高时,表面一次颗粒较为尖锐,且当体系pH=1.8 时,制备的样品粒径分布、比表面积和振实密度均符合标准要求。
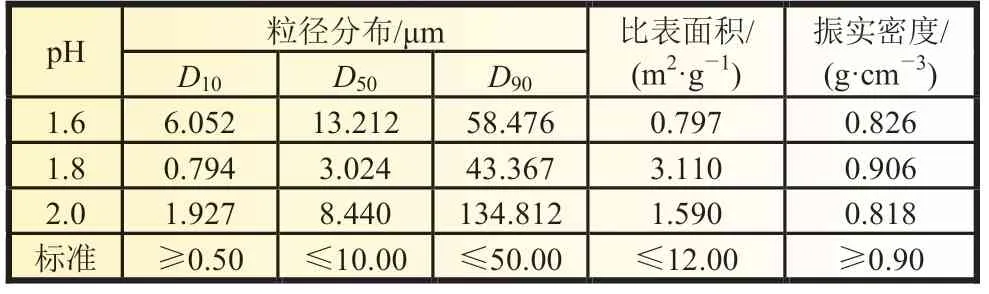
表2 不同体系pH 制备的FePO4 理化性能

图4 不同反应体系pH制备得到FePO4的SEM图
2.1.4 H2O2过量系数及滴加速度
实验中选择H2O2作氧化剂,将混合液中的Fe2+快速氧化为Fe3+,从而与磷酸根结合形成FePO4·nH2O 晶核。因高温下H2O2易分解,实验中为了减少分解损失,采用了蠕动泵进料。在优化进料方式的前提下,实验探究了H2O2的用量及滴加速度对FePO4·nH2O 晶核形成的影响,实验参数及实验结果如表3、表4 所示。数据显示实验组E5、E6、E8、E9 产物符合振实密度和粒径D90标准,且H2O2滴加速度越快,成核反应越迅速,同时晶粒生长受到一定程度的抑制,使得到产物的粒径相对较小,比表面积相对较大;但速度过快,可能导致反应不充分,Fe2+氧化不完全,因此得到最佳H2O2溶液过量系数为1.2,滴加速度为10 mL/min。
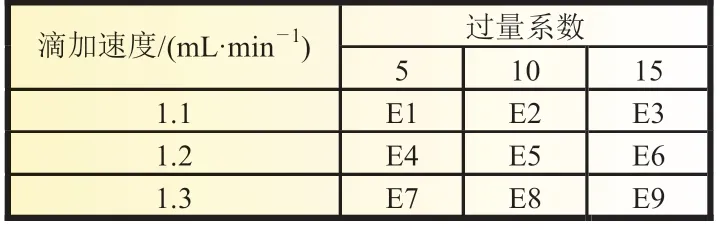
表3 H2O2 过量系数和滴加速度实验参数
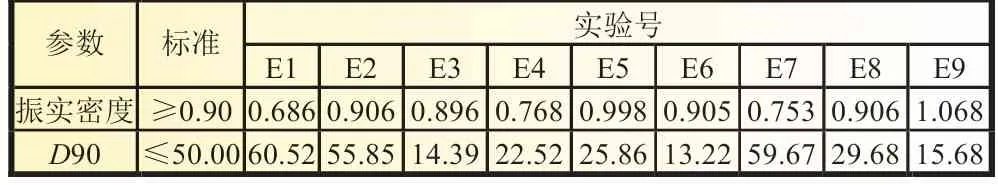
表4 不同H2O2 过量系数和滴加速度实验结果
2.1.5 搅拌速度的影响
在控制实验温度90 ℃、体系浓度0.6 mol/L、pH=1.8、H2O2过量系数1.2、滴加速度10 mL/min 的固定条件下,考察了搅拌速度对FePO4微观形貌及其理化特性的影响,实验结果如图5 和表5 所示。结果表明:搅拌速度对产物粒径分布、比表面积和振实密度有明显影响,搅拌速度过低时,原料分子因为动能不够大而导致反应粒子接触不够充分,部分反应未能充分进行,二次颗粒粒径明显长大,且比表面积和振实密度过小;转速增加,颗粒之间碰撞、摩擦加剧,二次颗粒的粒径减小,比表面积和振实密度提高,但过快的搅拌速度反而会使产物颗粒的比表面积和密度降低,这可能与颗粒表面过于光滑有关。因此,选择650 r/min 为宜。

图5 不同搅拌速度下制备得到FePO4的SEM图
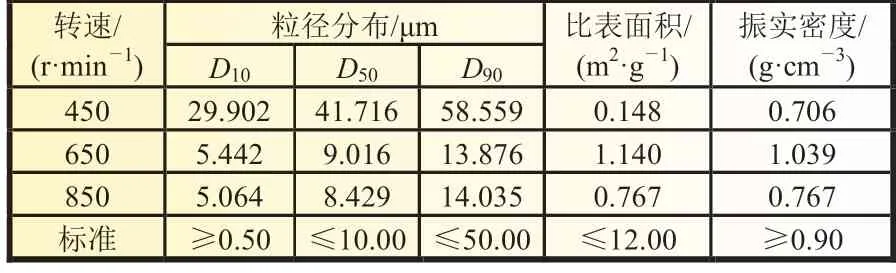
表5 不同转速下制备的FePO4 理化性能
2.1.6 陈化时间
反应进料完毕后,溶液呈黄色,需要一定的陈化时间,当溶液变白,则说明组分转变为FePO4·2H2O,陈化期间样品一次颗粒发育聚集,二次颗粒长大。实验中探究了陈化时间对样品的影响,不同陈化时间下制备的磷酸铁产物SEM 图如图6 所示。实验发现,铁磷比越小,陈化所需时间越短,当固定铁磷比为1∶0.97~1.02 时,所需陈化时间只要2 h 即可,延长陈化时间对磷酸铁颗粒的形成影响较小,从提高生产效率的角度出发,陈化时间选择2 h。

图6 不同陈化时间制备得到FePO4的SEM图(铁磷比1∶0.972)
2.2 产品性能检测
通过上述研究,获得了以Fe2--PO43-混合溶液为原料制备FePO4的优化条件:温度90 ℃、体系Fe2+浓度0.6 mol/L、pH=1.8、H2O2过量系数1.2、滴加速度10 mL/min、陈化时间2 h。本文对在此条件下制备出的FePO4产品的相关性能进行了评测。
2.2.1 FePO4产品物相和成分
所得FePO4产品的X 射线衍射(XRD)图谱如图7 所示,所有的尖峰与标准卡片一致,表明所得样品为纯FePO4,无任何杂相。
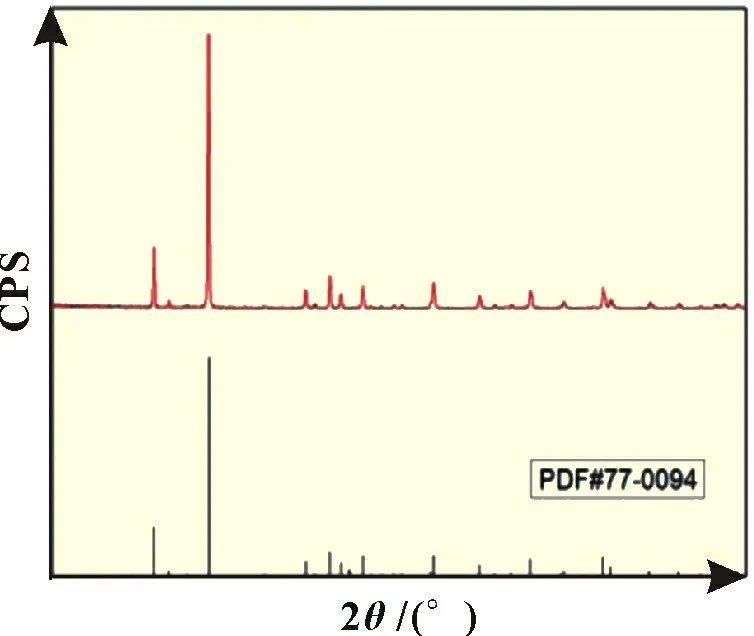
图7 Fe2+-PO43-混合溶液制备的FePO4 XRD图谱
净化液制备的FePO4主成分及其他杂质含量检测结果如表6 所示,无论是主成分Fe 和P 含量、铁磷比,还是其他杂质元素的含量,皆满足Q/NT 010-2018 电池用磷酸铁标准。
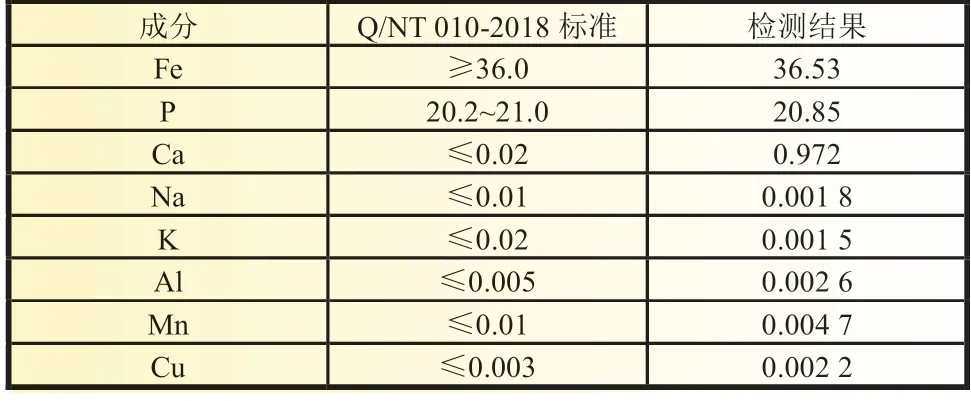
表6 Fe2+-PO43-混合溶液制备的FePO4 成分含量检测 %
2.2.2 材料充放电性能检测
利用单滴法湿法合成的FePO4前驱体混合葡萄糖经酒精球磨后置于60 ℃烘箱干燥5 h,烘干后的样品在氮气保护下于500 ℃煅烧10 h,再加入与铁等摩尔比的Li2CO3,球磨1 h,球磨所得产物在氢-氮混合气保护下于700 ℃煅烧10 h 得到LiFePO4[13]。按照质量比7∶2∶1 称 取LiFePO4、乙炔黑和PVDF,加NMP 研磨,涂片制得正极片,装配2025 扣式电池。在0.5C下测试该扣式电池的循环性能,结果如图8 所示,该电池充放电比容量在100 个循环的电化学性能测试中能够保持在147.6 mAh/g左右,且循环100周后容量保持率约为98.4%。
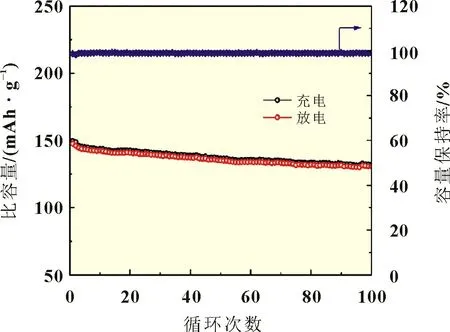
图8 湿法合成FePO4样品循环性能(0.5 C)
3 结论
本文以废旧磷酸铁锂电池浸出除杂所得净化液(Fe2--PO43-混合溶液体系)为原料,开发了单滴法湿法合成FePO4工艺,达到高效回收废旧磷酸铁锂电池中有价成分P 和Fe 的目的。
通过条件实验,获得单滴法制备FePO4的最佳实验条件为:温度90 ℃、体系Fe2+浓度0.6 mol/L、pH=1.8、H2O2过量系数1.2、滴加速度10 mL/min、陈化时间2 h。
采用在最佳工艺条件下制备的FePO4烧结LiFePO4正极材料,所装配电池的0.5C充放电比容量保持在147.6 mAh/g左右。
