生物信息学技术筛选乳腺癌他莫昔芬耐药关键基因及相关通路分析
2022-09-29李雷雷徐文漭王光辉杨举伦
李雷雷,徐文漭,王光辉,杨举伦
乳腺癌是常见的恶性肿瘤之一,在全球范围内其发病率位居女性恶性肿瘤之首,病死率位居第2位。根据ER、PR及HER-2表达水平,乳腺癌主要分为三种不同亚型:ER和(或)PR阳性型、HER-2过表达型及三阴型,其中ER阳性乳腺癌占乳腺癌的70%以上,内分泌治疗是ER阳性乳腺癌综合治疗必不可少的部分,无论早期还是进展期ER阳性乳腺癌,均能从内分泌治疗中获益[1]。他莫昔芬是最常用的选择性ER调节剂,通过与雌激素竞争性结合ER发挥抑癌作用,其是绝经前ER阳性乳腺癌患者的一线治疗药物[2]。他莫昔芬可将ER阳性乳腺癌的10年复发风险降低约1/2,死亡风险降低1/3[3-4]。虽然近年来不断有新的、疗效确切的内分泌药物出现[5],但他莫昔芬因其疗效显著且价格便宜被广泛运用。研究发现,50%ER阳性乳腺癌在内分泌治疗过程中存在原发或获得性耐药,其中30%病例表现为对他莫昔芬耐药[6-7],接受标准5年他莫昔芬治疗的1/3乳腺癌患者在15年内复发[8],说明他莫昔芬耐药现象普遍存在,也是临床工作亟待解决的一大难题。本文应用生物信息学技术筛选乳腺癌他莫昔芬耐药相关基因并分析相关通路,为预测乳腺癌潜在治疗靶点奠定基础。
1 材料与方法
1.1 乳腺癌他莫昔芬耐药微阵列数据集采集和处理利用关键词“breast cancer;tamoxifen-resistant”在GEO基因数据库下载GSE67916和GSE96670基因表达谱。GSE67916[9]的实验平台为GPL570(Affymetrix human genome U133 plus 2.0Array)其中包括10份tamoxifen-resistant标本(MCF-7R)和8份tamoxifen-sensitive(MCF-7S)标本。GSE96670[10]的实验平台为GPL96(Affymetrix Human Genome U133A Array),其中包括6个tamoxifen-resistant标本(MCF-7R)和6个tamoxifen-sensitive(MCF-7S)标本。
1.2 差异基因的获取与分析使用在线分析软件GEO2R对基因进行分组,分为tamoxifen-resistant样本组和tamoxifen-sensitive样本组。设置P值和差异倍数(foldchange,FC)进行差异基因的筛选。当P<0.05,∣log2FC∣>1时差异有统计学意义。
1.3 差异基因的GO和KEGG分析使用DAVID(https://david.ncifcrf.gov/)在线工具对所选差异基因进行GO分析;使用KOBAS在线分析数据库(http://kobas.cbi.pku.edu.cn/)对差异基因进行京都基因与基因组百科全书(KEGG)通路富集分析,设置P<0.05。
1.4 差异基因的PPI网络构建利用STRING(http://string-db.org/)来识别乳腺癌他莫昔芬耐药中差异基因所编码蛋白质之间的相互作用和通路关系,并利用Cytoscape(MCODE)筛选关键基因。
2 结果
2.1 乳腺癌他莫昔芬耐药样本中差异基因的鉴定利用GEO2R在线分析工具对数据集进行基因差异表达分析。该工具借助R和Limma软件完成分析过程,得到差异表达基因(differentially expressed genes,DEG)(校正后P<0.05,∣log2FC∣>1)。鉴定出DEG(GSE67916中有1 349个,GSE96670中有279个)。2个数据集之间的重叠包含132个基因(图1),由他莫昔芬耐药样本和他莫昔芬敏感样本之间的103个上调基因和29个下调基因组成。
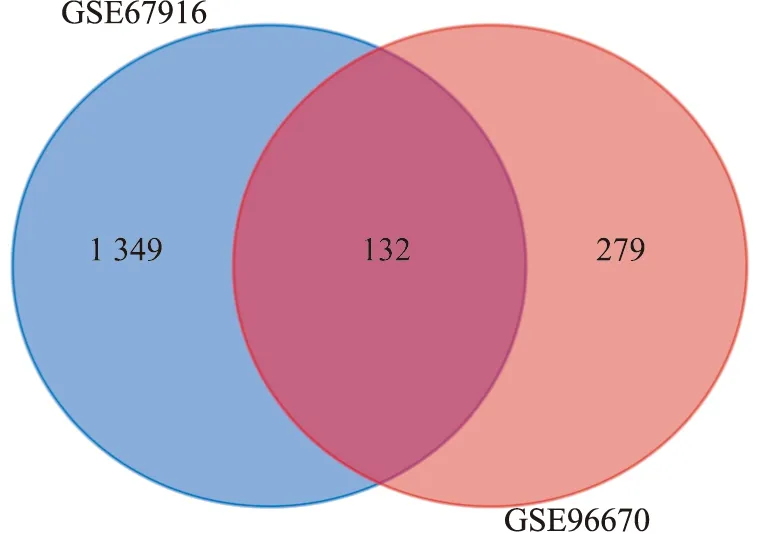
图1 两个数据集基因交集韦恩图
2.2 GO和KEGG分析利用DAVID在线分析工具对两个乳腺癌他莫昔芬耐药数据集中差异表达基因的生物过程、细胞组成和分子功能进行GO分析,结果发现其功能富集于蛋白质同二聚化活性、蛋白质结合、色氨酸代谢、ATP结合、胞外外泌体、对药物治疗的反应、细胞凋亡的正负调控、基因表达的正调控、细胞迁移的正调控。最主要的是细胞黏附、细胞质外泌体、蛋白结合功能。KEGG分析显示:差异基因的代谢主要集中在内吞作用、癌蛋白聚糖、色氨酸代谢、雌激素信号、卵巢类固醇生成通路,最主要在内吞通路、癌蛋白聚糖和雌激素信号通路(表1,图2、3)。
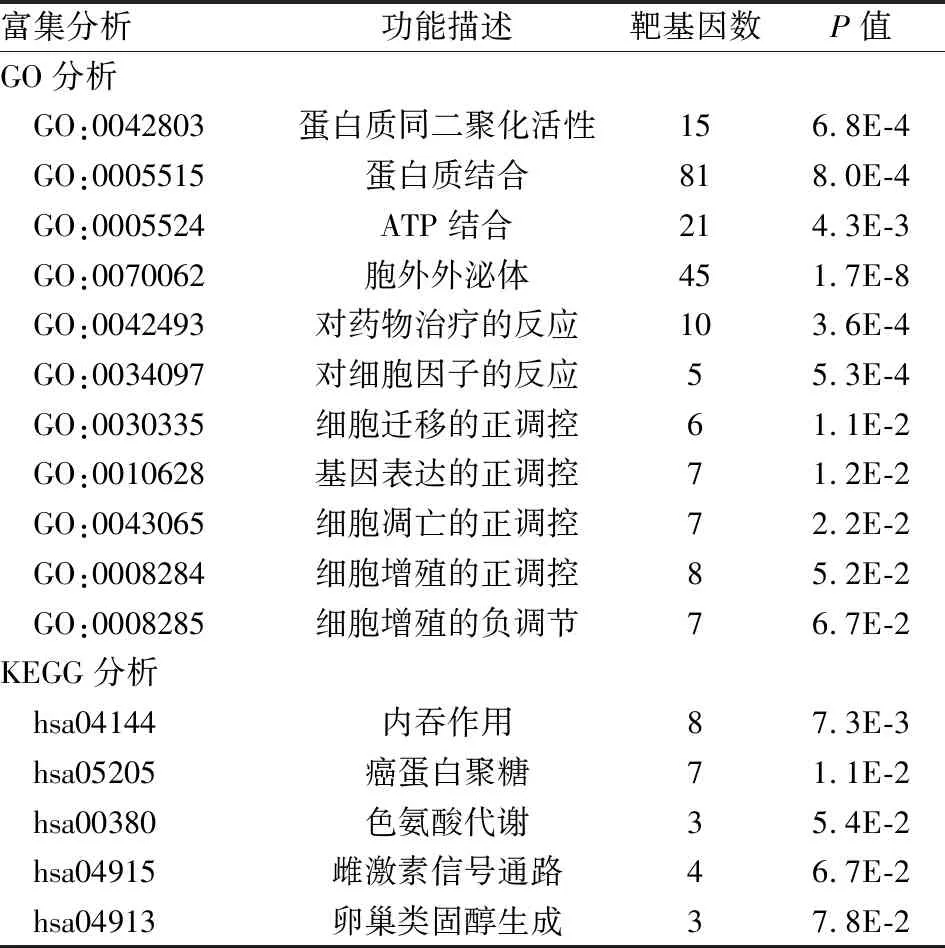
表1 差异表达基因的GO及KEGG分析
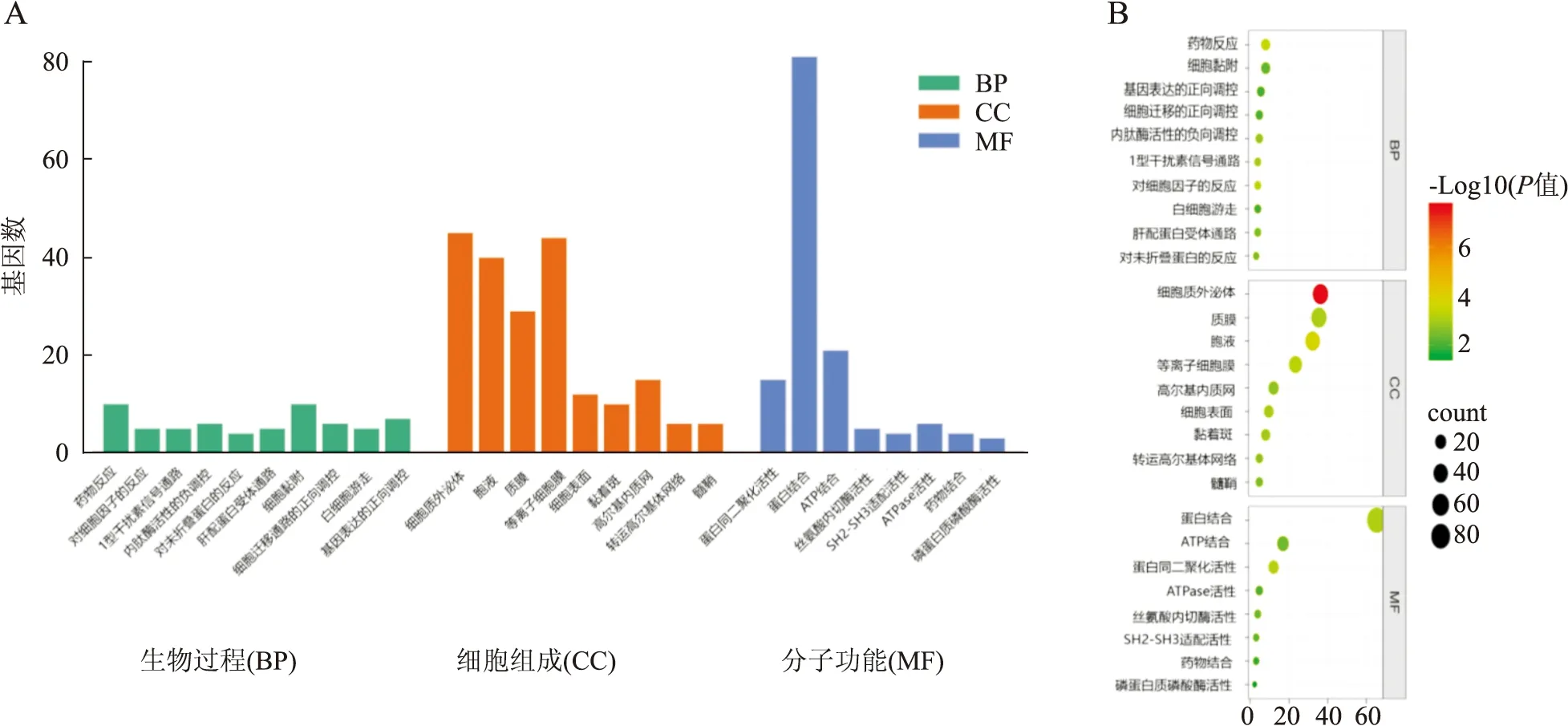
图2 差异基因GO分析:A.柱状图;B.气泡图:差异基因中参与生物过程、细胞组成、分子功能最多的分别是细胞黏附、细胞质外泌体、蛋白结合
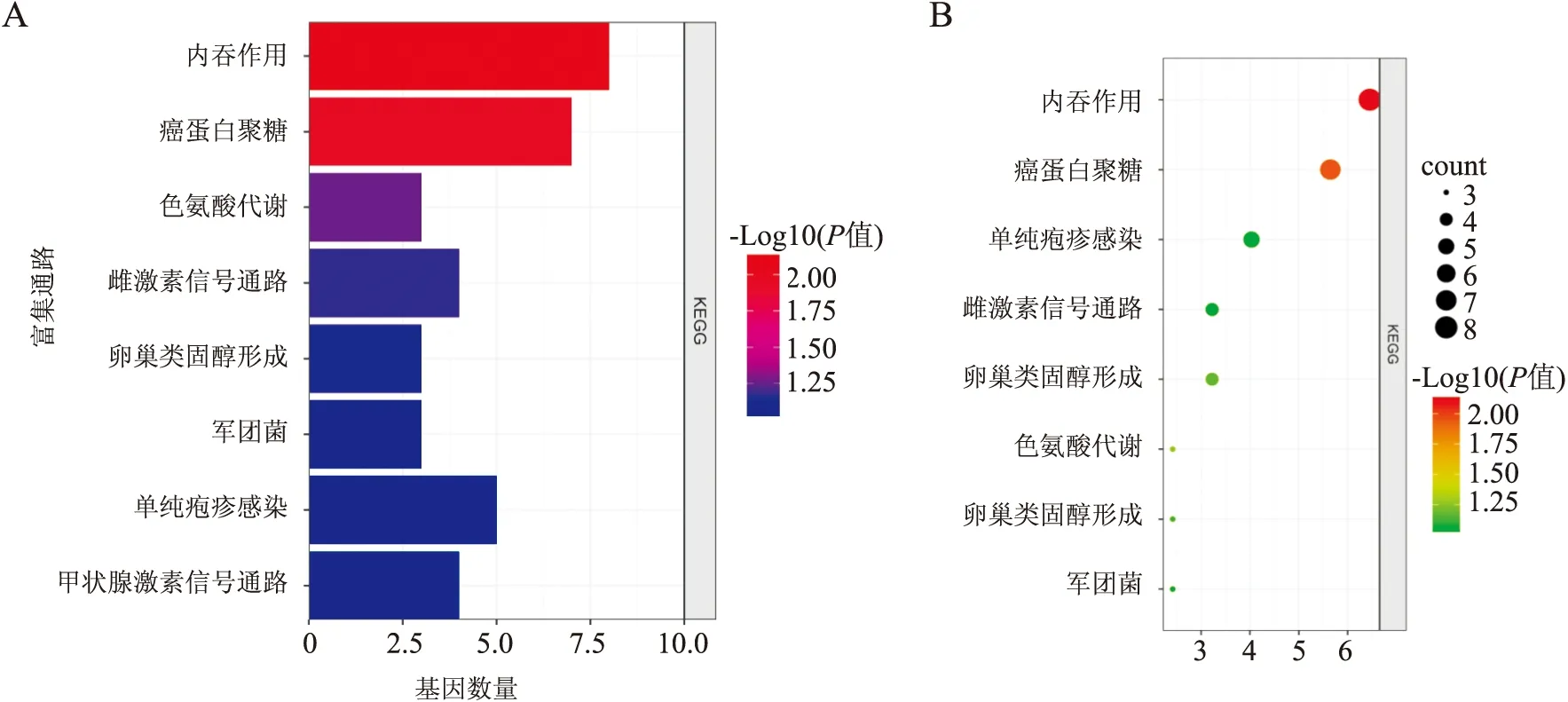
图3 差异基因KEGG分析:A.柱状图;B.气泡图:差异基因KEGG富集最多的通路是内吞作用、癌蛋白聚糖、雌激素信号通路等
2.3 乳腺癌他莫昔芬耐药差异基因的PPI网络构建利用STRING数据库构建差异基因表达产物的PPI网络图(图4),并用Cytoscape(MCODE)确定以下4个中心节点基因:IFI27、IRF9、OAS1、ISG15(图5),其对应的蛋白可能是核心蛋白或具有重要生理调控功能的关键候选分子。选择标准如下:MCODE分数>5,度数截止=2,节点分数截止=0.2,最大深度=100,K-core=2)。
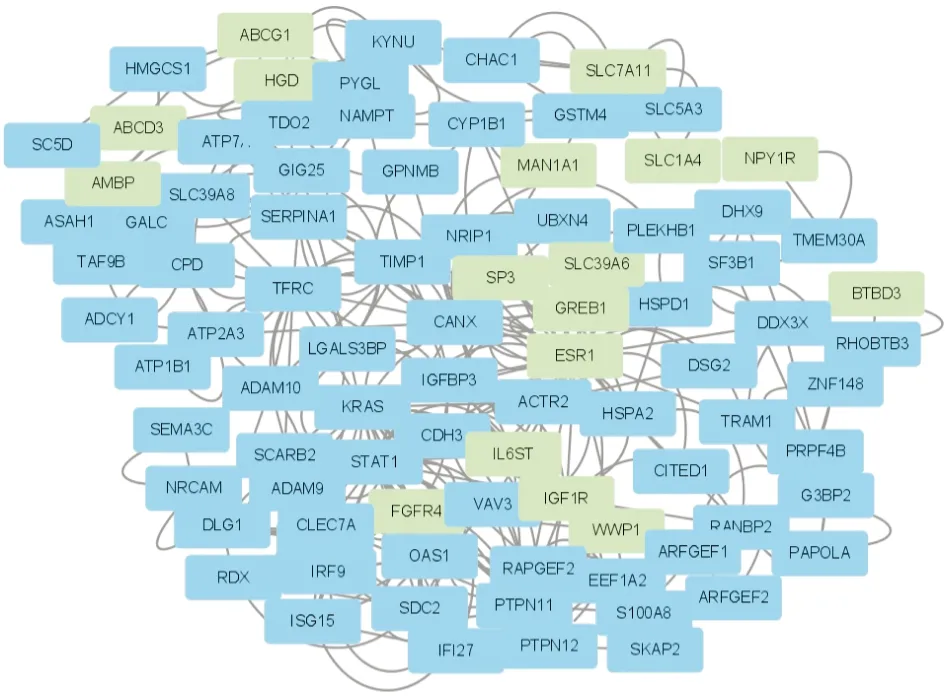
图4 PPI网络图:绿色代表上调基因,蓝色代表下调基因,线段连接的两个基因表示两者有相关性

图5 从具有4个节点和12条边的PPI网络中获得4个最关键基因:IRF9、ISG15、OAS1、IFI27
2.4 关键模块基因在乳腺癌组织中的表达及与肿瘤预后的关系利用UALCAN数据库分别对关键基因进行表达及生存分析,发现IFI27、IRF9、OAS1、ISG15在乳腺肿瘤组织中均为高表达(图6),且IFI27增高与肾上腺皮质癌的预后较差有关(图7A),OAS1增高导致肺腺癌生存率降低(图7B)。

图6 UALCAN数据库分析4个关键基因在乳腺癌中的表达及与肿瘤预后的关系:IFI27(A)、IRF9(B)、OAS1(C)、ISG1(D)在乳腺癌组织中的表达
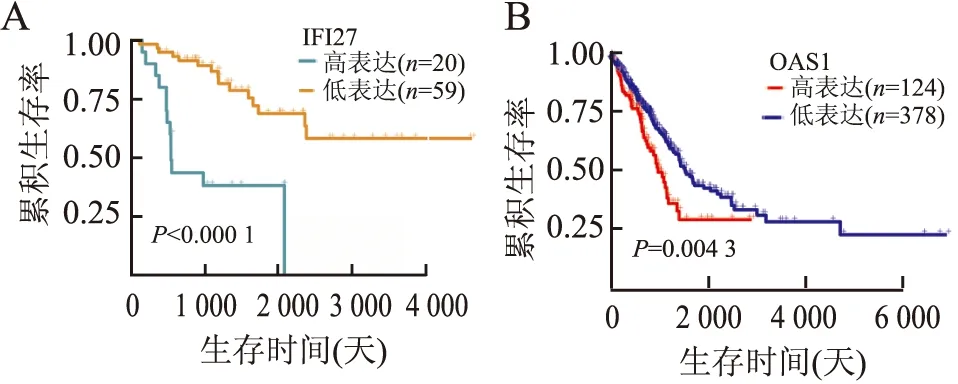
图7 A.IFI27表达与肾上腺皮质癌预后的关系;B.OAS1表达与肺腺癌预后的关系
3 讨论
ER阳性乳腺癌由于其基数较大以及远期复发转移比例较高,ER阳性乳腺癌患者死亡人数明显多于另外两型乳腺癌患者[1,4,11]。乳腺癌内分泌治疗和靶向治疗的应用增加了治疗的可选择性,并改善乳腺癌患者预后[12]。ER基因是内分泌治疗的靶点,包括选择性ER调节剂(selective ER modulators,SERM)和选择性ER下调剂(selective ER downregulators,SERD),或芳香酶抑制剂(aromatase inhibitors,AI)[13]。乳腺癌的内分泌治疗已有110多年历史,由于认识较少,曾长期徘徊于切除内分泌器官(如卵巢、肾上腺、垂体)和补充雌激素和雄激素的阶段。内分泌治疗按其治疗方式可分为药物治疗和非药物治疗[14-15]。最常用的药物治疗有他莫昔芬和芳香化酶抑制剂,但是近年越来越多的报道证明乳腺癌患者对内分泌治疗耐药。乳腺癌内分泌耐药分为原发性耐药和继发性耐药,原发性内分泌耐药是指辅助内分泌治疗不超过2年或者晚期一线内分泌治疗不超过6个月即出现复发转移或进展;继发性内分泌耐药是指辅助内分泌治疗超过2年或结束后1年内出现复发转移,或者晚期一线内分泌治疗超过6个月出现进展[16]。他莫昔芬治疗乳腺癌的原理是通过与雌激素竞争结合ER,阻断雌激素相关基因的表达,从而减慢肿瘤细胞的分裂和增殖,因而可以肯定他莫昔芬的耐药机制与ER信号传导的异常调节密切相关。据相关统计,高达1/3患者属于原发性他莫昔芬耐药,而早期对他莫昔芬敏感的患者中有30%~40%出现继发性耐药[17-19],他莫昔芬耐药可导致乳腺癌转移,缩短患者生存期,严重者可造成患者死亡。因此,探讨乳腺癌他莫昔芬耐药机制具有重要意义。
肿瘤耐药受基因调控,基因表达芯片作为一种高效、大规模的基因数据获取技术,已被广泛用于收集基因微阵列表达谱数据,研究多种人类癌症的基因表达。微阵列技术和高通量测序技术的出现及其快速发展,拓展了癌症研究的手段,加速各种癌症治疗潜在靶点的发现[20-22]。利用生物信息学技术整合这些数据可以帮助我们更深入地研究疾病发生、发展的分子机制。王世霞等[23]通过生物信息学技术证明HIF-1信号通路可能会导致乳腺癌他莫昔芬治疗耐药。柴慈曼等[24]亦通过生物信息学有效分析他莫昔芬耐药的基因芯片数据,为他莫昔芬耐药的治疗靶点提供重要依据。本实验通过生物信息学技术发现了与他莫昔芬耐药有关的132个差异表达基因,这些基因主要参与内吞作用、癌蛋白聚糖、雌激素信号通路等代谢过程。既往研究发现,自噬是他莫昔芬耐药的重要机制,抑制自噬可以实现获得性耐药乳腺癌细胞的再增敏。内吞作用是自噬的重要过程,故作者推测差异基因通过内吞作用参与自噬导致他莫昔芬耐药。近年越来越多的研究表明,雌激素表观遗传学改变以及雌激素相关信号通路的异常和交互作用,是导致乳腺癌内分泌治疗耐药的主要原因,本实验筛选出的差异基因也主要富集雌激素信号通路代谢过程,作者推测这些基因也可以通过雌激素信号通路导致他莫昔芬耐药。此外,本实验还探讨IFI27、IRF9、OAS1、ISG15与肿瘤预后的关系。从UALCAN数据库中发现IFI27、IRF9、OAS1、ISG15在乳腺癌组织中的表达均高于正常乳腺组织,且IFI27表达增高与肾上腺皮质癌的预后较差有关,OAS1表达增高导致肺腺癌生存率降低。目前,关于IFI27、IRF9、OAS1、ISG15基因与肿瘤关系的研究较多。其中一项研究证明IFI27与ER阳性乳腺癌的生长和侵袭存在内在联系[25];也有研究证明IFI27可以促进上皮-间质转化和诱导卵巢癌的发生[26];Wang等[27]的研究结果亦证明抑制IFI27可以抑制口腔鳞状细胞癌细胞的增殖和侵袭。Huang等[28]基于生物信息学分析的研究显示,IFI27是胰腺癌预后的独立预测因子。Yang等[29]的研究亦显示IFI27是胰腺癌诊断和预后的标志物。也有研究表明,VCAN能够使IRF9转导的细胞具有致癌特性(增殖和迁移),可能与CDKN1A有关[30],也有研究证明IRF9可以通过调节Versican促进肺癌进展[31]。Zhang等[32]的研究证明OAS1、OAS3的mRNA高表达与乳腺癌患者预后较差相关。以上结果与本实验结果一致,说明IFI27、OAS1、IRF9可能与乳腺癌不良预后有关,进而可能在乳腺癌他莫昔芬耐药过程中发挥作用。目前,关于ISG15的作用研究存在争议。Jeon等[33]的研究结果证实ISG15与多柔比星化疗敏感性密切相关;而Zhou等[34]的研究认为ISG15抑制癌细胞生长,促进细胞凋亡,与本组结果不一致,需要进一步分析。
综上所述,IFI27、IRF9、OAS1、ISG15可能与乳腺癌他莫昔芬耐药的发生和发展密切相关,目前,关于IFI27、IRF9、OAS1、ISG15与他莫昔芬耐药机制相关研究暂无报道,值得我们进一步分析,这可能对乳腺癌治疗产生积极的影响。本实验的局限性在于样本量相对较小,易造成统计学上的偏差,乳腺癌他莫昔芬耐药相关基因的功能仍需进一步的分子生物学实验来证实。
