机械加载通过促进髌下脂肪垫干细胞迁移及软骨分化治疗骨关节炎
2022-09-28王筱郁李杰李心乐刘大全张平
王筱郁,李杰,2,李心乐,2,刘大全,2,张平,2,3
(1.天津医科大学基础医学院人体解剖与组织胚胎学系,天津 300070;2.卫生部激素与发育重点实验室,天津市代谢性疾病重点实验室,天津 300134;3.天津市脊柱脊髓重点实验室,天津 300052)
骨关节炎(OA)是一种以关节软骨退行性病变为主要特征的慢性疾病[1],它引起的关节疼痛、运动功能障碍,带来了沉重的社会负担[2]。目前的药物治疗(如非甾体抗炎药和阿片类药物)在延缓OA 的同时也会导致严重的不良反应[3]。近年来,间充质干细胞(MSCs)在关节软骨重建中的修复作用越来越受到重视[4]。在关节内或关节周围的多个干细胞龛中存在各种具有迁移潜能的MSCs[5]。在早期OA 生物力学作用下,这些能够到达软骨浅层的关节内MSCs是软骨修复的关键细胞[6]。
髌下脂肪垫(IFP)是一种位于关节囊内、滑膜外的脂肪组织[7],其中含有增殖能力很强的MSCs[8]。并且,胚胎起源决定了其拥有更强的软骨分化潜能[9],这些MSCs 可以迁移至软骨表面进行修复[10]。机械加载是一种低频率、强度小、作用于膝关节等滑膜关节的温和机械刺激,能模拟人体主动运动的物理治疗手段[11],可以通过抑制炎性、促进骨髓MSCs 软骨分化,促进血管形成、骨形成,分别用于OA[12]、骨质疏松[13]、股骨头坏死[14]的治疗。前期的工作已经发现机械加载通过OA 小鼠的骨-软骨串扰来防止软骨退化[15],但是机械加载对髌下脂肪垫干细胞(IFPSCs)的动员作用尚不清楚。本实验采用手术横断小鼠膝关节内侧副韧带和切除内侧半月板建立OA 模型,评估机械加载对IFP-SCs 迁移和软骨分化的影响,为物理治疗OA 和内源性软骨再生提供新的见解。
1 材料与方法
1.1 材料
1.1.1 实验动物 54 只SPF 级雌性C57BL/6 小鼠,约14 周龄,体重18~20 g,由中国人民解放军军事医学科学院实验动物中心提供[生产许可证号:SCXK(京)2014-0013]。每笼5 只小鼠,自由摄取饲料和水。所有实验根据天津医科大学实验动物管理规定进行,并经天津医科大学伦理委员会批准,审批号为[SYXK(津)2019-0004]。
1.1.2 主要仪器和试剂 石蜡切片机(RM255)购自德国Leica 公司。光学显微镜BX53 购自日本Olympus 公司。转化生长因子(TGF)-β3 购自中国Novoprotein 公司。HE、番红O、Alcian Blue 染料购自美国Sigma 公司。胎牛血清、青霉素、链霉素和胰蛋白酶购自美国Invitrogen 公司。抗体购自美国Abcam 公司。
1.2 方法
1.2.1 动物分组及手术造模 54 只小鼠采用随机数字表法分成为对照组(Sham 组,n=18)、OA 组(n=18)、骨关节炎机械加载组(OAL 组,n=18)。用1.5%异氟烷麻醉小鼠,于右下肢膝关节内侧打开关节腔,使用手术显微镜和显微外科技术横断内侧副韧带,摘除内侧半月板。在右膝手术结束后,对左膝进行了同样的手术。Sham 组只切开关节内侧皮肤。术后使用丁丙诺啡盐酸盐镇痛并使用恩氟沙星抗感染3 d。
1.2.2 机械加载治疗 手术造模后第2 天,OAL 组接受机械加载。在机械加载期间,小鼠经1.5%异氟烷吸入麻醉,用定制的机械加载装备对双侧膝关节施加相同负荷(图1)。应用1 N 和5 Hz 的机械加载治疗2 周,每天6 min(每侧腿各3 min)。Sham 组和OA 组仅放置在加载装置上,没有实施加载力。加载后,允许小鼠在笼子中正常活动。
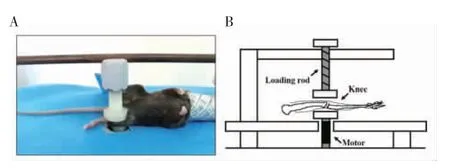
图1 机械加载示意图Fig 1 Schematic diagram of mechanical loading for a mouse
1.2.3 组织学分析
1.2.3.1 组织处理:小鼠在手术后2 周处死。剥离小鼠后腿,剔除皮肤、软组织及韧带,保留完整膝关节。将组织在10%中性福尔马林中固定2 d 后,在14%的EDTA 中脱钙2 周。将组织用石蜡包埋,冠状位切片,厚度为5 μm。
1.2.3.2 HE、番红O/快绿染色:组织切片经二甲苯脱蜡、梯度乙醇水化后,进行HE 和番红O/快绿染色,脱水透明后树胶封片,显微镜下观察组织病理形态学改变。使用Olympus CCD DP73 软件进行相关数据的测量。软骨国际骨关节炎研究学会(OARSI)评分评估软骨损害程度。
1.2.3.3 免疫荧光:组织石蜡切片用10%的山羊血清封闭,用一抗4°C 过夜孵育SDF-1(1∶1 000)、然后用荧光二抗染色。细胞核用DAPI 染色。使用U-RFL-T 荧光显微镜(Olympus,Tokyo,Japan)获得图像。计数每个样本中阳性染色细胞的数量。
1.2.4 细胞学实验
1.2.4.1 细胞分离培养:人道主义处死小鼠后,分离其后腿,切开关节囊上方皮肤,在髌韧带(PL)旁做切口,翻开PL,下方淡黄色组织即为IFP。用0.2%Ⅰ型胶原酶震荡消化IFP 1 h,用70 μm 细胞筛滤去多余脂肪组织。由于小鼠的IFP 体积很小,为了得到足够数量的原代细胞,每组使用9 只小鼠,将同一分组的3 只小鼠种在一个孔板。IFP-SCs 在添加100 U/mL 青霉素、100 μg/mL 链霉素和10%胎牛血清(FBS)的DMEM 中培养(图2)。
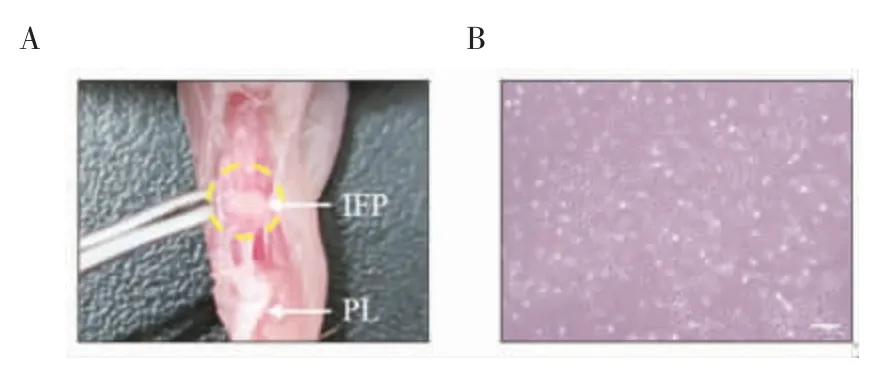
图2 IFP 的提取及光镜下IFP-SCs 的形态(×100)Fig 2 Extraction of IFP and the morphology of IFP-SCs under light microscopy(×100)
1.2.4.2 细胞迁移实验:Transwell(8 μm,24 孔板)用于细胞迁移实验。IFP-SCs 悬浮在上室无血清的培养基中,下室含有含10% FBS 的DMEM。共培养12 h 后,用福尔马林固定细胞,结晶紫染色通过孔膜底部的细胞以评估细胞迁移。
1.2.4.3 软骨诱导实验:IFP-SCs 在软骨分化培养基中(MesenCult 增殖试剂盒补充10-8mol/L 地塞米松、50 μg/mL 抗坏血酸、10 mmol/L β-甘油磷酸和10 ng/mL TGF-β3)培养28 d。细胞在10%缓冲福尔马林中固定,PBS 洗涤后,用1%阿立新蓝染色,蓝染的细胞为软骨细胞。
1.2.5 Western 印迹 IFP-SCs 在PBS 中洗涤3 次,在RIPA 裂解缓冲液中提取总蛋白。在4°C 下离心10 min 去除细胞碎片。采用一抗CXCR4(1∶1 000)、SOX9(1∶10 000)和β-actin(1∶10 000)在4°C 过夜孵育。二抗室温(1∶10 000)孵育90 min 后,经化学发光后用凝胶成像系统检测相关蛋白的表达。
1.3 统计学处理 采用SPSS 20.0 统计软件进行统计学分析。实验相关数据以表示,多组间比较采用单因素方差分析(one-way ANOVA),组间多重比较行LSD-t 检验,P<0.05 为差异有统计学意义。
2 结果
2.1 机械加载对OA 关节软骨的影响 HE 染色和番红O 染色显示,Sham 组软骨表面光滑、完整,而OA组软骨表面粗糙、不平,OARSI 评分升高(t=-8.485,P<0.001)。经过机械加载治疗后,软骨表面平整,OARSI 评分降低(t=4.025,P<0.01)。另外,与Sham组相比,OA 组的软骨细胞数量减低,空泡细胞数目增多,而机械加载使软骨细胞有所增加(t=24.405、-9.605,均P<0.001),空泡细胞有所减低(t=-8.000、-3.674,均P<0.01,图3)。
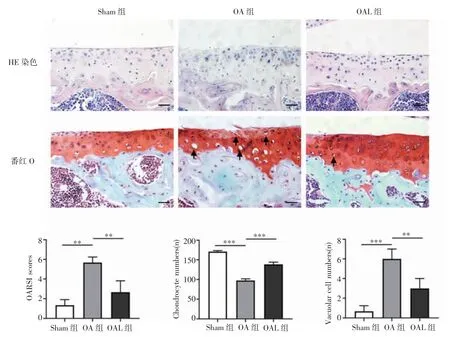
图3 内侧胫骨平台软骨的HE 和番红O 染色形态学检查(×400)Fig 3 Morphological examination of the medial tibial plateau cartilage by HE and Safranine O staining(×400)
2.2 机械加载促进了归巢因子SDF-1 的表达和IFP-SCs 的迁移 免疫荧光结果显示,与Sham 组相比,OA 组SDF-1 表达有所增加,机械加载治疗后,OA 小鼠软骨中SDF-1 的表达进一步增加(t=-8.148、-6.695,均P<0.001,图4)。同时,细胞迁移实验表明,与Sham 组相比,OA 组的细胞迁移量增加(t=-5.085,P<0.05),OAL 组的细胞迁移水平最高(t=-5.142,P<0.001,图5)。进一步通过Western 印迹检测迁移相关蛋白的水平。结果显示,与Sham 组相比,OA 组CXCR4 蛋白表达水平升高(t=-9.679,P<0.001),机械加载进一步增强了其蛋白的表达水平(t=-4.403,P<0.01,图6)。
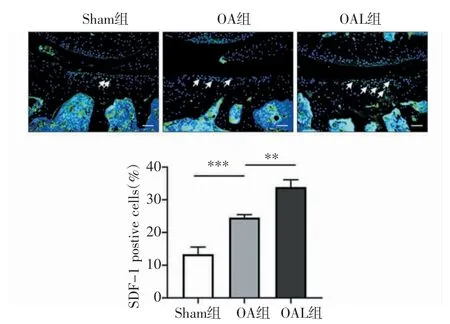
图4 各组小鼠软骨中SDF-1 的表达(×100)Fig 4 The expression of SDF-1 in cartilage of mice in each group(×100)
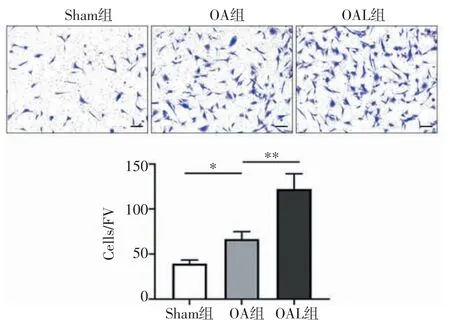
图5 各组IFP-SCs 迁移(×100)Fig 5 Migration of IFP-SCs in each group(×100)
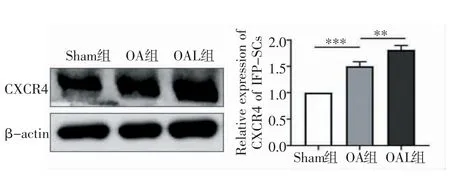
图6 Western 印迹检测各组CXCR4 表达Fig 6 The expression of CXCR4 detected by Western blotting assay in each group
2.3 机械加载上调SOX9 促进IFP-SCs 软骨分化 通过软骨诱导实验,检测机械加载对IFP-SCs软骨分化的影响。与Sham 组相比,OA 组中分化的软骨细胞数量明显减少。然而,OAL 组IFP-SCs 分化为软骨细胞的数量显著增加(t=28.517、-10.462,均P<0.001,图7)。为了进一步探究软骨分化的机制,采用Western 印迹检测IFP-SCs 中的SOX9,与Sham 组相比,OA 组的SOX9 蛋白表达水平显著降低,而机械加载升高了IFP-SCs 中SOX9 蛋白表达水平(t=17.580、-11.170,均P<0.01,图8)。
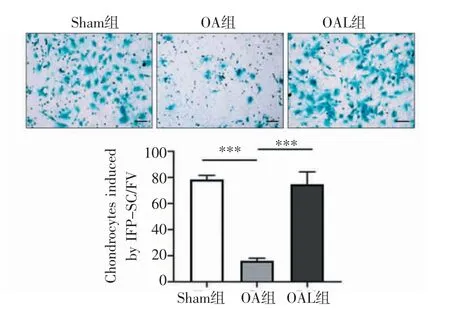
图7 各组IFP-SCs 诱导的软骨细胞(×100)Fig 7 Chondrocytes induced from IFP-SCs in each group(×100)
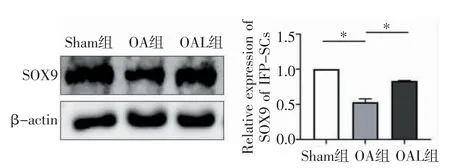
图8 Western 印迹检测各组SOX9 表达Fig 8 The expression of SOX9 detected by Western blotting assay in each group
3 讨论
OA 是一种常见的关节软骨退行性疾病,由于肥胖、衰老等因素不断增加,其发病率也在逐年升高。因为关节软骨没有血管,一经损伤后软骨难以修复,随着疾病的进展,会引起关节疼痛、僵硬甚至运动障碍,严重影响生活质量。目前,OA 已成为重要的公共健康问题之一[16]。因此,迫切需要开发OA早期的治疗办法以预防疾病进展。
早期药物治疗往往伴随一定的不良反应,相比于药物,运动训练更适合早期OA。适度运动不仅能降低体重过高等危险因素,更能预防OA 的发生发展。机械加载作为一种可模拟主动运动的被动物理康复治疗方式,能够引起骨髓腔内压力的改变,驱动骨质内液体的流动,动员内源性干细胞,影响骨髓中的干细胞的分化、功能和归巢,调节骨髓内微环境[11]。许多研究证明了机械加载对骨骼、关节的有益作用[17-19]。其中包括机械加载通过增强自噬、促进骨髓干细胞软骨分化[12]、抑制炎性反应[20],以及抑制破骨细胞[15]发挥作用,达到延缓OA 进展的目的[12]。本实验拓展了之前的研究范围,以关节内的脂肪组织为研究对象,探究机械加载条件下关节内干细胞的动员机制。笔者提取了OA 小鼠的IFP-SCs,证明了机械加载通过增强IFP-SCs 迁移及软骨分化能力,延缓OA 软骨破坏。OA 这种结果趋势与笔者预期一致,也与所报道的力学刺激对OA 的有益作用相一致。本实验证明了膝关节机械加载这种力学刺激方式对关节内干细胞的动员作用,以及对OA 关节软骨的保护及治疗作用。
IFP-SCs 在组织损伤后,干细胞的有效动员对其修复至关重要[21]。研究表明,IFP-SCs 可以迁移到滑液中,修复受损的软骨[5]。SDF-1 通过与其受体CXCR4 发生反应,调节干细胞归巢到损伤部位[22]。事实上,损伤后组织中趋化因子SDF-1 浓度增加在短时间内是有限的,在此期间,MSCs 虽然可以动员到损伤部位,但数量不足。研究发现,低强度机械刺激可以通过SDF-1/CXCR4 轴,促进MSCs 迁移[23-24]。在本研究中,与OA 组相比,机械加载增加了软骨表面SDF-1 的表达。Western 印迹结果显示,机械加载增加了IFP-SCs 中CXCR4 的表达。细胞迁移实验显示,IFP-SCs 在机械加载后迁移能力增强。以上结果表明,机械加载可能通过SDF-1/CXCR4 轴,促进IFPSCs 迁移,修复软骨。
另外,在软骨的形成和稳定性中,SOX9 是不可或缺的,特别是在MSCs 的软骨分化中[25-26]。文献表明,软骨修复失败的潜在机制之一是OA 关节中的软骨细胞祖细胞和MSCs 缺乏软骨生成转录因子SOX9 的活性[27]。本实验研究结果表明,在OA 小鼠中SOX9 的表达水平明显降低,而机械加载上调了IFP-SCs 中SOX9 的表达,并促进其软骨分化。这与低强度机械刺激可促进IFP-SCs 分化为软骨细胞结果相一致[28]。实验证明了机械加载作用下SOX9 对IFP-SCs 成软骨分化的贡献。
综上所述,本研究表明机械加载可以作为OA 的一种新的治疗方法。机械加载可能通过激活SDF-1/CXCR4 轴、促进SOX9 表达,增强IFP-SCs 的迁移和软骨分化能力,发挥其治疗作用。但机械加载治疗下的迁移方式仍不明确,需进一步完善体内外研究进行验证,为临床治疗OA 提供新的思路依据。
