纳米纤维明胶胶囊等固体制剂的制备及生产工艺
2022-09-28张芮娟
张芮娟
(瑞迪博士(北京)药业有限公司,北京 100022 )
药物的概念随着药物治疗的发展而发展。作为化学物质的活性剂很少单独使用。药物制剂正在使用中,其应用机会也显示出类似的重大进展。在过去的几十年里,制剂被视为活性剂的载体,这种态度的影响一直持续到今天。因此,很少有人需要对人体与药物制剂之间的关系系统进行彻底的科学探索。生物制药已经建立并使制药技术能够满足更高层次的治疗需求。新一代药物制剂是在最近科学成就的基础上发展起来的,它通过改进现有的药物治疗方法和开发全新的治疗设备(如复方制剂、药物控释系统、药物缓释系统等)促进了治疗领域的重大进展,包括自动调节和靶向释放系统。现代药物制剂(剂型)同样由具有药物传递功能的活性剂和赋形剂组成。然而,由于其特殊的组成、结构,除了在体内引入活性剂外,还可以通过改变活性剂的药代动力学参数来优化药物治疗。
1 固体制剂的分类和制备方法
1.1 固体制剂载体的制备
选择用于制备固体分散体的载体时,必须考虑以下特性:
(1) 水溶性-高,改善润湿性和溶解性;
(2) 玻璃化转变点高,提高稳定性;
(3) 吸水率低,降低;
(4) 与物质在同一溶剂中的溶解度;
(5) 熔点应该相对较低。
考虑到载体形式,固体分散体分为3代。形成所谓晶体载体的物质,即尿素、糖、有机酸;第2代包括无定形载体,即聚乙二醇、聚乙烯吡咯烷酮、聚醋酸乙烯酯、纤维素衍生物;第3代包括表面活性剂、自乳化载体,如泊洛沙姆188,吐温80和凝胶44/14。聚合物载体的使用被认为在固体分散体的制备中特别有用,因为它们可以在最终产品中实现许多功能。它们是溶剂、增溶剂,可润湿并在空间上稳定并入的物质分子。此外,它们还影响热塑性参数和固体分散体组分之间的分子间相互作用,并确定所制备配方的溶解机理。
载体中的药物也可能以分子分散形式存在,处于非晶形或结晶状态。相互空间排列,即所谓的组分分子在制备的固体分散体中的插入,如图1所示。它们被定义为2组分或3组分体系,由易溶性药物和缺乏单独药理活性的难溶性载体组成。

图1 组分分子在固体分散体中的空间排列(插入)
1.2 共晶混合制剂制备
简单的共晶混合物由至少2种化学惰性成分组成,它们在液态时完全互溶,而在固态时只有很少程度的互溶。按一定比例用作混合物组分的物质,形成一个熔点低于单个组分熔点的体系。固态共晶混合物通常是通过快速冷却熔化的组分来制备的,目的是获得单个组分的极细晶体的物理混合物。固态共晶混合物通常是通过快速冷却熔化的组分来制备的,目的是获得单个组分的极细晶体的物理混合物。而在一个系统中,共晶组分以外的组分在同一过程中的不同时间结晶。由和组分组成的共晶混合物的示例相图如图2所示。和线显示了和组分特定比例的均质液体混合物开始结晶的温度。在这些线以上的系统是液态的,称为液相线。线表示和组分混合物开始熔化的温度,低于这个温度系统是固态的。线以下的混合物成分处于所谓的固相线状态。面积表示存在与固体组分平衡的液体和组分混合物;而面积表示存在与固体组分平衡的液体和组分混合物。点指定为液相线的线与指定为固相线的线相交,定义了共晶混合物成分。
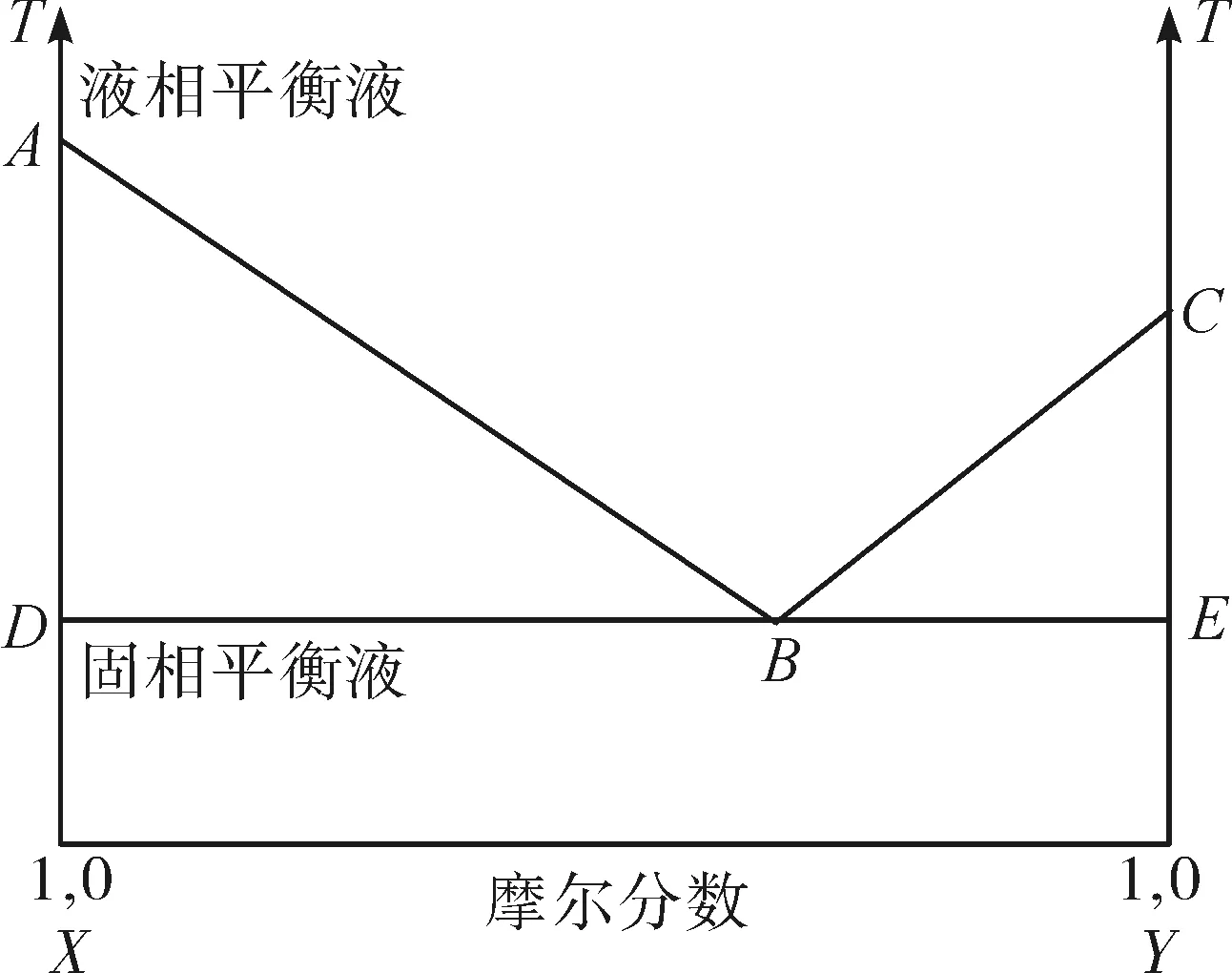
图2 共晶混合物相图
1.3 熔化法
熔化法也称为熔融法。Sekiguchi和Obi首次采用这种方法形成固体分散体,他们获得了由磺胺噻唑和尿素组成的物理混合物。在加热组分直至其熔化时,形成由药物和水溶性载体组成的物理溶液。当在冰浴的低温下剧烈搅拌时,熔融混合物迅速硬化。与溶质的过饱和可以通过突然冷却形成的混合物来实现,在这些条件下,物质分子被“困”在快速凝固系统的基质中。此外,该过程可在惰性气体(例如氮气)气氛下进行,该气氛可防止药物或载体的氧引发降解。在用这种方法制备固体分散体的过程中可能出现的另一个不利现象是在冷却过程中组分的相互混溶性发生变化,导致相分离。缓慢冷却混合物后,观察到药物呈结晶形式出现。另一方面,快速冷却促进非晶固体分散体的形成。
1.4 溶剂法
溶剂法最早由Tachibani和Nakamura使用。该方法能够在亲水性载体-聚乙烯吡咯烷酮中形成亲脂性β-胡萝卜素的固溶体。在该方法中,药物和载体的物理混合物溶解在挥发性溶剂中,即氯仿或二氯甲烷。然后,溶剂在23~65 ℃下完全蒸发,溶解的固体形成一层固体分散体,将所得膜干燥并粉碎。所用溶剂及其去除率是决定药物在固体分散体中溶出速率的重要因素。它们影响最终系统的晶体结构。
1.5 熔融挤压法
熔融挤出法制备固体分散体的方法较新,即使在聚合物固化时仍以分子分散形式存在。熔融挤出法是先前讨论的熔融法的一种变体。
熔融挤出的工艺过程可分为几个阶段,包括:将基质引入挤出机。混合和减小颗粒尺寸;将质量浓缩成固体稠度的致密材料。质量熔融,使熔体均匀化并使其通过挤出工具。起载体作用的物质,如聚合物,通过加药漏斗进入挤出机的加料部分。
1.6 冻干技术
冻干技术已被提出作为固体分散体制备溶剂法的替代方法。不同的是,载体和药物在溶剂中溶解,然后在空气中冷冻,例如液氮。此阶段持续几分钟,在冻干机中进行,确保低压和升华温度保持在-53 ℃。引入装置的样品升华形成分子分散体,然后在室温下置于硅胶上的真空干燥器中至少一天。
现有文献描述这种技术是有前途的,适合于将药物纳入载体。然而,这种方法并没有广泛地用于制造固体分散体。限制其使用的一个重要因素是大多数有机溶剂的冷冻温度较低,而升华过程只有在溶剂保持冷冻状态时才会发生。该方法以2-甲基-2-丙醇或叔丁醇(TBA)为溶剂,后者具有熔融温度高、蒸发压力大的特点。另外,如果样品处于玻璃态,温度应保持在玻璃化转变温度以下。
1.7 表面活性剂法
表面活性剂的应用是医药技术中的一个普遍做法,它是一种常用的方法。表面活性剂在颗粒表面的吸附可改变颗粒的疏水性、电荷等性能,从而导致溶液中物质行为的改变。表面活性剂参与溶剂化/增塑,这限制了组分的熔化,降低了它们的玻璃转变温度。固体分散体中的表面活性剂可起载体、分散剂和所述所述药物的乳化剂的作用。由于药物与溶剂之间的接触面积增加,它们在配方中的存在确保了物质的溶解度增加。同时,它也会使物质分子分散乳化,从而使它们迅速溶解。当在不使用表面活性剂的情况下制备固体分散体时,其表面形成一层富含药物的层。这一层限制了溶解,延长了药物的释放。
在选择固体分散体载体表面活性剂时,必须注意的参数是其熔融温度和药物在载体中的溶解度。用固体分散体填充硬胶囊和软胶囊要求混合物温度分别不超过70 ℃和40 ℃。此外,工艺过程要求载体形成熔融的液态物质。只有当被载体溶解并且以令人满意的方式溶解在该载体中时,才可使用一定剂量的药物。当使用难溶性物质时,其分散和溶解往往需要大量的载体表面活性剂。
1.8 静电纺丝
静电纺丝是一种能够在电场作用下生产直径为40~2 000 nm的长聚合物纤维的技术。固体分散纤维的形成发生在液体,或熔融聚合物与原料药,通过1 mm喷嘴,并注入到聚焦屏幕。带电纤维在到达收集器的路上会变干或凝固。它们可以被电力引导或加速。然而,加速它们到高速是不利的,因为它们倾向于滚动和折叠。除了上述注射速度外,最终纤维尺寸还受到库仑斥力的影响,库仑斥力导致纤维直径减小。这个过程可以通过增加聚合物的黏度来抵消。静电纺丝能够接收到成分、长度和物理化学性质不同的纳米纤维。以纳米纤维形式从固体分散体中释放药物的机制可以通过适当的物质与聚合物的定量比、接收到的纤维的直径和进一步的工艺过程来调节,例如将纤维加入硬明胶胶囊中,其中含有难溶于水的伊曲康唑和易溶于水的聚合物羟丙基甲基纤维素(HPMC)。
2 固体制剂制药质量控制研究
2.1 差示扫描量热法和扫描热显微技术
差示扫描量热法(DSC)是一种热法,在制药工业中应用最为广泛,它用于原料和原料药的理化性质鉴定。这反过来又有助于开发新的化学实体(NCE)。在DSC分析中,将极少量样品包装在铝盘中,然后与空白铝盘(参考盘)一起放置在仪器中。然后以预设和稳定的速率加热每个锅。为了以与基准相同的速率加热盛有样品的锅,需要不同的功率,计算的是加热样品的功率大小的差异。然后绘制热流与温度的关系图,这可以提供关于一阶和二阶相变的信息。
Laura Bond等描述了直接比较和对比药物化合物盐酸吡哆醛、Avicel的DSC和μTA的实验结果甘露醇。甘露醇和(Avicel)的DSC如图3、图4所示。

图3 使用热探针获得的甘露醇DSC表面
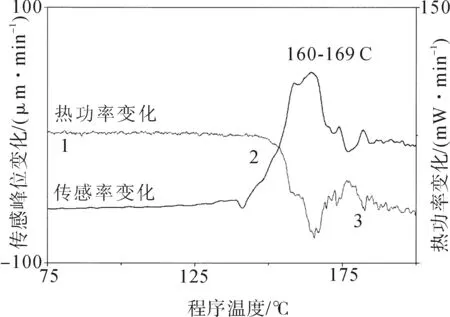
图4 Avicel 的DSC分析
图4显示了Avicel的DSC(潜在转换分析)分析的结果。从图3中的点开始。在150 ℃时出现放热峰;而在199 ℃时出现吸热峰。样品非晶形区域的吸热失水导致在150 ℃时出现实际放热峰,伴随着随后结晶过程的主要放热。熔体在199 ℃时出现峰值,这在很大程度上与文献值有关。
2.2 近红外光谱分析质量控制技术
红外光谱测量已被广泛应用于从液体、气体成分和固体物质的分析到每种物理状态的详细表征。单个分子吸收的红外辐射使特定的键以类似于双原子振荡器的方式振动。因此,从双原子分子作为最简单的振动系统出发,将这一概念推广到多原子分子是很方便的。红外线3个区域之间光能的变化导致不同分子和键的不同吸收,引起不同类型的振动。例如,能量最低的远红外光区(FIR)被重原子(如一些无机和有机金属物质)吸收,而中红外光区(MIR)用于有机化学分析。近红外光谱技术近年来已发展成为学术研究和工业质量控制不可缺少的工具,其应用领域广泛,从合成化学到农业,从一些生命科学到环境分析。这也是制药领域的关键方法,主要应用于技术、微生物学、毒理学、假药检测、理化性质测定、稳定性试验以及最终产品的质量控制等分支。
近红外光谱法提供了对各种材料的快速分析,从而有可能获得大量的化学和物理化学参数,甚至某些配方的化学成分。通过近红外光谱可以定量分析片剂技术中的各种药物参数,如硬度、粒径、压紧力、溶出速率或水分含量。近红外化学成像(NIR-CI)已被应用于许多制药产品的工艺和质量相关研究,包括质量评估、高通量分析、包衣厚度、成分信息、远程识别、混合均匀性,工艺相关效应的提取及假药鉴定。
近红外的另一个优点是可以处理和控制大量的工业/技术变量,这些变量必须在制造过程中进行优化。2009年2月,欧洲药品管理局(EMA)公布了关于制药行业使用近红外技术的修订指南草案,以及涉及该技术的新提交和变更的数据要求。根据cGMP,建议在剂型技术生产的质量控制程序中使用近红外光谱法。
2.3 化学成像质量控制技术
化学成像(CI)是一种新兴的平台技术,它将传统的成像技术与光谱学相结合,从物体获取空间和光谱信息。振动光谱法,如近红外(NIR)和拉曼光谱,结合成像技术,特别适用于生物/药物形态的分析。CI具有快速、无损、无创的特点,是制药工业过程分析工具的潜在适用性,可用于药品生产多个阶段的过程监控和质量控制。化学图像是由数百个连续的波段组成的每个空间位置的目标研究。因此,化学图像中的每个像素都包含该特定位置的光谱。产生的光谱就像一个指纹,可以用来描述特定像素的组成。化学图像,称为超立方体,是三维数据块,由2个空间维度和一个波长维度组成。超立方体允许将样本的生化成分可视化,分离到图像的特定区域,因为具有相似光谱特性的样品区域具有相似的化学成分。
在化学成像(CI)中,光谱成像和数字成像的结合产生了位置参考光谱,对复杂多组分样品的分析具有重要价值。CI在制药行业的一个主要优势是它有能力评估一个生产批次(而不仅仅是一个样本集)中的所有片剂,从而显著降低可变性和风险。此外,它在空间上定位药物成分的能力代表了对平均浓度方法(如HPLC和MS)的巨大改进。化学成像(CI)的非破坏性、坚固性和灵活性使其成为识别影响成品质量的关键控制参数的一种有吸引力的方法。随着人们对过程分析技术的不断重视,为制药过程提供准确、快速、无损的分析,CI很可能会越来越多地被应用于制药行业的过程监测和质量控制,就像近红外光谱技术一样。CI设备制造的未来创新可能会降低采购成本,并鼓励在制药行业更广泛地利用这一新兴技术。
3 结语
就固体药物制剂来讲,对其性能与质量影响较大的因素无外乎于其生产制备工艺以及质量监控方法。因此,本文着重于分析国内外对于生产固体制剂的制药方法以及其质量控制手段的叙述和研究。对固体制剂制药技术采取的熔化法、溶剂法、熔融挤压法、冻干技术、表面活性剂法、静电纺丝进行了论述,同时阐述了固体药物制剂制备的质量控制技术包括差示扫描量热法和扫描热显微技术、近红外光谱分析质量控制技术和化学成像质量控制技术。从中掌握了固体制剂药物制备工艺和质量控制方法的一般性规律,以便于更好的服务于制药厂对于固体制剂制药工艺和质量监控,具有极大的实践意义。
