基于网络药理学研究丹参-红花治疗冠心病的物质基础及作用机制
2022-09-27曹新福王鑫淼刘红旭张赫怡
曹新福 王鑫淼 刘红旭 张赫怡 李 享
(1 首都医科大学附属北京中医医院,北京,100010; 2 北京中医药大学,北京,100029)
冠心病(Coronary Heart Disease,CHD)是指由于冠状动脉发生粥样硬化引起冠脉管腔狭窄或闭塞,导致心肌缺血缺氧甚至坏死而引发的心脏病,心血管疾病每年造成1 730多万人死亡,到2030年估计死亡人数将增加到2 360万,而CHD是最常见的心血管死亡原因[1-5]。CHD属于中医学“胸痹”范畴,血瘀是CHD的关键病机,丹参-红花是常见的活血化瘀药对,以其为主要组分的丹红注射液广泛用于CHD的治疗,且具有确切的疗效[6-9]。然而丹参-红花治疗CHD的物质基础和作用机制仍不够明确。目前大多数关于丹参、红花的研究局限在“单一成分”“单一靶点”或“单一途径”,中医理论是建立在系统医学方法论基础上的,单一的成分或作用靶点研究,难以充分揭示中药复方的作用机制。网络药理学可通过构建网络阐述中药复方多成分、多靶点、多作用机制的特点,超越了单靶点思维的束缚,能较全面揭示中药复方的作用机制[10]。本研究从网络药理学的角度探讨丹参-红花治疗CHD的物质基础和可能的作用机制。
1 资料与方法
1.1 药物成分及靶点的筛选 使用中药系统药理学数据库与分析平台(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP,http://tcmspw.com/),分别以丹参、红花为关键词检索出所有化学成分,以口服生物利用度(Oral Bioavailability,OB)≥30%和类药性(Drug Likeness,DL)≥18%为筛选条件,筛选相应药物的化学成分[11]。通过PubChem(https://pubchem.ncbi.nlm.nih.gov/)查找筛选出的化学成分的三维结构数据,将三维结构数据输入PharmMapper平台(http://lilab.ecust.edu.cn/pharmmapper/index.php)预测化学成分的潜在靶点[12-13]。最后,使用String 10.5数据库(http://string-db.org/)将检索得到的所有靶点校正为其官方名称[14]。
1.2 疾病相关靶点的收集及药物-疾病共同靶点筛选 以“coronary heart disease”为关键词,通过检索DisGeNET数据库(https://www.disgenet.org/),获取与CHD相关的靶点[15]。将药物化学成分的潜在靶点以及CHD相关的靶点输入Venny 2.1在线软件(https://bioinfogp.cnb.csic.es/tools/venny/)进行交集,求得药物和疾病之间的共同靶点,并绘制韦恩图[16]。
1.3 药物-成分-靶点-疾病网络构建 采用Cytoscape 3.7.1软件构建药物-成分-靶点-疾病网络[17]。网络中节点代表药物、成分、靶点、疾病,边代表药物-成分-靶点-疾病之间的相互作用。通过Cytoscape的附加功能CytoNCA计算网络中节点的度中心性(Degree Centrality,DC)、中介中心性(Betweenness Centrality,BC)、接近中心性(Closeness Centrality,CC)和特征向量中心性(Eigenvector Centrality,EC),用以筛选丹参-红花治疗CHD的关键成分,参数值越大,说明节点越接近网络的中心。
1.4 PPI网络构建 在String 10.5数据库中导入药物-疾病的共同靶点,设置蛋白种类为“Homo sapiens”,最低相互作用阈值为(>0.40),其他的参数保持默认设置,构建蛋白质-蛋白质相互作用(Protein-protein Interaction,PPI)网络。网络图中节点表示靶点,节点之间的直线代表靶点间有相互作用关系,每种颜色的线条分别代表不同关系,线条越多代表度值越大,作用关系越强。
1.5 基因本体(Gene Ontology,GO)富集分析和京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集分析 将80个药物-疾病的共同靶点,依据P<0.05筛选条件导入David数据库(https://david.ncifcrf.gov/),进行GO富集分析和KEGG富集分析,并采用Omicshare软件绘制KEGG富集分析气泡图[18]。
2 结果
2.1 丹参-红花化学成分及靶点筛选 共纳入化学成分84个,丹参65个,红花22个,Baicalin、Luteoli、Poriferast-5-en-3beta-ol为丹参-红花所共有。借助PubChem查找化学成分的三维结构,并通过在线数据库PharmMapper预测得到211个药物靶点。
2.2 疾病相关靶点的收集及药物-疾病共同靶点筛选 共得到与CHD相关的有治疗作用的靶点912个。得到药物-疾病之间的共80个共同靶点。见图1。

图1 药物-疾病靶点韦恩图
2.3 药物-成分-靶点-疾病网络构建 多个化学成分可作用于同一个靶点,一个化学成分可作用于多个靶点,体现了丹参-红花治疗CHD多成分、多靶点的作用特点。见图2。结果显示化学成分的DC中位数为10.00,BC中位数为6.49、CC中位数为0.41、EC中位数为0.08,筛选得到丹参-红花治疗CHD的13个关键成分,丹参中有8个,红花中有6个,Luteolin(木犀草素)为丹参-红花所共有。见表1。
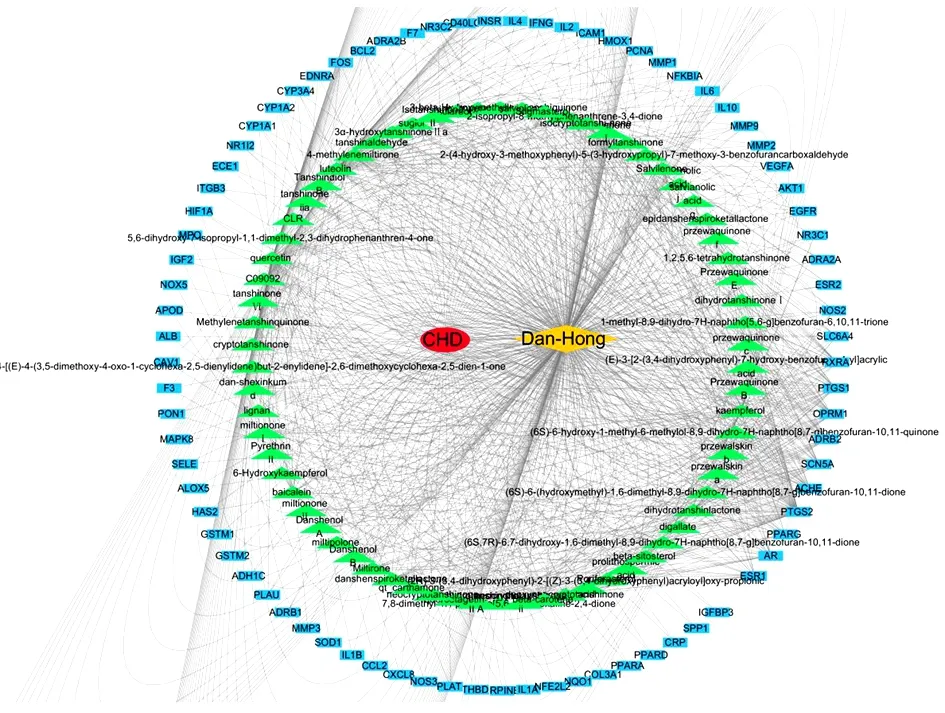
图2 药物-成分-靶点-疾病网络
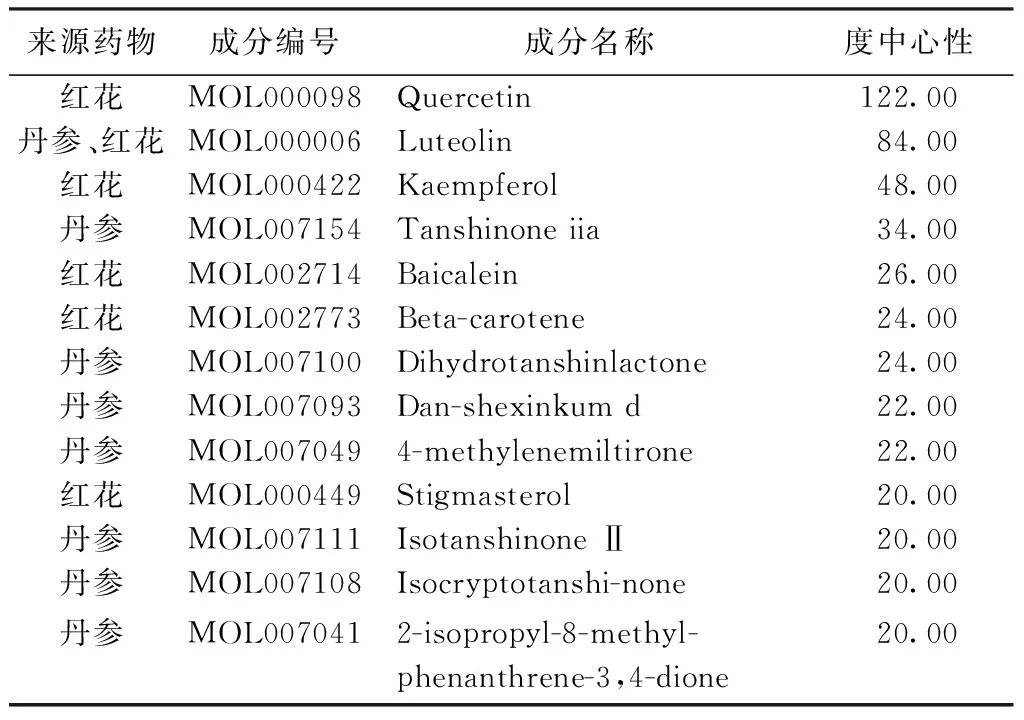
表1 关键化学成分信息
2.4 PPI网络构建 度值排名前10的靶点为IL6、AKT1、VEGFA、CXCL8、PTGS2、IL1B、NOS3、MAPK8、CCL2、MMP9,这些靶点可能为丹参-红花治疗CHD的核心靶点。见图3~4。

图3 药物-疾病共同靶点PPI网络
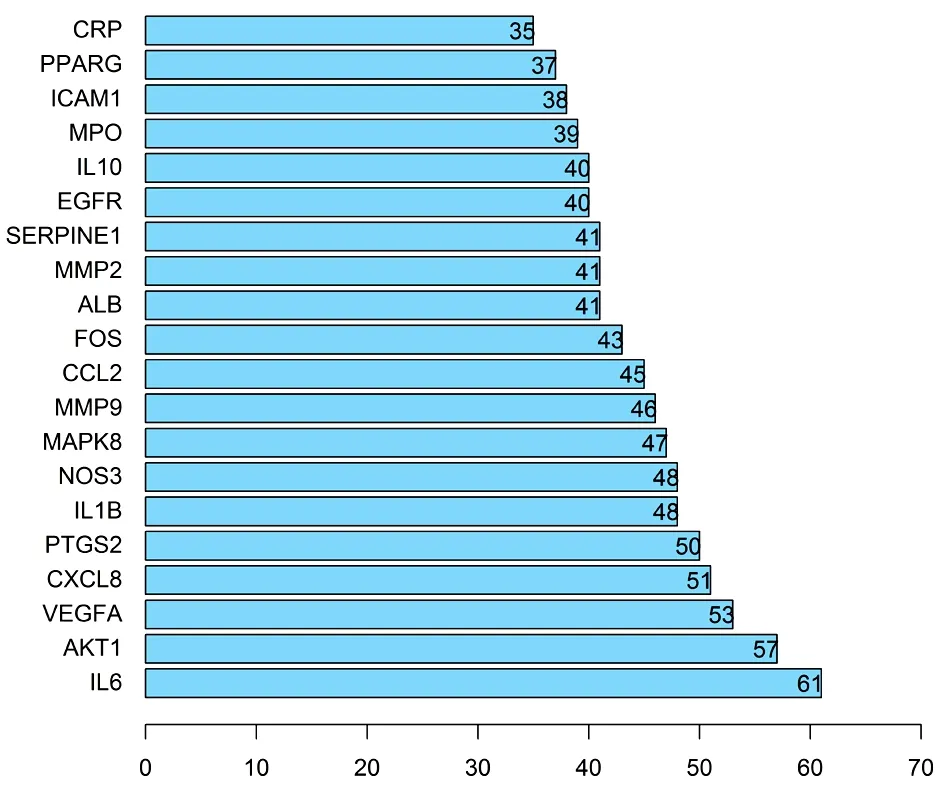
图4 PPI网络中度值排名前20靶点
2.5 GO功能富集分析 共收集到292个生物过程,25个细胞组分,62个分子功能。见表2~4。
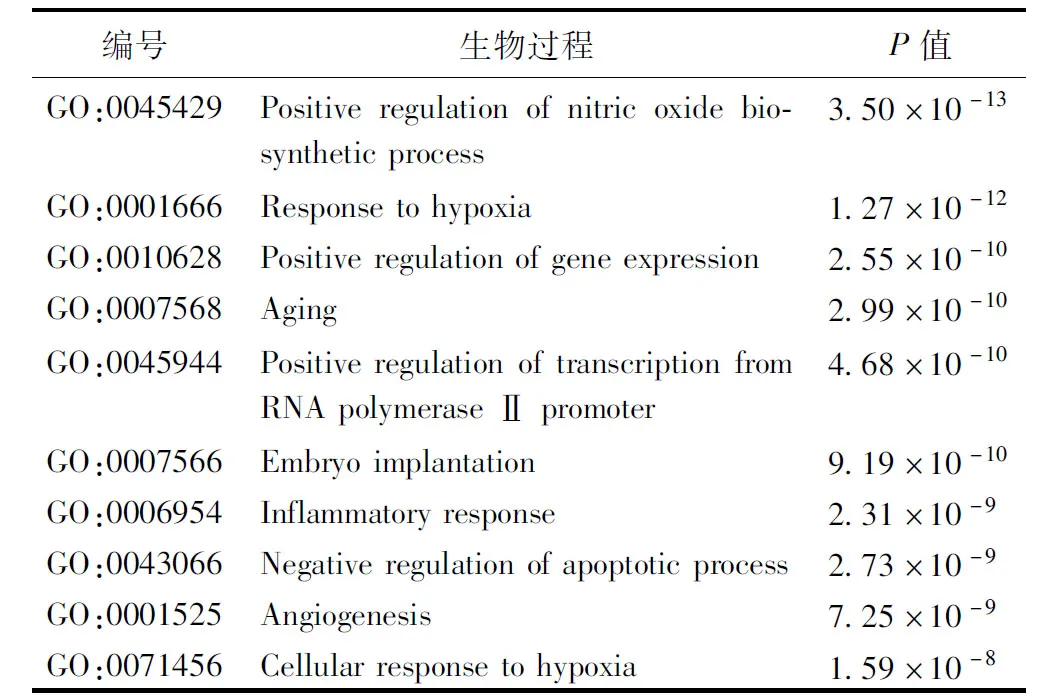
表2 GO富集-生物过程
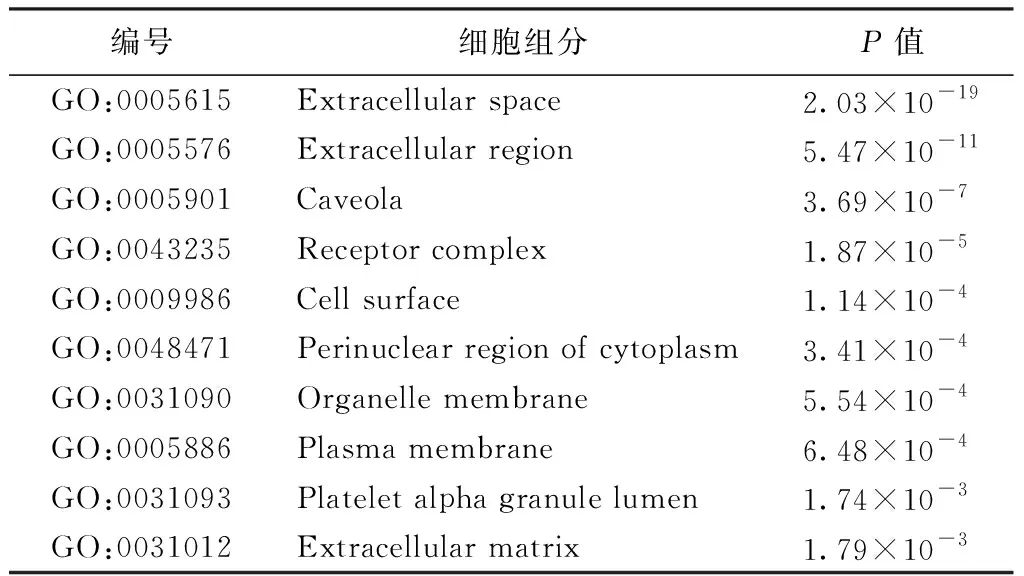
表3 GO富集-细胞组分

表4 GO富集-分子功能
2.6 KEGG通路富集分析 共收集到115条信号通路,以校正P值从小到大进行排序,取排名前20的信号通路,并绘制气泡图。见表5,图5。

表5 KEGG通路富集分析
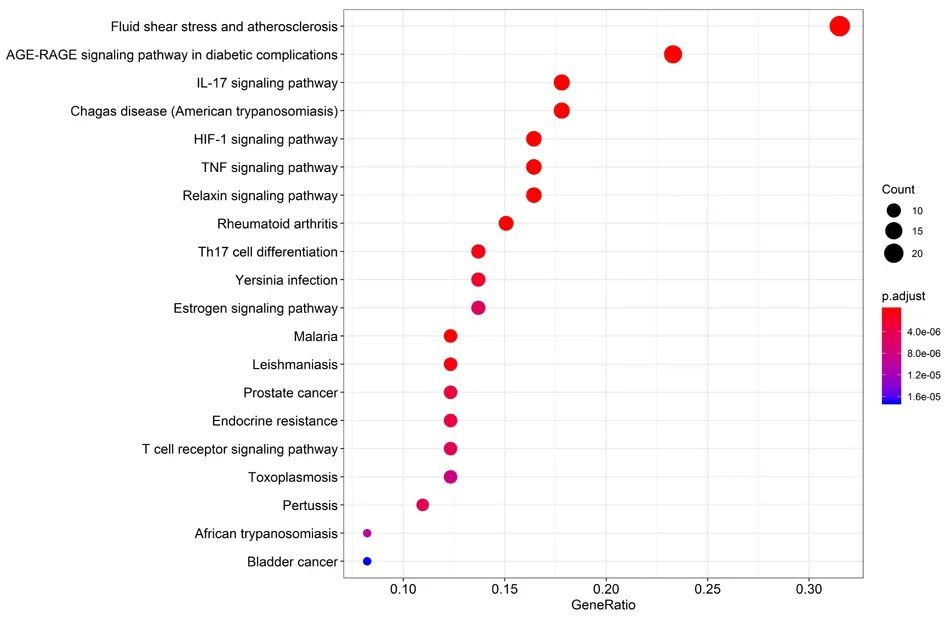
图5 KEGG通路富集分析
3 讨论
CHD属于中医学“胸痹心痛”范畴,其发生多与年老体衰、寒邪内袭、饮食不节、情志失调等因素相关。普遍认为该病病机为本虚标实,本虚以气虚、阴虚、阳虚为主,标实多与寒凝、痰浊、瘀血有关,其中又以心脉瘀阻为关键[19]。稳定期多表现为虚实夹杂,发作期则以寒凝血瘀或兼痰浊为主。治法上则强调急则治其标,发作期以活血化瘀、温化寒痰为主;缓则标本兼治,稳定期则以益气养阴、温阳散寒配合活血化瘀、化痰降浊等治法为关键。血瘀证贯穿CHD发展的始终,为最主要的证候要素,活血化瘀是治疗CHD的核心治法[20-21]。本研究基于网络药理学对活血化瘀药对丹参-红花治疗CHD的物质成分、潜在靶点及可能信号通路进行了初步探讨。
药物-成分-靶点-疾病网络分析结果显示,丹参-红花治疗CHD的关键成分有13个,丹参中有8个,红花中有6个,木犀草素为丹参-红花所共有。本研究发现与CHD相关程度较高的成分有5个,分别为槲皮素、木犀草素、山柰酚、丹参酮ⅡA、黄芩苷元。槲皮素具有抑制乳酸脱氢酶氧化、舒张血管,保护血管内皮功能、预防炎症损伤以及抗血小板聚集等作用[22]。木犀草素通过PI3K/AKT信号通路抑制缺血再灌注损伤诱导的肌质网/内质网钙ATP酶2a活性的降低,从而产生心肌保护作用,同时减少乳酸脱氢酶的释放和细胞凋亡[23]。山柰酚抗缺血再灌注损伤可能与抗氧化、抑制巯基蛋白酶-3有关[24]。丹参酮ⅡA通过激活PI3K/AKT/mTOR信号通路来预防心肌缺血再灌注损伤[25]。黄芩苷元可以增强心肌抗氧化能力,减轻中性粒细胞介导的炎症损伤,降低心肌缺血/再灌注损伤诱导的肌酸激酶和乳酸脱氢酶的释放,降低心肌梗死和心肌细胞凋亡的发生率[26]。
PPI网络分析显示,IL6、AKT1、VEGFA、CXCL8、PTGS2、IL1B、NOS3、MAPK8、CCL2、MMP9等可能为丹参-红花治疗CHD的核心靶点。本研究提示与CHD相关的靶点有9个,分别为IL6、AKT1、VEGFA、CXCL8、PTGS2、IL1B、NOS3、CCL2、MMP9。白细胞介素-6(Interleukin-6,IL-6)是一种上游炎症介质,在引起动脉粥样硬化的下游炎症反应中起着核心作用,具有IL-6受体变异的个体CHD患病风险降低[27]。蛋白激酶B1在心肌细胞、内皮细胞和血栓细胞等心血管系统细胞的功能行为中具有明确的调节作用,蛋白激酶B1基因敲除小鼠表现出严重的动脉粥样硬化、闭塞性冠状动脉疾病[28]。血管内皮生长因子A是促血管生成神经保护因子,在血管生成、修复和重塑过程中发挥着重要作用,影响动脉粥样硬化的形成[29]。IL-8是一种趋化因子CXC,可诱导内皮细胞和平滑肌细胞的迁移和增殖,在冠状动脉粥样硬化中,IL-8能通过其血管生成特性促进斑块形成[30]。环氧合酶-2衍生的前列环素通过抑制沉默信息调节因子-1依赖的组织因子来调节动脉血栓形成,同时前列环素具有血管舒张和抗血小板作用[31-32]。CHD患者的高冠状动脉钙负荷与血清IL-1β水平显著升高有关,其通过促进成骨转录程序而成为血管平滑肌细胞钙沉积的关键驱动,IL-1βmAb可抑制低密度脂蛋白受体缺陷小鼠的主动脉钙化[33-34]。一氧化氮合酶3受剪切力和血管舒缓激肽及乙酰胆碱等刺激后释放一氧化氮以促进血管舒张,抑制血小板聚集和黏附,参与内皮祖细胞的活化、平滑肌细胞增殖等过程[35]。CC基序趋化因子配体2主要由炎症细胞和内皮细胞表达,其在促炎刺激和组织损伤后表达水平上调,在动脉粥样硬化的发病机制中起着重要作用[36]。基质金属蛋白酶9参与动脉粥样硬化的各个阶段,通过破坏内皮细胞周围的基底膜促进单核细胞向内皮细胞上迁移,促进平滑肌细胞迁移到动脉粥样硬化病变部位,并在那里增殖和分泌胶原以及形成纤维帽所需的其他细胞外基质蛋白[37]。
GO富集分析结果显示,生物过程主要涉及一氧化氮生物合成过程的正调控、炎症反应、缺氧反应、凋亡过程的负调控、血管生成、细胞对缺氧的反应等。细胞组分主要涉及细胞外间隙、受体复合体、细胞表面、细胞质核周区、细胞器膜、质膜、血小板α颗粒腔、细胞外基质等。分子功能主要涉及酶结合、类固醇激素受体、蛋白质结合、细胞因子活性、类固醇结合、肾上腺素结合、蛋白质均聚活性等。
KEGG通路富集分析结果中与CHD相关度较高的通路有5条,分别为流体剪切应力与动脉粥样硬化通路、IL-17信号通路、HIF-1信号通路、TNF信号通路、松弛素信号通路。剪应力代表了血流施加在血管壁内皮表面的摩擦力,与动脉粥样硬化的发展相关,紊乱血流相关的“启动”状态使内皮细胞更容易受到高低密度脂蛋白胆固醇和高血糖等危险因素的影响,并激活多种炎症事件,包括通透性增加、活性氧生成、核因子κB的激活等[38-39]。另外,作用于血管内皮细胞表面的流体剪切应力的增加可以导致细胞内一氧化氮合酶活性显著升高,从而增加血管内皮细胞一氧化氮的生成[40]。IL-17调节多种炎症介质的表达,包括肿瘤坏死因子-α(Tumor Necrosis Factor-α,TNF-α)、IL-1β和γ干扰素,此外还诱导核因子κB的激活,IL-17介导的促炎症介质到达一个共同的下游信号通路,导致动脉粥样硬化[39-40]。缺氧诱导因子-1(Hypoxia-inducible Factor-1,HIF-1)通过细胞特异性反应,作用于内皮细胞、血管平滑肌细胞和巨噬细胞,上调血管内皮生长因子(Vascular Endothelial Growth Factor,VEGF)、一氧化氮、活性氧和血小板生长因子,引起内皮细胞功能障碍、血管生成和炎症,在动脉粥样硬化的发展中起关键作用[43];同时HIF-1信号通路对组织缺血后的恢复也十分必要,HIF-1可上调促血管生成的VEGF及促血管舒张的相关蛋白基因的表达,从而减轻组织缺血损伤[44]。巨噬细胞清道夫受体和泡沫细胞的形成在动脉粥样硬化的发病机制中起着关键作用,TNF-α通过转录和转录后过程下调巨噬细胞清道夫受体基因表达,而TNF-α诱导的MAPK通路在巨噬细胞清道夫受体的转录调控和受体表达增加中起重要作用[45]。松弛素保护心脏的能力很可能是通过其抗纤维化、抗心肌细胞肥大、抗炎和血管舒张作用介导的,同时也可直接刺激心肌的再生和修复[46-47]。
综上所述,可以发现丹参-红花治疗CHD具有多成分、多靶点、多通路协同作用的特点。丹参-红花通过调节冠状动脉粥样硬化进程、减轻血管炎症反应、扩张冠状动脉、抗血栓形成、减轻心肌缺血缺氧损伤,从而发挥治疗CHD的作用。本研究初步揭示了丹参-红花治疗CHD的可能成分、潜在靶点以及信号通路,为进一步开展丹参-红花治疗CHD的相关研究提供了新的思路。
