生物源Fe(Ⅱ)的形成及其在污染控制中的应用
2022-09-27冯威刘慧徐喜旺陈晨陈学萍陆永生
冯威,刘慧,徐喜旺,陈晨,陈学萍,陆永生
(上海大学环境与化学工程学院,上海 200444)
铁元素是恒星核聚变的最终产物,是地壳中含量第四高的元素,普遍存在于地球环境中的各个圈层。铁在自然环境中的主要形式为Fe(Ⅲ)和Fe(Ⅱ),Fe(Ⅲ)在近中性pH下不溶,Fe(Ⅱ)则较易溶解且更易参与各种化学和生物过程,但在中性有氧条件下易被氧化,因此固体矿物是铁元素在自然环境中的主要赋存形式。
铁对绝大部分生命形式至关重要,自然界中铁参与的各种氧化还原反应是许多微生物生存和发展的基础,多种不同生理结构的微生物均演化出利用铁为底物进行代谢的能力。微生物学和地质学上越来越多的研究成果表明,铁呼吸可能是地球上最早的微生物呼吸形式〔1〕。
长期以来,自然界中Fe(Ⅲ)还原一直被认为由化学过程主导。直到1980年开始,通过还原Fe(Ⅲ)获得能量的微生物陆续被发现〔2-3〕,微生物介导的异化铁还原才被认为是自然界中铁还原的重要途径。研究表明,微生物驱动Fe(Ⅲ)还原形成的生物源Fe(Ⅱ)对N、P和S等营养元素的循环及污染物的迁移转化具有重要意义(如图1所示)。

图1 生物源Fe(Ⅱ)应用于污染控制的机制Fig.1 Mechanisms of application of biogenic Fe(Ⅱ)in pollution control
1 生物源Fe(Ⅱ)的形成
1.1 Fe(Ⅲ)还原微生物
厌氧条件下很多微生物在呼吸过程中产生电子,通过胞内电子转移酶将其转移给胞外Fe(Ⅲ)产生Fe(Ⅱ),通常把这些微生物称为异化铁还原菌(Dissimilatory Fe(Ⅲ)-reducing microorganisms,DIRB)。这一过程中产生的Fe(Ⅱ)称为“生物源Fe(Ⅱ)”。异化铁还原菌按照能否利用还原Fe(Ⅲ)产生的能量进行生长分为呼吸型和发酵型两类〔4〕。呼吸型异化铁还原菌以Fe(Ⅲ)作为最终电子受体,贮存能量用于生长;发酵型异化铁还原菌在有机物发酵过程中以Fe(Ⅲ)为电子库,基本不从铁还原过程中获得能量。目前,呼吸型异化铁还原菌为主要研究对象。除Fe(Ⅲ)外,铁还原菌还可利用Mn(Ⅲ/Ⅳ)、U(Ⅵ)、硫代硫酸盐、亚硫酸盐、硝酸盐、氧气、卤代有机物和其他有机污染物等作为电子受体〔5〕。
铁还原菌能在多种环境中生存,其种属类别分布于古菌、细菌和真菌〔4〕。海底及湖泊沉积物中的异化铁还原菌主要为希瓦氏菌(Shewanella)和地杆菌(Geobacter),地下水中则以地杆菌和团泛菌(Pantoea agglomerans)为主〔6〕。目前已知的铁还原微生物已超过200种,且绝大部分为革兰氏阴性菌,其中希瓦氏菌属和地杆菌属作为铁还原菌研究的模式菌种已有大量研究成果。
希瓦氏菌是兼性厌氧菌,属于γ-变形杆菌纲,大部分分离自海洋环境。希瓦氏菌可以利用甲酸盐、丙酮酸盐或乳酸作为电子供体,但不能利用乙酸。S.oneidensisMR-1是Shewanella菌属中研究最为广泛的菌株,首次分离自美国纽约Oneida湖,作为模式菌株首先完成全基因组测序并深入研究〔7〕。
地杆菌是严格厌氧菌,是厌氧环境中分布最广泛的铁还原菌,属于δ-变形杆菌纲。地杆菌除了能利用甲酸、乙酸、乙醇等简单有机物外,还能利用芳香烃、含氯有机物等作为电子供体。G.metallireducens和G.sulfurreducens是地杆菌中研究最深入的两种,分别分离自美国Potomac河底泥和美国Oklahoma州被烃污染的沟渠〔8〕。
1.2 Fe(Ⅲ)的微生物还原机制
由于大部分自然环境近中性,Fe(Ⅲ)主要以不溶物的形式存在,难以像溶解性电子受体如硝酸根、硫酸根等通过扩散作用进入细胞内。为了将电子传递到细胞外,实现难溶性Fe(Ⅲ)的还原,Fe(Ⅲ)异化还原微生物形成了直接接触、电子穿梭体、螯合剂和纳米导线四种机制〔8〕,见图2。

图2 Shewanella oneidensis MR-1对Fe(Ⅲ)矿物的还原机制Fig.2 Reduction mechanisms of Fe(Ⅲ)minerals by Shewanella oneidensis MR-1
在铁还原菌作用下的Fe(Ⅲ)矿物还原性溶解过程中,表面Fe(Ⅲ)被还原为Fe(Ⅱ),由于还原性铁和相邻铁之间的键合较弱,且Fe(Ⅱ)在中性条件下也有较好的溶解性,因此生成的Fe(Ⅱ)很容易释放到水相中形成游离态Fe(Ⅱ)。
1.2.1 直接接触机制
最基本也是最早被认识的异化Fe(Ⅲ)还原机制为直接接触,本质是电子在呼吸链上的传递,即以细胞外膜蛋白为介体将电子直接传递至胞外铁矿物。以目前研究最为透彻的希瓦氏菌的直接电子传递为例,电子传递通道由包括C型细胞色素、醌类、脱氢酶及硫铁蛋白在内的数十种电子传递蛋白组成〔7〕。由亚铁血红素组成的细胞色素CymA、MtrA、MtrC、OmcA和横跨细胞外膜上的非血红素蛋白MtrB形成Mtr途径,将细胞内代谢活动产生的电子传递到细胞膜表面,从而可形成脱氢酶→CymA→MtrA→MtrB→OmcA/MtrC→Fe(Ⅲ)的电子传递途径〔9〕,不同电子受体的电子传输介体有较大差异。
1.2.2 电子穿梭体机制
由于自然环境中Fe(Ⅲ)通常以不溶物的形式存在,不易与菌体外膜接触。因此,铁还原菌可以利用天然有机物如腐殖质或自身合成的氧化还原介体作为电子穿梭体,通过电子穿梭体的多次还原氧化过程将电子从胞外蛋白如MtrC和OmcA转移到固体矿物。内生电子穿梭体对能分泌核黄素(RF)及黄素单核苷酸(FMN)的Shewanella还原Fe(Ⅲ)具有重要意义〔10〕,Geobacter也可以分泌富里酸等作为电子穿梭体促进铁还原过程〔11〕。
1.2.3 螯合剂机制
近年来研究发现铁螯合剂也可促进微生物还原Fe(Ⅲ)。螯合剂与铁矿物形成的可溶螯合铁通过扩散作用被输送到铁还原菌表面后,从外膜蛋白获得电子而被还原。不同于电子穿梭体,溶铁螯合剂不仅可以与铁矿物形成可溶性螯合铁,还会将Fe(Ⅲ)矿物表面或微生物表面结合的Fe(Ⅱ)去除,增加Fe(Ⅲ)矿物与微生物接触的几率,从而促进Fe(Ⅲ)还原〔12〕。
1.2.4 纳米导线机制
异化铁还原菌的纳米导线最先在Shewanella和Geobacter中被发现,它是生长于细胞表面的一种类似菌毛的具有多肽结构的导电性细丝〔13-14〕,其直径一般为纳米级而长度为微米级〔15〕。纳米导线可以在细胞周围形成交错的导电网络,从而作为电子导管远距离向铁矿物传递电子而无需细胞和电子受体之间的直接接触。S.oneidensisMR-1的纳米导线是细胞外膜与周质空间的延伸物,由磷脂双分子层和外膜蛋白组成,Msh和Pil是其两种主要的菌毛蛋白分泌系统〔16〕。G.sulfurreducens的纳米导线是四型菌毛,由细胞色素c分子首尾相接而成,其导电性来源于菌毛蛋白PilA中芳香族氨基酸的苯环π-π共轭现象〔17〕。
1.3 次生Fe(Ⅱ)矿物的形成
生物源Fe(Ⅱ)既包括游离态Fe(Ⅱ),也包括由游离态Fe(Ⅱ)催化诱导或共沉淀作用形成的次生矿物。铁还原菌形成生物源游离态Fe(Ⅱ)后,会和铁(氢)氧化物发生一系列复杂反应,包含吸附、电子传递、还原溶解、原子交换和晶相重组,从而引起向次生矿物的转化过程〔18-20〕。J.R.LLOYD认为,异化还原生成的Fe(Ⅱ)被铁矿物吸附后会与其发生表面化学反应,改变铁矿物的晶型或与周围其他物质共沉淀,形成次生铁矿物〔21〕。
除了Fe(Ⅲ)还原菌的种群特性,次生矿物形成过程还会受到Fe(Ⅱ)浓度、电子穿梭体、共存阴阳离子以及铁矿物种类等的影响。例如,铁氧化物还原生成的Fe(Ⅱ)可诱导水铁矿转化成针铁矿、菱铁矿、赤铁矿和磁铁矿等多种产物,不同产物的形成会受Fe(Ⅲ)还原速率和环境pH等因素影响。J.M.ZACHARA等〔22〕的研究表明pH为6.5左右时,Fe(Ⅱ)诱导形成次生铁矿的反应速率最大。当水铁矿还原速率很低,产生的Fe(Ⅱ)全部被表面位点所吸附,此时主要形成针铁矿和赤铁矿;随着还原速率增加,Fe(Ⅱ)吸附达到饱和,主要产物为磁铁矿;当Fe(Ⅱ)浓度很高,且环境存在一定浓度的HCO3-时,会形成菱铁矿并抑制磁铁矿生成,C.M.HANSEL等也得到类似的研究结果〔23〕。电子穿梭体通过加速Fe(Ⅲ)微生物还原速率,提高矿物周围Fe(Ⅱ)浓度,进而影响次生铁矿的形成及种类〔24〕。当环境中存在一定量的HS-和H2S,游离态Fe(Ⅱ)可与其结合形成多种铁硫矿物。
2 无机污染物的治理
2.1 氮磷硫等营养物质的去除
2.1.1 氮
生物源Fe(Ⅱ)以生物或非生物的方式与氮循环密切关联。众多研究成果表明,和NO2-被游离态Fe(Ⅱ)、矿物表面结合态Fe(Ⅱ)或矿物结构中的结构态Fe(Ⅱ)化学还原后,可产生NO、N2O、N2、等多种产物,但N2O或是主要产物甚至唯一产物〔25-30〕。Fe(Ⅱ?)与难以直接发生化学反应,但在Cu2+、铁氧化物和黏土矿物等催化剂的存在下,这一反应被大大加速〔31〕。相比于硝态氮,在自然环境pH即6~8下亚硝态氮与Fe(Ⅱ)之间的反应则要容易得多,且磁铁矿、菱铁矿等中结构态Fe(Ⅱ)要比溶解态Fe(Ⅱ)反应性更强〔32〕。P.DHAKAL等〔25〕报道了磁铁矿与和的反应活性,指出磁铁矿去除硝态氮的速率比亚硝态氮慢得多,速率常数分别为1.4×10-4h-1及1.2×10-3h-1;向体系中添加游离态Fe(Ⅱ)之后,NO2-的去除速率提高了约3倍。在纯磁铁矿体系中,由于没有检测出溶解态Fe(Ⅱ),他们推测磁铁矿中的结构态Fe(Ⅱ)是亚硝态氮得以被还原的原因,并认为在含有磁铁矿的环境中,氮氧化物可以通过多相电子转移过程向气态氮转变,先被Fe(Ⅱ)还原成NO,NO再被还原成N2O。Yongsheng LU等〔27〕研究了Shewanella oneidensisMR-1和水铁矿/磁铁矿体系中NO2-的转化机理,结果表明在反应启动阶段,伴随着生物源Fe(Ⅱ)的形成,Shewanella oneidensisMR-1驱动亚硝酸盐还原为氨并使乳酸氧化;而在运行阶段,生物源Fe(Ⅱ)化学还原亚硝酸盐是产生气态氮(N2O)的唯一原因。此外,广泛分布于各种水体、湖泊底泥及厌氧沉积环境中的硝酸盐依赖厌氧亚铁氧化菌还可以经由酶促反应耦合Fe(Ⅱ)的氧化和、NO2-的还原,形成NO、N2O、N2等不同产物,具体取决于该菌的代谢产能和营养类型〔33〕。
2.1.2 磷
铁(氢)氧化物因具有较大的比表面积而对磷具有很强的吸附能力,缺氧环境中Fe(Ⅲ)的微生物还原能够释放被其结合固定的磷,进而被吸附在环境中其他交换位点上,或形成蓝铁矿等沉淀,或浸出或被植物和微生物吸收固定,提高磷的生物可利用性〔34〕。而当Fe(Ⅱ)被各种因素氧化后形成的Fe(Ⅲ)又能够重新吸附磷。
在富铁、富磷的还原性环境下,铁还原菌推动磷酸盐的固定形成蓝铁矿。蓝铁矿在环境中广泛分布,水淹土壤、沼泽、各种水体及富营养化水体底部沉积物中均有发现〔35〕。Shu WANG等〔11〕研究发现地杆菌自生分泌的富里酸,能促进异化铁的还原和蓝铁矿的回收,并指出Fe/P=1批次的铁还原率最高,为2.29 mmol/(L·d),是Fe/P=3批次的2.66倍。蓝铁矿在自然界磷循环中具有重要作用,鉴于其稳定的化学性质和难溶解性,M.ROTHE等〔36〕和M.EGGER等〔37〕估算进入水体中的总磷约有20%~40%被铁以蓝铁矿沉淀形式固定在水体底部,一定程度上可减轻水体富营养化。此外,城市污水厂剩余污泥中也有发现蓝铁矿的存在,并且是磷在污泥中的重要沉淀形式〔38〕。目前,城市污水处理过程中以蓝铁矿的形式回收磷作为一种新的技术获得了大量的关注与研究〔39-40〕,但从污泥中回收蓝铁矿所需的有效分离手段当下还未有研究报道。
2.1.3 硫
2.2 重金属的还原和固定
随着工业的快速发展,重金属在人类活动过程中以多种复杂的方式进入环境。由于重金属的持久性和毒性,重金属污染已成为全球环境和生态系统健康最严重的威胁之一。铁还原菌能够通过胞外电子传递直接还原多种金属元素,其形成的生物源游离态Fe(Ⅱ)对这些金属元素也有还原或固定作用。还原条件下,生物源Fe(Ⅱ)扩散到环境中时,其与Fe(Ⅲ)矿物之间作用过程作为铁循环的重要组成部分,其电子传递、晶相重组和次生矿物过程极大地影响了体系中共存重金属的环境行为〔20,43〕。
自然条件下铁矿物结构中金属离子除Fe(Ⅲ)外,还存在多种其他替代金属元素如Al(Ⅲ)、Si(Ⅳ)、Cr(Ⅲ)和Cu(Ⅱ)等。一方面,厌氧条件下在Fe(Ⅱ)驱动铁矿物晶相重组过程中,环境中游离态和矿物结构中的金属离子,可通过化学键作用被吸附固定或者是重金属取代铁位点,被重新固定于新生成的矿物结构中,其也可在晶相重组过程中被释放,变为游离态〔44〕。另一方面,新生成的Fe(Ⅱ)/Fe(Ⅲ)生物矿物往往具有纳米颗粒、高表面积和高反应活性等特征,对重金属具有还原或钝化作用。厌氧环境中微生物-Fe(Ⅱ)/Fe(Ⅲ)-(类)金属之间的复杂作用,不仅推动了铁元素的循环,对于各种重金属、类金属和放射性核素的迁移转化也具有重要意义〔43,45〕。
2.2.1 铬、铀的还原
铬是造成环境中重金属污染的主要元素,其在环境中通常以Cr(Ⅲ)和Cr(Ⅵ)的形式存在。Cr(Ⅵ)被还原为Cr(Ⅲ)后毒性大大降低,异化铁还原菌及其形成的生物源Fe(Ⅱ)均可以参与Cr(Ⅵ)的还原过程。A.MOHAMED等〔46〕的 研 究 发 现,厌 氧 条 件 下Shewanella oneidensisMR-1可以在8 h内还原65%的Cr(Ⅵ)。在三元复合体系Shewanella oneidensis-针铁矿-腐殖酸的作用下,伴随着生物源Fe(Ⅱ)的形成,Cr(Ⅵ)还原速率大幅增加79%,并且还原效率增加了1.3倍,这表明生物源Fe(Ⅱ)促进了Cr(Ⅵ)的还原。XPS分析表明,Cr(Ⅵ)被还原为Cr(Ⅲ)的最终产物为沉淀在细菌细胞表面的Cr(OH)3和Cr2O3。Yangyang YU等〔41〕利用Shewanella oneidensisMR-1合成生物源纳米级FeS并用其还原Cr(Ⅵ),结果表明0.2 mmol/L的Cr(Ⅵ)在24 h内能够被1 mmol/L的纳米级FeS完全还原。
铀是放射性元素,水溶性高的U(Ⅵ)在环境中易于迁移,但其被铁还原菌或Fe(Ⅱ)还原所形成的U(Ⅳ)由于难溶而易于固定,因此利用异化铁还原作用能够有效抑制铀在厌氧地下水、土壤环境中的迁 移 扩 散。T.BEHRENDS等〔47〕研 究 了Shewanella putrefaciens和赤铁矿体系中U(Ⅵ)的生物还原与化学还原竞争,发现生物源Fe(Ⅱ)的表面催化还原作用是U(Ⅵ)还原的主要途径。厌氧条件下由生物源Fe(Ⅱ)诱导形成的次生Fe(Ⅱ)矿物能够实现铀的还原,但不同种类矿物的还原产物不尽相同。E.J.O’LOUGHLIN等〔48〕发现,次生矿物为绿锈的培养体系对于U(Ⅵ)的去除率显著高于磁铁矿和菱铁矿体系,48 h内U(Ⅵ)的浓度从初始的500 µmol/L分别降至1.5、392、472 µmol/L,此外绿绣和磁铁矿的体系中有纳米U(Ⅳ)颗粒形成,而菱铁矿只在其表面吸附U(Ⅵ)。H.VEERAMANI等〔49〕发现铁还原菌介导下形成的磁铁矿有利于结构有序、晶态的UO2形成,而蓝铁矿则导致单体U(Ⅳ)物种的形成,U(Ⅵ)还原产物受周围环境的矿物学和地球化学组成以及固相还原剂界面溶质-固相化学的影响。
2.2.2 镉、铅的固定
镉、铅在环境中的溶解度低,且一般以正二价的形式存在,生物源Fe(Ⅱ)对其没有还原作用。当异化铁还原过程发生时,吸附在其上的重金属会释放到环境中,致使重金属的活性增加,但随后由生物源Fe(Ⅱ)等形成的次生矿物又能够重新固定重金属。Chenchen LI等〔50〕利用Shewanella oneidensisMR-1还原负载了Cd的Fe(Ⅲ)絮体纯培养体系中发现,Fe2+和Cd2+在培养48 h后达到最大值但随后降低,原因在于由生物源Fe(Ⅱ)形成的次生针铁矿和磁铁矿能够重新吸附释放的Cd。E.M.MUEHE等〔51〕利用Geobacter还原Cd负载的水铁矿,在Cd2+高达112 mg/L的条件下,随着Fe(Ⅲ)还原的持续进行,Cd与生物源Fe(Ⅱ)以共沉淀的方式被固定并形成含有CdCO3、FeCO3及CaCO3的 混 合 矿 物 相。同 样,铅 也会随着铁矿物的异化还原溶解释放进环境中,随后铅也可能在铁还原菌细胞内和次生矿物表面形成含铅的结晶沉淀〔52〕。
3 有机污染物的降解
铁还原菌还原Fe(Ⅲ)为Fe(Ⅱ)的过程所需要的电子一般来源于简单有机物,众多证据表明,在湿地、热泉和根际土壤等氧化还原交替频繁的环境中,铁呼吸是有机碳矿化的主要贡献者〔34〕,异化铁还原过程在简单有机物的降解过程中产生重要作用。此外,铁还原菌还可利用部分有机污染物质为电子供体或将电子传递给胞外有机物对其降解,其代谢过程形成的生物源Fe(Ⅱ)作为还原性物质,又能够促进环境中有机污染物的降解并使得Fe(Ⅲ)能够再生。土壤、地下水环境中丰富的铁矿物以及存在的多种可被异化铁还原菌利用的电子供体,为生物源Fe(Ⅱ)形成及其对有机污染物的还原作用提供了良好基础。图3描述了多卤代甲烷〔53〕、硝基芳香族化合物〔54〕、四氯乙烯〔55〕、DDT〔56〕等几种典型有机污染物在Fe(Ⅱ)矿物或表面结合Fe(Ⅱ)作用下的可能降解途径。
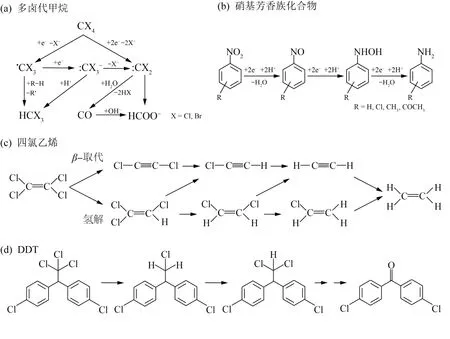
图3 Fe(Ⅱ)矿物或表面结合Fe(Ⅱ)对污染物的可能降解途径Fig.3 Proposed degradation pathways of pollutant by Fe(Ⅱ)minerals or surface-bound Fe(Ⅱ)
3.1 含氯有机物
含氯有机物在工业过程中被广泛用作溶剂、脱脂剂或萃取剂,并随着人类活动进入自然环境危害人类健康。对于含氯有机物,铁还原菌可直接还原脱氯,也可通过还原Fe(Ⅲ)提供游离态、吸附态Fe(Ⅱ)和结构态Fe(Ⅱ),从而进行化学还原脱氯反应。厌氧土壤和水体中的多种有机氯化合物〔56〕可以被生物源Fe(Ⅱ)及其化合物和结合体系还原。污染环境中Fe(Ⅲ)异化还原与有机氯脱氯密切相关,厌氧土壤中Fe(Ⅲ)还原能促进双对氯苯基三氯乙烷(DDT)的还原转化〔57〕。S.BEA等〔58〕发现S.putrefaciensCN32耦合针铁矿体系对四氯化碳的还原脱氯速率(0.043 d-1)比纯菌体系(0.014 d-1)快2倍,主要原因在于还原针铁矿形成的Fe(Ⅱ)与磷酸盐结合形成生物源蓝铁矿,氯仿(16.1%~29.4%)、一氧化碳(2.4%~23.8%)和甲酸盐(0~58.0%)是主要产物。S.putrefaciensCN32还能在特定条件下形成生物源FeS纳米颗粒,其对四氯化碳的脱氯速度提升了8倍,并表现出比化学合成FeS高5倍的脱氯活性〔59〕。
还原性环境中,当Fe(Ⅱ)吸附、结合到铁氧化物、黏土矿物表面时,体系反应活性大大提高。多卤代甲烷、四氯乙烯、六氯乙烷等多种卤代烷烃和烯烃能在Fe(Ⅱ)结合铁矿物体系下发生还原脱卤反应〔53-54〕。这些反应过程会受到铁矿物特性、Fe(Ⅱ)浓度、pH等因素影响。Fangbai LI等〔56〕研究了Shewanella decolorationisS12和α-FeOOH在厌氧条件下对DDT的还原性脱氯。结果表明双对氯苯基二氯乙烷(DDD)是DDT还原性脱氯的主要产物,并指出微生物形成的生物源Fe(Ⅱ)吸附α-FeOOH表面后能增强DDT的还原性脱氯,16 d后的脱氯效果从纯菌组的60%提高至95%,而仅存在游离态Fe(Ⅱ)的化学对照组则没有观察到脱氯作用。
3.2 芳香族化合物
芳香族化合物经常在地表和地下环境中被发现,其中许多被认为是有毒的。有些铁还原菌能以Fe(Ⅲ)为电子受体氧化芳香烃,最早发现的Geobacter metallireducensGS-15能够对苯、甲苯、苯酚、对甲基苯酚、苯甲醛等多种芳香族有机物进行降解〔60〕。硝基芳香族化合物(NACs)可被铁还原菌还原降解,也可被生物源Fe(Ⅱ)还原。Fubo LUAN等〔61〕的研究表明,在短时间尺度(<50 h)内,硝基苯还原主要是由S.putrefaciensCN32驱动的,但随后黏土矿物中生物形成的结构态Fe(Ⅱ)对硝基苯的还原作用变得越来越重要。梁剑滔等〔62〕发现高岭石界面吸附Fe(Ⅱ)能在4 h内实现2-NP(2-硝基酚)的100%还原转化,Fe(Ⅱ)/蒙脱石体系中还原率为85.8%,而纯Fe(Ⅱ)的均相反应体系中仅有52.6%。研究表明,NACs被环境中的铁氧化物吸附后可能作为路易斯碱被铁氧化物结构中距离最近的Fe(Ⅱ)还原〔63〕,还原速率主要取决于苯环上硝基数目和取代基。在Fe(Ⅱ)结合铁氧化物体系作用下,NACs会脱除硝基生成相应的苯胺类物质〔62-63〕。
4 展望
微生物驱动Fe(Ⅲ)还原广泛存于自然界中,异化铁还原微生物形成的生物源Fe(Ⅱ)对N、P和S等营养元素的循环及污染物的迁移转化具有重要意义。自然环境中丰富的铁矿物对重金属和有机污染物存在天然的吸附、固定作用,这为利用铁还原菌进行污染场地的原位修复提供了良好的基础。
分子生物学和基因组学技术的发展为揭示铁还原菌形成生物源Fe(Ⅱ)的电子传递详细机制提供了支持,有利于进一步认清其对不同污染物修复的特定机理,从而对其用于环境污染的修复提供理论依据。新技术仍需要发展来提高对微生物胞内各种微量细胞蛋白的检测灵敏度,探索出更多参与铁转化与代谢相关的功能基因,以及在代谢网络水平揭示铁循环与其他元素循环和污染物代谢之间的关联。
铁还原菌能够利用环境中的多种电子供体和电子受体,目前对于这些过程已有大量的研究,但由于其是一个包括生物或者化学作用的复杂体系,如何区分其中的生物和化学作用仍需继续研究。且目前的研究主要是生物源Fe(Ⅱ)与某种单一要素的作用过程,如何将生物源Fe(Ⅱ)和C、N、P、S、重金属和有机污染物间的复杂关系和相互作用耦连起来,如何建立一个系统、全面的体系亟待研究。发掘生物源Fe(Ⅱ)对于不同污染物降解的特性、机理、相关影响因素,及铁还原菌与环境中其他微生物群落的相互作用,将对其在实际污染处理中的应用产生重要的指导意义。
