基于网络药理学方法探究天麻素抗阿尔兹海默症的作用机制*
2022-09-27张科
张 科
(天津医科大学总医院,天津 300052)
阿尔兹海默症(alzheimer’s disease,AD)是一种发病隐匿的中枢神经系统退行性疾病,65岁以上的人群多发,确诊后很难控制,且目前治疗效果不佳[1-3]。随着全球人口老龄化社会的到来,AD 的发病率及患病人数逐年增加,严重威胁老年人群的健康,给人们的生活和社会带来沉重的负担,已经成为亟待解决的一个世界难题[4-7]。现代研究表明,AD的可能的主要病理特征有:β-淀粉样蛋白斑块(β-amyloid plaques,Aβ斑块)、过度磷酸化Tau蛋白形成神经纤维缠结、乙酰胆碱递质减少、炎症反应、神经元丢失及淀粉样血管病等[8]。但是AD发病机制复杂,与多种因素有关,目前确切原因尚不明确。研究表明,氧化应激损伤参与AD的发病过程,并在AD发病机制的众多学说中,氧化应激学说与其他诸多假说之间存在间接或直接的联系[9]。目前AD的治疗药物主要有M型胆碱能受体激动剂、胆碱酯酶抑制剂、抗氧化药物、抑制β-淀粉样蛋白沉积药等[10-11]。由于这些药物的治疗效果仍不太理想,同时某些化学合成类药物还会造成一定的不良反应[12]。因而进一步从中药中探索新的AD治疗药物,是一个重要的研究趋势[13]。
天麻素(gastrodin,GAS),是从兰科植物天麻的干燥根块中提取的一种天然酚类物质,具有较好的镇静、安眠、抗炎、抗氧化自由基作用,对神经衰弱、失眠、头痛有缓解作用[14]。研究表明,GAS通过抑制神经胶质细胞的活化,减少Aβ蛋白的沉积保护神经元,起到改善学习和记忆功能障碍的作用[15-17]。在AD防治方面具有重要的理论意义,但对于GAS的潜在靶点及作用机制仍然不明确。
近年来,基于网络药理学对中药复方或者单体成分进行物质基础、靶点、通路分析的研究成为热点。该方法通过构建多层次网络,从基因、分子和细胞层面阐释药物的作用机制。PharmMapper是一款通过整合DrugBank、BindingDB、Target Bank和PPTD数据库对药效团模型进行反向预测靶点的工具,它能快速预测药物分子作用靶标[18]。本文拟采用该方法探究GAS防治AD的潜在靶点及作用机制,为其进一步的研究提供依据。
1 材料与方法
1.1 预测天麻素的作用靶点 在Pubchem数据库(https://pubchem.ncbi.nlm.nih.gov/)检索关键词“Gastrodin”获取天麻素(CAS号:62499-27-8)的化学结构式,保存为“SDF”格式文件。利用Chem3D 18.0进行MM2力场优化后保存为mol2格式文件并上传至PhrmMapper平台服务器,设定物种为人类,选取z’-scoer>0[19]进行靶点预测,得到结果作为天麻素的靶点。并使用Uniprot数据库,将靶点蛋白名称(Protein name)转换标准基因名(Gene symbol),得到天麻素的潜在靶点。
1.2 筛选天麻素抗AD的靶点 打开Genecards数据库,以“Alzheimer’s Disease”为关键词检索,收集AD疾病靶点,以 Excel 格式导出,然后将1.1中潜在靶点的标准基因名与疾病靶点基因取交集,作为天麻素抗AD的候选靶点。
1.3 构建蛋白互作网络及关键靶点的筛选 蛋白质互作网络(protein-protein interaction networks,PPI)是由蛋白通过彼此之间的相互作用构成,来参与生物信号传递、基因表达调节、能量和物质代谢及细胞周期调控等生命过程的各个环节。系统分析蛋白在生物系统中的相互作用关系,对了解生物系统中蛋白质的工作原理,了解疾病等特殊生理状态下生物信号和能量物质代谢的反应机制,以及了解蛋白之间的功能联系都有重要意义[20]。应用STRING数据库对1.2项的候选靶点基因进行分析,使用Cytoscape软件将分析结果绘制成天麻素抗AD的PPI 网络,并对网络进行拓扑结构分析。使用Cytoscape软件中的“Generate style from statistics”工具设置网络节点的大小和颜色。节点的大小和颜色深浅代表Degree值的大小,边的粗细反映了Combine Score的大小,从中筛选出Degree值排名靠前的靶点作为重要靶点。
1.4 功能注释和KEGG通路富集分析 DAVID不仅是个生物数据库,也是一款在线分析软件。可以用来做基因的差异分析,系统的生物功能注释信息,进行基因本体论(gene ontology,GO)富集分析和KEGG通路分析[21]。将候选靶点导入DAVID6.8数据库,并限定物种为人,进行基因功能注释分析和功能富集分析,然后导出数据,对生物过程(P<0.05)和信号通路(P<0.05)进行筛选,并进行绘图。
2 结果
2.1 天麻素靶点的预测结果 经PhrmMapper平台服务器对天麻素进行靶点预测,将所得靶点蛋白名称转换为标准基因名,删除重复和无效靶点,共获得有效靶点69个,详见表1。
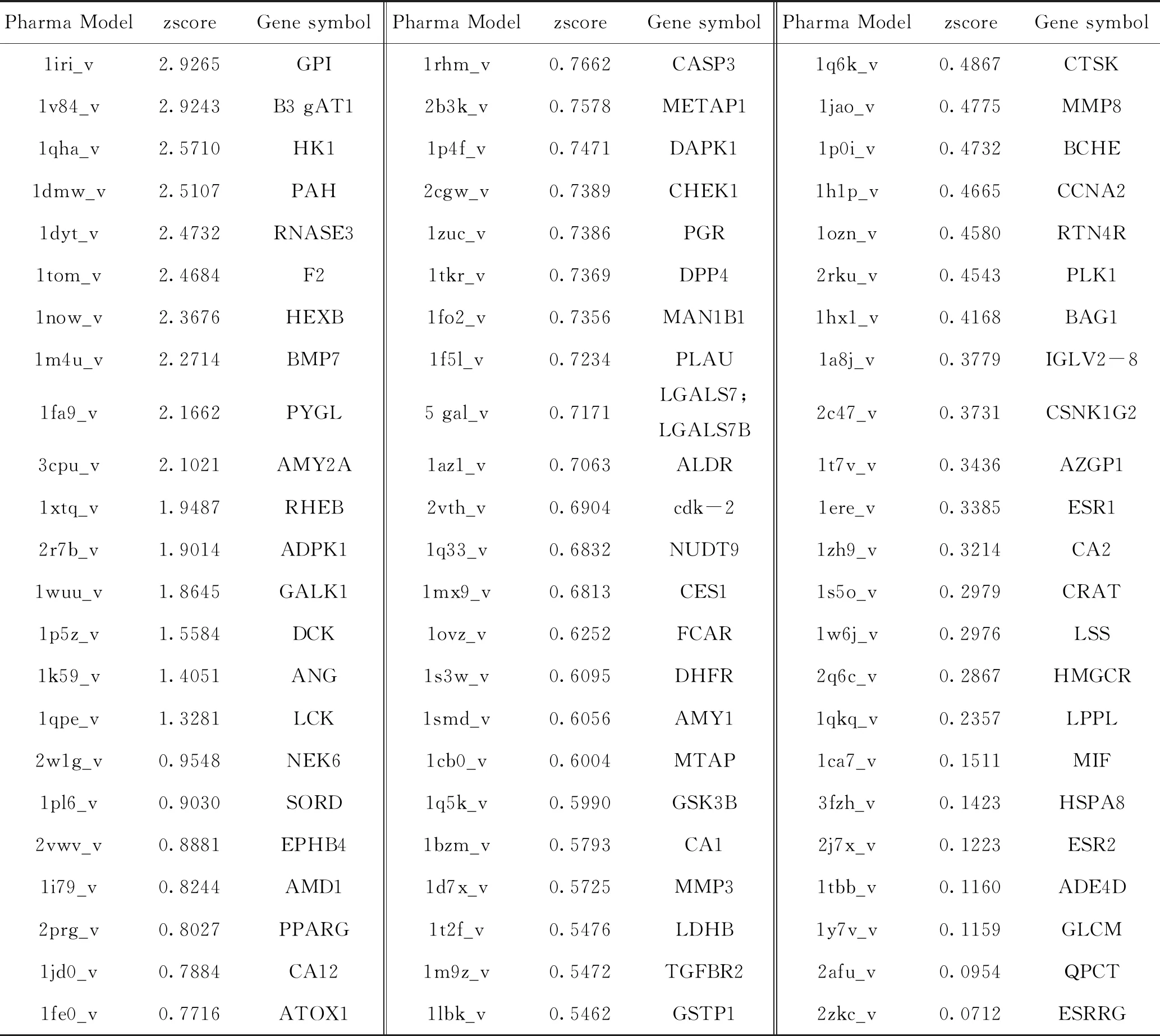
表1 天麻素靶点预测结果
2.2 成分靶点与疾病靶点的交集 Genecards数据库检索得到10972个AD相关靶点基因,使用在线韦恩图工具获得55个天麻素预测靶点与AD的共有基因,见图1、图2。具体为:NUDT9、CA12、GSTP1、CHEK1、PGR、MTAP、BCHE、TGFBR2、FCAR、CA1、CCNA2、RTN4R、CA2、BMP7、HSPA8、PYGL、QPCT、ANg,HK1、GALK1、DAPK1、F2、PPARg,AMD1、PAH、DHFR、MMP3、CTSK、PLK1、MMP8、ESR1、CSNK1G2、BAG1、RHEB、MIF、CRAT、AZGP1、ESR2、ADE4D、
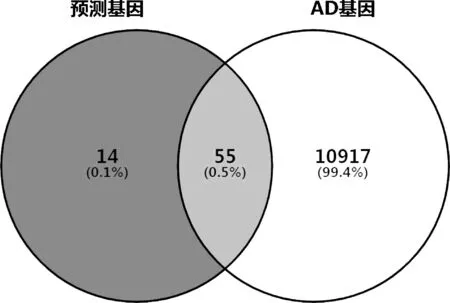
图1 交集基因的韦恩图
ADPK1、ESRRg,GPI、SORD、LDHB、B3 gAT1、EPHB4、GSK3B、PLAU、HEXB、DPP4、CES1、CASP3、ATOX1、LCK、HMGCR。
2.3 PPI 网络的分析 将共有基因导入STRING数据库进行分析,结果以TSV格式导入Cytoscape(v 3.7.1)软件进行分析和可视化处理,节点的大小和颜色的深浅表示节点的度(Degree)的变化。分析结果显示:PPI网络包含44个节点,92条边,平均节点Degree值为3.35,见图2;使用软件中Network Analyzer选项中的Network Analysis模块进行分析,结果网络中Degree值排名前20的靶点包括ESR1、CASP3、HSPA8、CCNA2、LDHB、PLAU、DHFR、PGR、GSK3B、BMP7、PPARg,MMP3、CHEK1、GSTP1、GPI、BAG1、F2、SORD、CTSK、MMP8。其中ESR1(Degree=17),CASP3(Degree=15),HSPA8(Degree=7),CCNA2(Degree=7),LDHB(Degree=7),PLAU(Degree=6)在网络中具有较高的Degree值,网络参数见表2。

图2 潜在靶点与AD靶点蛋白互作网络图
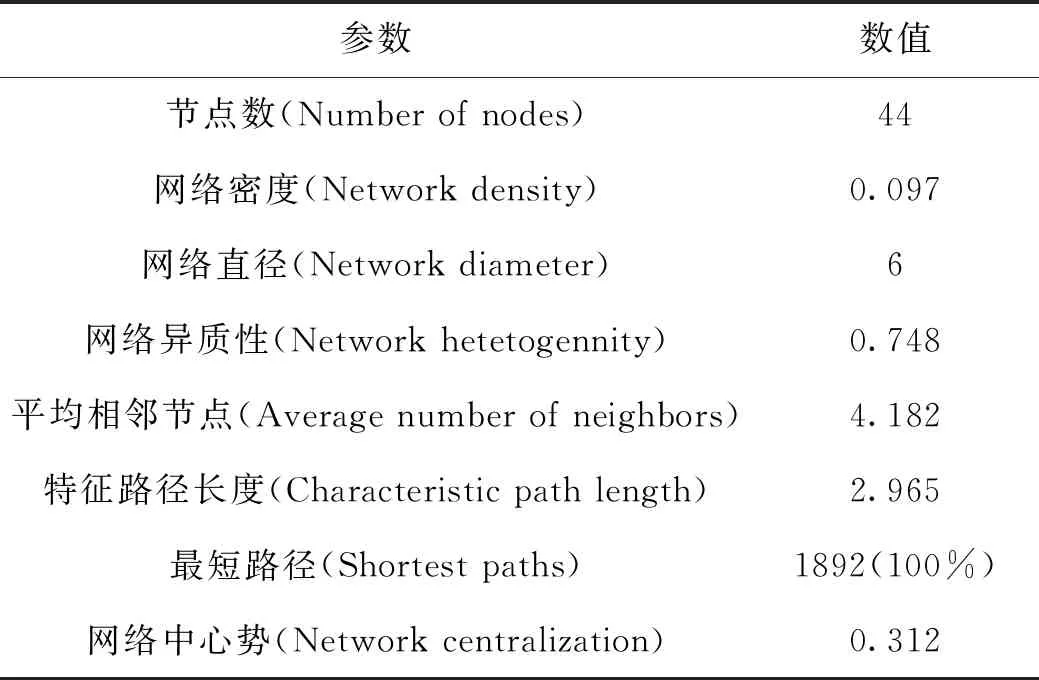
表2 蛋白互作网络参数
2.4 功能注释分析和KEGG通路富集分析结果
2.4.1 GO富集分析结果 DAVID 6.8 数据库得到天麻素与AD的交集基因GO功能富集分析的结果:GO条目79个(P<0.05),包括46个生物过程(BP),8个细胞组成(CC),25个分子功能(MF),主要涉及生物学功能与过程包括:肽基苏氨酸磷酸化、肽基丝氨酸磷酸化、RNA聚合酶Ⅱ启动子的转录起始、激酶活性、碳酸盐脱水酶活性、丝氨酸型内肽酶活性等,具体结果见图3和表3。
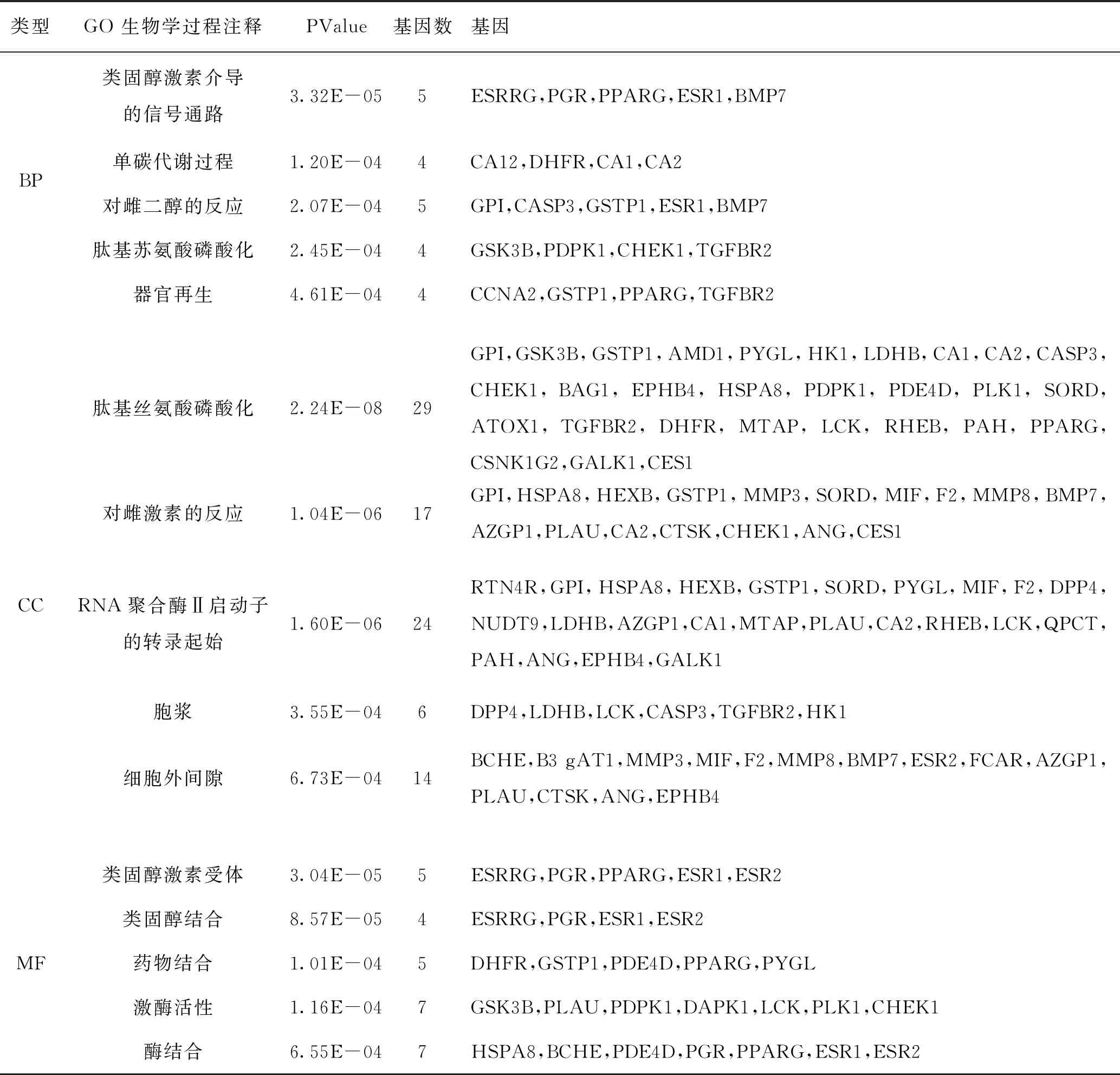
表3 潜在靶点与AD靶点交集基因 GO 富集分析结果(P<0.05,BP、MF、CC的 PValue值前5注释)

图3 GO富集分析结果
2.4.2 KEGG通路富集分析结果 通路富集分析结果得到信号通路8条(P<0.05),包括氨基糖和核苷酸糖代谢、氮代谢、AMPK信号通路、胰岛素信号通路、淀粉和蔗糖代谢、半胱氨酸和蛋氨酸代谢、甲状腺激素信号通路、细胞周期,富集结果见图4和表4。
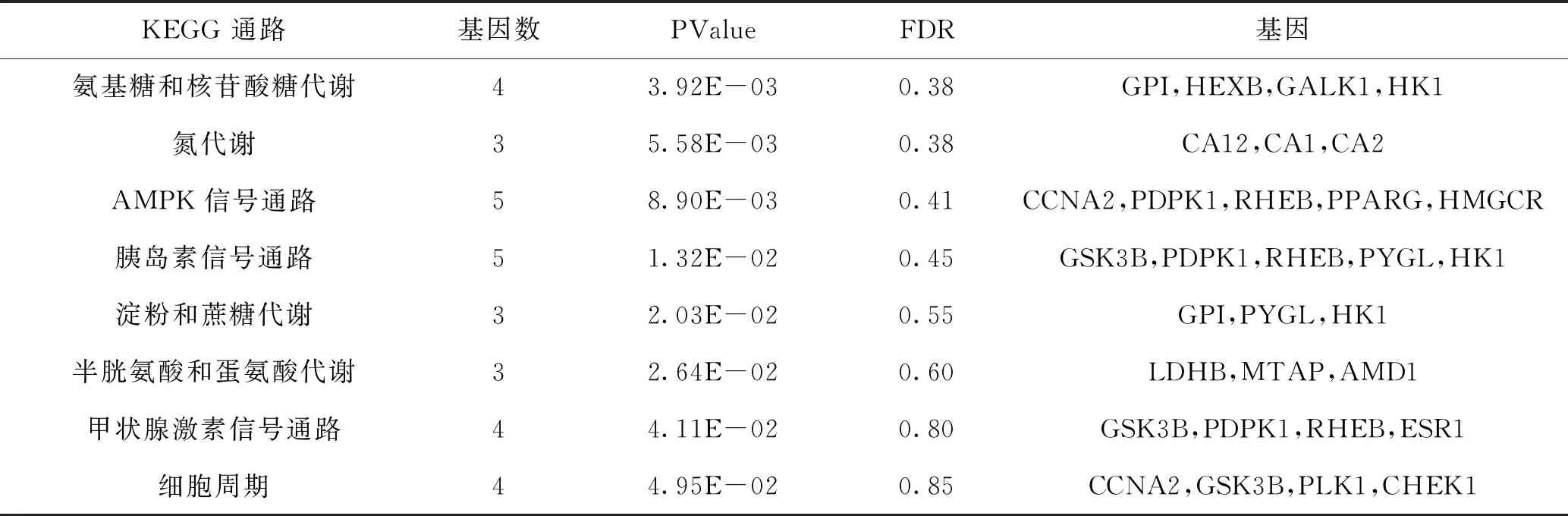
表4 潜在靶点与AD靶点交集基因 KEGG 通路富集分析结果(P<0.05)
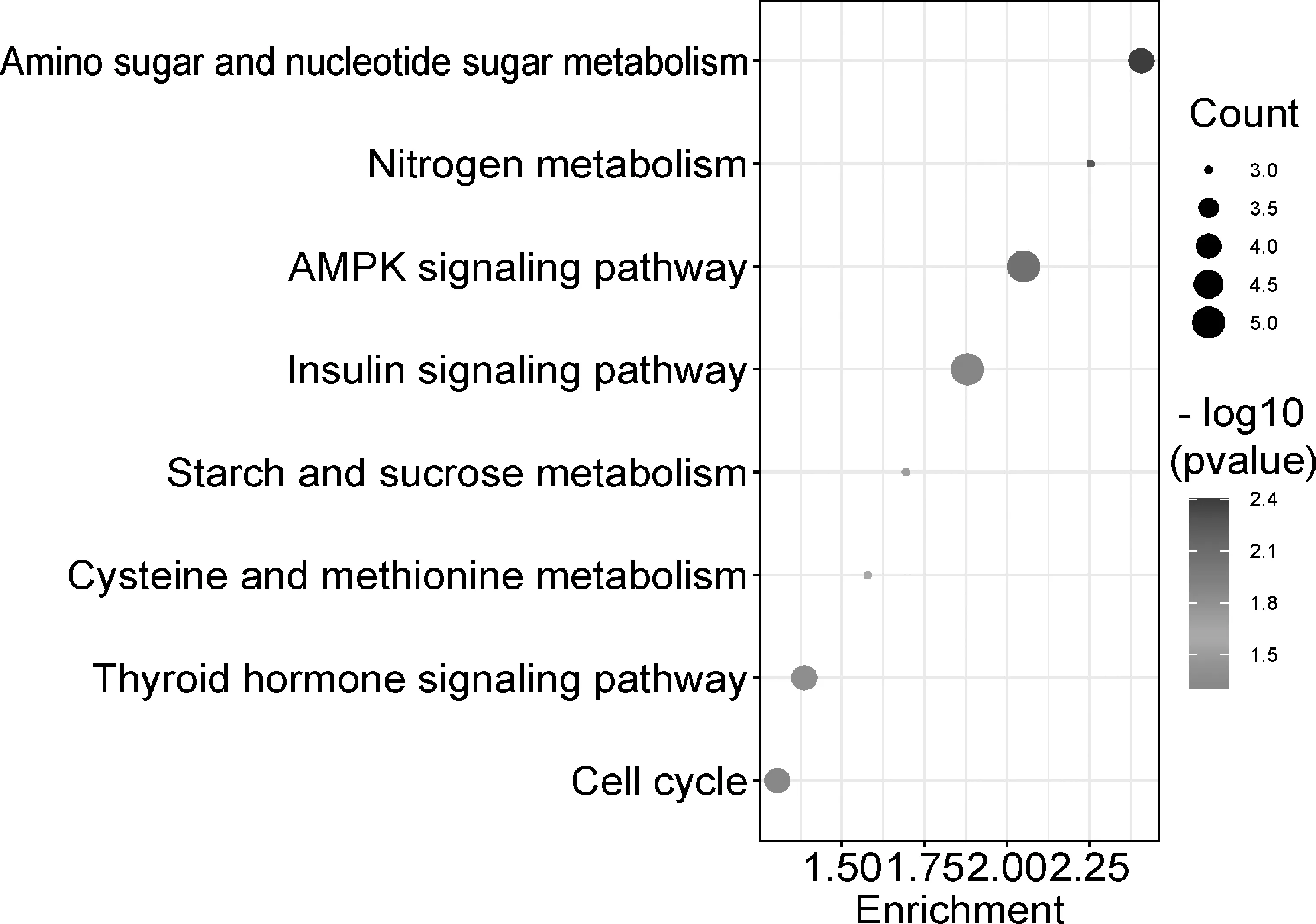
图4 KEGG富集分析的8条通路图
3 讨论
从蛋白互作网络图分析可知,雌激素受体(ESR1),半胱氨酸蛋白酶-3(CASP3),尿激酶型纤溶酶原激活因子(PLAU)在网络中处于关键地位。研究发现,衰老过程中雌激素受体的活性、表达水平及分布变化会引起大脑中雌激素的变化,而AD病情发展的一个重要的危险因素就是脑源性雌激素的下降[23]。Aβ毒性假说是目前AD 致病机制中占主导地位的学说。淀粉样前体蛋白APP由于基因突变,在β分泌酶作用下产生具有神经毒性的Aβ,当其含量升高后,细胞并不能将其代谢掉,在细胞中大量的积累形成Aβ纤维沉积。几乎所有的AD 患者脑细胞中都会出现不同程度的Aβ纤维沉积。胰岛素降解酶(insulin degrading enzyme,IDE)可以促进AD患者脑Aβ降解,在AD患者脑中IDE会随年龄的增加而下降,而雌激素受体β的激活可以上调IDE的表达,从而减少Aβ的沉积。同时雌激素受体的激活可以抑制促凋亡蛋白Bim的表达,增加抗凋亡蛋白Bcl-xL和Bcl-w的含量,从而降低Aβ介导的神经元毒性损伤[24]。同时,选择性雌激素受体激动剂通过激活神经元细胞内钙离子快速内流,引起丝裂原活化蛋白激酶信号传导和细胞外调节蛋白激酶的磷酸化,起到保护神经的作用[25];Caspase-3通过剪切靠近胞浆侧C末端720位的天冬氨酸产生C末端异常的Aβ蛋白,这些蛋白对细胞有毒性作用,可诱导细胞凋亡[26]。另外,当早老素蛋白PS1和PS2基因突变和蛋白质过度表达时,Caspase-3可以酶切上述蛋白产生异常的氨基酸C末端片断,而这些片段可以促进APP水解产生更多Aβ,从而加速神经元的凋亡[27]。PLAU基因可以编码产生尿激酶型纤溶酶原激活因子(uPA),该因子与特异受体相结合,催化生成具有降解神经毒性Aβ蛋白作用的纤溶酶。因此uPA及其受体与AD发病的关系越来越受到关注[28];而HSPA8、CCNA2、LDHB 与AD的关系尚未见相关报道,或可成为潜在作用靶点。
KEGG通路富集分析共得到8条与AD相关的通路,分别是氨基糖和核苷酸糖代谢、氮代谢、AMPK信号通路、胰岛素信号通路、淀粉和蔗糖代谢、半胱氨酸和蛋氨酸代谢、甲状腺激素信号通路、细胞周期,以上通路均与代谢相关。在AD患者中,功能失调的下丘脑导致能量稳态紊乱和随之而来的代谢障碍。在改变的代谢途径中,肥胖、胰岛素抵抗、2型糖尿病和病毒感染增加了患AD的风险。研究显示,AD患者的神经退行性表现与脑能量代谢紊乱有关[29]。研究显示,在AMPKα2敲除的神经元细胞中Aβ生成会增加。可能的机制是由于激活腺苷酸活化蛋白激酶(AMPK)后,调节APP生成进而减少Aβ的产生[30-31]。胰岛素信号通路可以直接或间接地参与Aβ的清除过程。研究发现,人体出现胰岛素抵抗时,升高的胰岛素水平可以提高β分泌酶活性,从而加速APP剪切生成更多的Aβ蛋白。因此通过调节IDE的活性来抑制Aβ的生成[32]。
综上,基于网络药理学方法对天麻素抗阿尔兹海默症的潜在靶点进行了预测,并对潜在靶点进行了蛋白互作研究,以及通路富集分析。天麻素或可以作为治疗AD的一个新的潜在化合物。同时本研究也具有一定的局限性,所得结论均建立于数据库及网络药理学技术,缺乏相关实验的验证。后期将继续从其化合物结构改造、药效评价以及机制验证等方向开展试验,为其进一步深入研究提供思路和参考。
