大蒜素减轻OSAHS模型大鼠学习能力下降及海马神经元凋亡
2022-09-27耿彩虹赵昆朋
王 超,耿彩虹,赵昆朋,嵇 朋
(1.新乡医学院第二附属医院 睡眠医学科,河南 新乡 453002; 2.郑州市第三人民医院 神经内科,河南 郑州 450000)
阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea-hypopnea syndrome,OSAHS)主要表现为阻塞性呼吸暂停、呼吸不足或由睡眠期间上呼吸道反复、部分阻塞引起的氧饱和度下降和睡眠觉醒[1]。大脑对缺氧极为敏感,OSAHS脑部认知损伤主要原因可能为间歇性低氧(intermittent hypoxia,IH)对脑组织的影响,容易诱导某些特定部位(如海马和皮质)神经元细胞凋亡[2]。大蒜素(allicin)是大蒜主要活性成分,具有抑菌、抗肿瘤和病毒、降血糖、预防心血管疾病等多种药理活性,无明显不良反应,安全性高[3]。研究显示,大蒜素可对高糖/缺氧诱导的主动脉内皮细胞具有保护作用[4]。另有一项研究表明,大蒜素可通过突出可塑性调节活性减轻衣霉素诱导的大鼠认知功能缺陷[5]。鉴于以上研究,推测大蒜素或可在OSAHS中发挥改善作用。晚期糖基化终末产物(advanced glycation endproducts,AGEs)是蛋白质和脂类非糖基化后生成物质的统称,炎性反应、氧化应激等可促进AGEs形成[6]。AGEs-糖基化终末产物受体(RAGE)-核转录因子κB(NF-κB)通路是RAGE与AGEs相互作用后具有代表性的一种信号传导途径,OSAHS可激活该通路,损害脏器[7]。大蒜素对缺氧损伤及认知功能的改善作用已有报道,但其是否可通过AGEs/RAGE/NF-κB通路在OSAHS中发挥作用尚不十分明确。基于此,本研究通过建立OSAHS模型,观察大蒜素对OSAHS模型大鼠的影响及可能作用机制,为临床治疗提供参考。
1 材料与方法
1.1 材料
1.1.1 实验动物:SD大鼠,雄性,SPF级,体质量180~220 g,8周龄,100只[厦门万泰沧海生物技术有限公司,许可证号:SCXK(闽)2018-0002]。购入后适应性饲养1周,保持环境通风,温度21~25 ℃,湿度50%~70%,光暗循环12 h/12 h。
1.1.2 试剂:大鼠肿瘤坏死因子(TNF-α)、白细胞介素-6(IL-6)和TUNEL凋亡染色试剂盒(北京索莱宝生物科技有限公司);大鼠AGEs ELISA试剂盒(上海恪敏生物科技有限公司);兔抗大鼠RAGE、B淋巴细胞瘤-2基因(Bcl-2)、Bcl-2相关X蛋白(Bax)、NF-κB p65、p-NF-κB p65一抗及羊抗兔二抗-HRP(Abcam公司)。大蒜素(≥97%,批号A50961)(上海吉至生化科技有限公司);莫达非尼(200 mg/片,批号050618)(湖北威尔曼制药股份有限公司)
1.2 方法
1.2.1 分组和干预方法:大鼠分为对照组、模型组(参照文献[8]使用低氧/复氧模拟舱建立OSAHS模型)、大蒜素低剂量(10 mg/kg)、高剂量(40 mg/kg)组、阳性药物组(莫达非尼,20 mg/kg)。参照文献[9-10]设置剂量,大蒜素使用0.9%氯化钠溶液稀释,低、高剂量组分别按照体质量灌胃给药10 mg/kg和40 mg/kg,阳性药物组给予20 mg/kg莫达非尼。各组均每天给药1次,持续4周。
1.2.2 Morris水迷宫实验检测大鼠学习能力:定位导航实验:记录大鼠搜索并爬上平台的运动轨迹和时间,爬上平台所需时间为逃逸潜伏期。空间探索实验:拆除平台,将大鼠面向池壁放入水中,记录120 s内穿越平台的次数,重复3次,取均值。
1.2.3 样品采集:分离大鼠海马组织,各组取6只大鼠海马组织,置于4%多聚甲醛固定,余下置于-80 ℃存储。
1.2.4 ELISA检测炎性因子水平:取-80 ℃存储的6只海马组织,匀浆、离心,取上清。使用ELISA试剂盒,按照说明书操作步骤检测海马组织TNF-α、IL-6、AGEs含量。
1.2.5 HE染色观察海马组织病理学变化:左侧海马组织(4%多聚甲醛固定)经石蜡包埋,切片、脱蜡、常规HE染色,脱水、透明、中性树脂封固,光学显微镜观察。
1.2.6 TUNEL法观察海马组织神经元凋亡:取海马组织切片,按照TUNEL试剂盒说明书操作步骤对切片染色,显微镜观察海马组织神经元凋亡情况。取5个不同区域视野(10×20),显微镜下观察,并计算凋亡细胞指数(AI),AI(%)=凋亡细胞数/总细胞数×100%。
1.2.7 RT-qPCR检测RAGE、NF-κB p65、Bcl-2、Bax mRNA表达:Trizol法提取左侧海马组织总RNA,检测纯度及浓度,将RNA反转录为cDNA后,并以其为模板进行PCR扩增。扩增条件:95 ℃ 30 s、95 ℃ 5 s、59 ℃ 30 s,40个循环。以β-actin为内参,采用2-△△Ct法定量分析。引物序列见表1。

表1 引物序列Table 1 Sequence of primers
1.2.8 Western blot检测蛋白表达:取右侧海马组织,加RIPA裂解缓冲液离心,取上清液,BCA法确定蛋白浓度。通过SDS-PAGE分离蛋白(100 V、90 min),并转移至PVDF膜(250 mA恒流),5%脱脂牛奶封闭2 h,分别加入1∶500稀释的RAGE、NF-κB p65、p-NF-κB p65、Bcl-2、Bax和β-actin一抗进行孵育(4 ℃,24 h),TBST洗膜后,再加1∶1 000稀释的二抗孵育(25 ℃,2 h),反复洗膜、曝光、显影。Image J软件测定样品各蛋白条带吸光度值。
1.3 统计学分析

2 结果
2.1 Morris水迷宫检测的学习能力
与对照组比较,模型组逃逸潜伏期延长、目标象限行驶时间缩短、跨平台次数减少(P<0.05);与模型组比较,大蒜素低、高剂量组、阳性药物组逃逸潜伏期缩短、目标象限行驶时间延长、跨平台次数增加(P<0.05)(表2)。

表2 各组大鼠学习能力
2.2 TNF-α、IL-6、AGEs水平的比较
与对照组比较,模型组TNF-α、IL-6、AGEs水平升高(P<0.05);与模型组比较,大蒜素低、高剂量组、阳性药物组TNF-α、IL-6、AGEs水平降低(P<0.05);与大蒜素低剂量组比较,大蒜素高剂量组、阳性药物组TNF-α、IL-6、AGEs水平降低,且阳性药物组TNF-α、IL-6、AGEs水平低于大蒜素高剂量组(P<0.05)(图1)。
2.3 海马组织病理学的观察
对照组的海马神经元排列整齐、结构完整,无明显异常变化;模型组的神经元细胞组织间隙扩大、排列紊乱、细胞质稀少且核仁不明显;大蒜素低、高剂量组、阳性药物组的神经元排列较整齐、结构层次较完整、细胞质较均匀且与细胞核边界逐渐清晰、略有少量神经元细胞结构形态出现异常,其中大蒜素高剂量组、阳性药物组接近于对照组(图2)。
2.4 TUNEL法观察海马组织神经元凋亡
与对照组比较,模型组AI升高(P<0.05);与模型组比较,大蒜素低、高剂量组、阳性药物组AI降低(P<0.05);与大蒜素低剂量组比较, 大蒜素高剂量组、阳性药物组AI降低,且阳性药物组低于大蒜素高剂量组(P<0.05)(图3)。

*P<0.05 compared with the control; △P<0.05 compared with model; #P<0.05 compared with low-dose allicin group图1 海马组织TNF-α、IL-6、AGEs水平Fig 1 TNF-α, IL-6 and AGEs levels in hippocampus
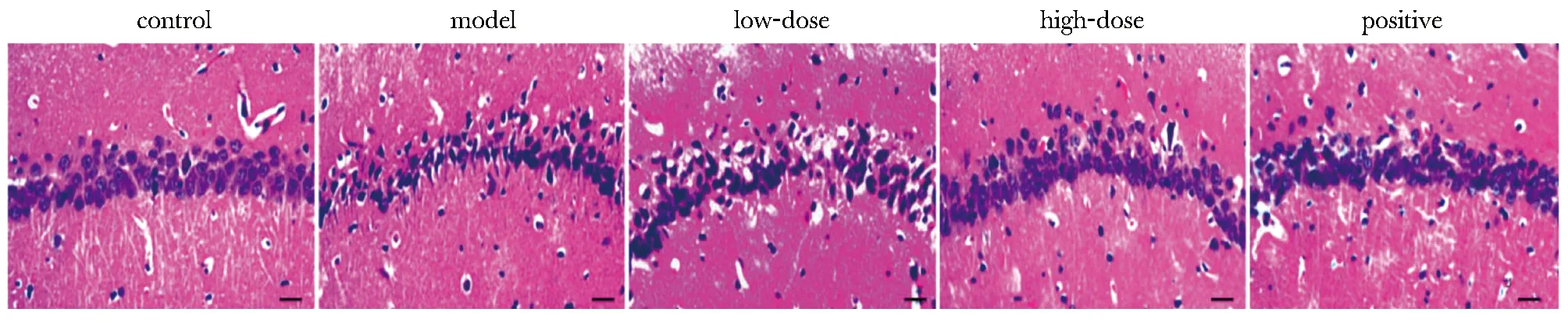
图2 海马神经元的病理学变化Fig 2 Pathological changes of hippocampal neurons(HE×200,scale bar=50 μm)

*P<0.05 compared with the control; △P<0.05 compared with model; #P<0.05 compared with low-dose allicin group; ▲P<0.05 compared with high-dose allicin group
2.5 RAGE、NF-κB p65、Bcl-2和Bax mRNA水平比较
与对照组比较,模型组RAGE、Bax mRNA水平升高,Bcl-2 mRNA水平降低(P<0.05);与模型组比较, 大蒜素低、 高剂量组、 阳性药物组Bcl-2 mRNA水平升高,RAGE、Bax mRNA水平降低(P<0.05);与大蒜素低剂量组比较,大蒜素高剂量组、阳性药物组Bcl-2 mRNA水平升高,RAGE、Bax mRNA水平降低(P<0.05);与大蒜素高剂量组比较,阳性药物组Bcl-2 mRNA水平升高,RAGE、Bax mRNA水平降低(P<0.05)(图4)。
2.6 RAGE、NF-κB p65、p-NF-κB p65、Bcl-2、Bax蛋白水平比较
与对照组比较,模型组RAGE、p-NF-κB p65、Bax蛋白水平升高、Bcl-2蛋白水平降低(P<0.05);与模型组比较,大蒜素低、高剂量组、阳性药物组Bcl-2蛋白水平升高,RAGE、p-NF-κB p65、Bax蛋白水平降低(P<0.05);与大蒜素低剂量组比较,大蒜素高剂量组、阳性药物组Bcl-2蛋白水平升高,RAGE、p-NF-κB p65、Bax蛋白水平降低(P<0.05);与大蒜素高剂量组比较,阳性药物组Bcl-2蛋白水平升高,RAGE、p-NF-κB p65、Bax蛋白水平降低(P<0.05)(图5)。
3 讨论
OSAHS患病率高,可出现情绪障碍,甚至会影响认知能力并增加代谢疾病的风险。OSAHS可能是由睡眠期间反复低氧、再充氧引起的氧化应激反应诱导炎性反应相关易感基因表达及生物活性物质的蛋白质合成,从而引起炎性反应和代谢紊乱,增加心血管疾病与代谢疾病风险。
OSAHS中反复低氧-复氧,产生大量活性氧自由基,使得机体受到损害,其中神经损伤尤为明显,甚至导致脑部神经元丢失;而大脑内海马体在空间记忆、情景记忆和空间导航中起着至关重要的作用。临床研究表明[11],OSAHS出现长期、 反复低氧血症可导致神经和心理缺陷,包括神经认知功能如注意力、记忆力、执行能力和警觉性下降。此外,IH是刺激细胞凋亡常见因素,OSAHS还会导致海马萎缩且体积缩小,与认知功能下降呈正相关[12]。本研究结果发现,大蒜素可有效改善OSAHS大鼠学习认知能力;且经大蒜素干预后,TNF-α、IL-6、AGEs水平和AI较模型组降低,炎性反应得以有效改善,神经元凋亡减少,表明大蒜素可能通过减轻炎性反应减少脑部神经元丢失,进而提高学习认知能力。此外,HE结果也显示,大蒜素各组海马神经元损伤较模型组均出现不同程度改善,与阳性药物组效果相当,进一步证实大蒜素对OSAHS大鼠的改善作用。
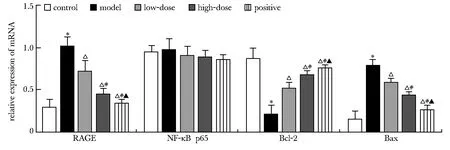
*P<0.05 compared with the control; △P<0.05 compared with model; #P<0.05 compared with low-dose allicin group; ▲P<0.05 compared with high-dose allicin group

A.representative result of Western blot; B.statistical analysis of protein expression level; *P<0.05 compared with the control; △P<0.05 compared with model; #P<0.05 compared with low-dose allicin group; ▲P<0.05 compared with high-dose allicin group
AGEs/RAGE信号加强导致NF-κB活性增加,从而引起细胞因子水平升高,NF-κB活性增加又可反过来上调RAGE表达,在细胞凋亡过程中发挥重要作用[13]。Bcl-2家族在线粒体介导的细胞凋亡途径中起重要作用,Bcl-2/Bax表达水平与细胞凋亡过程密切相关。研究显示,抑制AGEs-RAGE/NF-κB通路可减轻D-半乳糖诱导的神经炎性反应,恢复小鼠记忆功能[14]。此外,小檗碱缓解糖尿病小鼠认知功能障碍与调节AGEs-RAGE/NF-κB通路有关[15]。以上研究均提示AGEs-RAGE/NF-κB通路与神经功能有关。本研究结果显示,大蒜素能显著降低大鼠海马组织RAGE、Bax mRNA和RAGE、p-NF-κB p65、Bax蛋白表达,提示大蒜素可降低OSAHS对机体的损害,可能与抑制AGEs-RAGE/NF-κB通路关键分子表达从而减轻炎性反应和神经元凋亡有关。
综上所述,大蒜素能有效改善OSAHS大鼠学习认知能力,其机制可能通过调节AGEs-RAGE/NF-κB轴相关mRNA和蛋白表达及下游炎性因子发挥作用,本研究结果为临床治疗提供参考。
