羊布鲁氏菌(Brucella melitensis)基因组的对比分析
2022-09-27张宏兴朱万斌宋宇轩
张宏兴,王 原,王 强,朱万斌,张 磊,宋宇轩
(1.陕西省畜牧技术推广总站,陕西 西安 710000;2.宝鸡市畜牧兽医中心,陕西 宝鸡 721000;3.安塞区畜牧兽医服务中心,陕西 延安 717400;4.金昌市畜牧兽医技术推广服务中心,甘肃 金昌 737100;5.西北农林科技大学 动物科技学院,陕西 杨凌 712100)
布鲁氏菌病(Brucellosis),简称布病,病原为革兰氏阴性、兼性细胞内寄生的布鲁氏菌(),人畜共患,是中国法定的二类动物疫病。母畜感染布鲁氏菌的主要临床症状是流产,其次是早产、死胎或弱胎;有些母畜会发生子宫炎或脓肿导致生育能力下降、产乳量下降,有的还会发生关节炎和滑囊炎而导致跛行。公畜患病后主要表现为睾丸炎和副睾炎,后肢麻痹导致运动障碍。对人具有感染性和侵袭力的是羊、猪、牛和犬源布鲁氏菌,其中羊源布鲁氏菌()感染占90%以上,人感染布鲁氏菌病呈全身性发热性疾病,可导致骨关节炎、心内膜炎和神经紊乱。
针对布鲁氏菌的诊断主要有病原学、血清学和核酸检测方法,其中病原学检测是布鲁氏菌病诊断的“金标准”,但布鲁氏菌的分离培养对实验人员和实验环境有一定的要求,需要经过生物安全培训和有资质的专业技术人员在BSL-2(Biosafety Level 2 Laboratory)级以上的实验室操作,因此该法不适于普遍应用。与病原学方法相比,血清学检测是中国当前最普遍的诊断方法,包括虎红平板凝集实验(rose-bengal plate agglutination test,RBT)、试管凝集实验(standard tube agglutination test,SAT)、全乳环状实验(protocol of milk ring test,MRT)、补体结合实验(complement fixation test,CFT)、酶联免疫吸附实验(Enzyme-linked immuonsorbant assay,ELISA)和胶体金免疫层析技术(colloidal gold immunochromatography,GICA)等。随着分子生物学和基因组学的快速发展,越来越多的学者开始研究布鲁氏菌的核酸检测技术,主要包括普通PCR(polymerase chain reaction)、多重PCR和实时荧光定量PCR(real-time fluorescence qPCR)。其中实时荧光定量PCR技术因其特异性强、灵敏度高、用时较短且能对DNA含量进行实时定量等优势,已逐渐成为研究热点。
实时荧光定量PCR技术的发展应用已较为成熟,但运用实时荧光定量PCR技术检测羊布鲁氏菌的技术体系尚不成熟,主要原因在于选择检测的基因序列。本研究基于对NCBI数据库中布鲁氏菌的基因组数据进行分析,比对不同种属来源的布鲁氏菌基因组,筛选羊源布鲁氏菌共有和特有基因序列,以期为羊布鲁氏菌的PCR精准检测提供参考。
1 材料与方法
1.1 羊布鲁氏菌基因组信息
登录NCBI(National Center for Biotechnology Information,NCBI)网站,选择“Genome”,输入羊布鲁氏菌参考基因组名称(),点击list查找完整信息,筛选完整基因组并下载,以bv.1 str.16M菌株为参考。
1.2 羊布鲁氏菌共有和特有基因分析
以羊布鲁氏菌中均存在的同源基因作为共有基因(core gene),获取core gene使用软件cd-hit(v4.6.1版本)。去掉共有基因后,得到非共基因(dispensable gene),所有非共基因与共有基因合并作为泛集(pan gene)。将共有基因序列与NT数据库(Non-Redundant Nucleotide Sequence Databaset)使用软件blastn(版本号为2.2.30+;参数 evalue 1e-5,identify>60%,其它默认)进行比对,筛选羊布鲁氏菌特有基因(specific gene)。其中共有基因(core gene)和特有基因(specific gene)很可能与羊种布鲁氏菌的共性和特性相对应,可以作为羊种布鲁氏菌间功能差异研究依据。
1.3 羊布鲁氏菌致病基因筛选
登录VFDB数据库(http://www.mgc.ac.cn/VFs/download.htm,2019.08.02),下载VFDB_setB_pro.fas VFDB_setB_pro.fas和VFDB_setB_nt.fas两个序列文件。致病性分析使用软件blastp(v2.2.30+),比对获取结果,筛选比对率大于95%的致病基因信息(参数evalue 1e-5,其它默认)。
2 结果与分析
通过NCBI数据库,获得67株羊布鲁氏菌基因组,共有3 699个基因(图1A),经过BLAST比对后得到羊布鲁氏菌共有基因2 850个(图1B),非共有基因849个(图2),分布在41个菌株上,其中SAMN12917484含有63个非共有基因,SAMN12917575含有58个非共有基因。其中26株未筛选到非共有基因,可能为不同研究者上传的相同羊布鲁氏菌菌株导致。
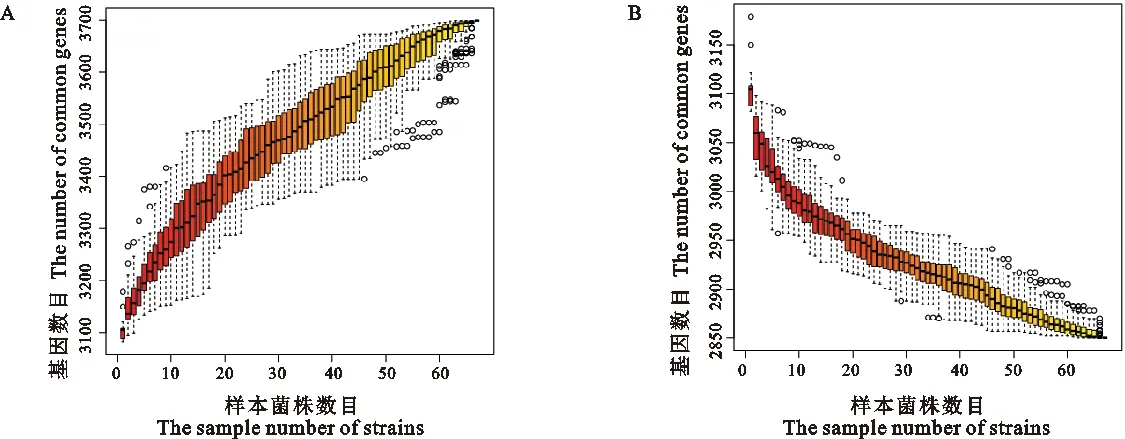
图1 67 株羊种布鲁氏菌所有基因和共有基因溶解曲线图

图2 67株羊种布鲁氏菌的非共基因聚类分析
物种越多共有基因数目越少并趋于稳定,最后保留的基因应具有同源性,且高度保守。在过滤去除部分与近缘物种同源性较高、致病性未注释到的261个基因之后,获得2 589个共有基因用于进一步分析,将得到的2 589个共有基因核酸序列同Nt库比对,并未找到特有基因,可能由于不同菌株间亲缘性密切,基因序列高度相似导致。同时,对2 589个共有基因进行致病性注释,共筛选到可能的8个致病序列,注释到6个基因上,分别为(flagellar motor switch protein FliM,SAMN02603416001957)、(acyl carrier protein,SAMN02603416002347)、(flagellar motor switch protein FliN,SAMN026034 16002460)、(proline racemase family protein,SAMN 02603416000151)、(flagellar biosynthetic protein,SAMN02603416000165)、(flagellar motor switch protein FliN,SAMN02603416000166)、(flagellar type III secretion system pore protein FliP,SAMN0260 3416001111)、(flagellar motor switch protein FliN,SAMN02603416001145)(表1)。

表1 羊布鲁氏菌共有的8个致病基因信息
3 讨 论
关于鞭毛的研究通常建立在细菌运动性的基础上,而布鲁氏菌并无运动特征也是布鲁氏菌一直以来被认为无鞭毛的原因之一。2005年Freti从羊种布氏菌获得的全细胞提取物进行蛋白质印迹分析,在布鲁氏菌指数增长期早期检测到布鲁氏菌鞭毛钩蛋白FliE和鞭毛蛋白FliC的表达,后来又陆续有学者发现布鲁氏菌具有趋化基因外所有鞭毛结构基因,并且在透射电镜下观察其鞭毛属单一极性鞭毛,同副溶血弧菌一样在鞭毛表面包裹着一层鞘膜,有研究发现此鞭毛与布鲁氏菌毒力相关,并在布鲁氏菌持续感染中有不可或缺的意义。FliM、FliN(Flagellar motor switch protein)是形成鞭毛马达旋翼开关复合物(C环)的3种蛋白质(FliG、FliN、FliM)中的1种,作为马达的转子(rotor)位于基底体的基部。另外,FlhB是形成鞭毛基部杆状结构所必需的一种蛋白,FliP是鞭毛Ⅲ型分泌系统孔蛋白,目前对其在布鲁氏菌中的功能研究较少。烯脂酰ACP还原酶是细菌脂肪酸合成的关键酶之一,已经作为新型抗菌药物的作用靶标,用于新的抗菌药物的筛选。流产布氏杆菌同时拥有2个同种类型的烯脂酰ACP还原酶,但是其在布鲁氏杆菌致病性方面的功能有待进一步的研究。ProR家族中的PrpA是编码脯氨酸消旋酶蛋白A或羟脯氨酸-2-差向异构酶蛋白的基因,可使B细胞数量增加以及增强特异性抗体应答,而这些抗体又能促进细胞的感染,且布鲁氏菌以prpA依赖方式在感染过程的急性期,改变INF-γ、IL-10、TGFβl和TNFa的细胞因子水平。
4 结 论
布鲁氏菌是对人畜健康和公共卫生安全能够造成较大威胁的病原,且由于中国畜牧业发展规模庞大、部分区域人畜接触较为密切等因素存在,须对该病严加防控。当前对于该病的诊断方法尚不够准确,各方面的研究仍需加强。本研究通过对NCBI数据库中67株羊布鲁氏菌()菌株基因组信息的分析比对,获得羊布鲁氏菌共有的6个致病基因及其序列,可为羊布鲁氏菌PCR的精准检测提供重要参考。
