高强度间歇训练对心肌梗死大鼠心脏结构和功能的影响
2022-09-26贾思琦王迪鲁燕贾永平
贾思琦,王迪,鲁燕,贾永平*
心血管疾病作为严重威胁人类生命健康的常见病,具有高发病率、高死亡率、多并发症等特点。数据显示,全世界每年死于心血管病的人数从1990年的1 210万增至2019年的1 860万,超过肿瘤,居各种死因之首[1],其中急性心肌梗死(acute myocardial infarction,AMI)会引起心脏左心室重构和功能障碍,造成严重不良事件[2]。目前,AMI在临床上有药物治疗、介入治疗等多种治疗方式,但经首次治疗的AMI患者中,约50%在出院后发生严重冠脉事件[3]。心脏康复(cardia crehabilitation,CR)作为AMI治疗的重要环节,对提高患者生活质量、降低死亡率有重要意义[4]。运动作为CR的核心要素,可能在AMI后的心肌细胞炎症、增殖、成熟三个阶段发挥重要作用[5-7],参与心肌瘢痕形成和左心室重构,可显著改善AMI预后[8]。本研究对AMI大鼠进行4~8周跑步训练观察,分析运动对AMI后炎性反应、血管新生等过程的影响,拟探讨运动对左心室重构和心功能的影响。
1 材料与方法
1.1 实验材料
1.1.1 研究时间 研究自2020年9月至2021年10月。
1.1.2 实验动物 实验选取3月龄雄性SD大鼠共78只,均由山西医科大学迎泽校区实验动物中心提供〔生产许可证:SCXK(晋)2019-0004〕,其中有19只在AMI造模期间死亡〔1只于麻醉后死亡,18只于左冠状动脉前降支(LAD)结扎时死亡〕,有3只大鼠在造模结束后的48 h内死亡,最终纳入本实验的SD大鼠共56只,体质量(body weight,BW)为230~270 g,在可控动物房内分笼饲养(3只/笼),饲养条件为温度(23±2)℃、湿度(60±10)%和压差(25±2)Pa,自由饮食、水,标准12 h光照/12 h黑暗节律,6:00~18:00为光照条件。本研究通过山西医科大学伦理委员会批准〔【2019】伦审字(K-SK032)〕。
1.1.3 实验仪器设备 小动物跑步机〔Columbus Instruments(美国),型号:Exer3/6〕;超高分辨率小动物超声成像系统〔Visualsonics Inc(加拿大),型号:Vevo3100〕;小动物电生理机和呼吸机(安徽正华生物仪器设备有限公司,型号:DW-3000);正置白光拍照显微镜(日本Nikon公司,型号:EclipseCi-L)。
1.1.4 实验试剂 兔抗CD31多克隆抗体(武汉赛维尔生物科技有限公司,货号:GB13428);山羊抗兔IgG抗体(武汉赛维尔生物科技有限公司,GB23303);masson染色试剂盒(武汉赛维尔生物科技有限公司,货号:G1006);组化试剂盒DAB显色剂(武汉赛维尔生物科技有限公司,货号:G1211);肿瘤坏死因子α(TNF-α)试剂盒〔ThermoFisher Scientific(美国),货号:88-7324〕。
1.2 实验方法
1.2.1 AMI大鼠模型制备 结扎大鼠LAD造模,术前腹腔注射10%水合氯醛麻醉(350 mg/kg),进行心电监护后经颈行气管插管,使用小动物呼吸机辅助呼吸〔参数:呼吸频率70次/min,吸∶呼=1∶1,潮气量7.5 ml(1~5 ml/100 g)〕。完成气管插管后开胸暴露心脏,于左心耳下方2~4 mm结扎LAD,观察结扎远端心肌颜色变浅,心电图ST段抬高持续0.5 h,暂定为AMI造模成功,缝合关胸、关颈,术后1周用超声检查,再次判断造模是否成功,排除失败大鼠。
此外,另有部分大鼠术中插管、开胸处理,不对LAD进行结扎,之后缝合关胸、关颈,并在1周后进行超声检查。
1.2.2 实验大鼠分组 术后存活的大鼠适应性喂养1周,术中未进行结扎的大鼠随机选取14只纳入假手术组(Sham组);AMI模型鼠随机分为心梗静息组(MI-SED组,n=14)、心梗高强度间歇训练(HIIT)组(MI-HIIT组,n=14)和心梗中等强度持续训练组(MI-MICT组,n=14)。
1.2.3 运动训练方案 Sham组与MI-SED组不进行运动训练。MI-HIIT组和MI-MICT组大鼠术后1周开始在小动物跑步机上进行适应性跑步训练:速度15 m/min,合计30 min/d,持续5 d。2 d后开始正式训练,正式训练前先进行热身(速度5 m/min,持续3 min)。正式训练MI-HIIT组:高强度运动训练〔速度25 m/min,持续时间4 min/次,80%~90%最大摄氧量(VO2max),坡度为0°〕与中等强度运动训练(速度15 m/min,持续时间3 min/次,50%~60%VO2max,坡度为0°)交替进行,每天各7次,每周训练5 d。MI-MICT组:速度17 m/min,持续60 min/次,1次/d,(50%~70%)VO2max,坡度为0°,每周训练5 d[9];大鼠训练4周后每组随机取7只大鼠进行数据和标本采集,第8周结束时对其余7只大鼠进行数据和标本采集。
1.2.4 心脏彩色多普勒超声检查 运动训练前1 d与运动训练结束后次日进行超声数据采集,方法如下:4%七氟烷(流速0.5~1.0 L/min)与97%氧气麻醉大鼠后,将其固定在超声采集板上,大鼠鼻罩吸氧维持麻醉(1%~2%七氟烷与97%~99%氧气),完成胸腹部脱毛,用30 MHz探头采集长轴M模块的射血分数(EF)、缩短分数(FS)、左心室收缩末期内径(LVDs)、左心室舒张末期内径(LVDd)、左心室收缩末期后壁厚度(LVPWs)、左心室收缩末期前壁厚度(LVAWs),分别测3个心动周期取平均值(整个过程监测大鼠核心温度和心电图情况)。
1.2.5 大鼠心脏标本制备 首次运动训练开始前与末次运动训练结束后24~48 h对各组大鼠分别称重,记录体BW,首次运动前为初始BW,末次运动后为最终BW。超声数据采集完成后,摘取心脏,用预冷0.9%氯化钠溶液反复冲洗多余血液并置于纱布或吸水纸上控水,称重心脏质量(heart weight,HW)。计算心脏质量指数(HMI),HMI=HW/BW(使用最终BW值进行计算),并对HMI进行标准化处理:标准化HMI=HMI/Sham组训练4周后HMI均值。每组大鼠取部分左心室组织于4%多聚甲醛,常规石蜡包埋固定,用于HE、Masson染色、免疫组化分析,剩余大鼠心脏-80 ℃冰箱保存待用。
1.2.6 HE染色 石蜡脱水切片后固定在载玻片上,光学显微镜在200×倍镜下使用HE染色鉴定切片,然后在不同倍数下观察组织切片情况,用分析软件Media Cybemetics,Image-Pro Plus 6.0分析切片中的基本病理变化。
1.2.7 Masson染色 石蜡切片脱蜡后用水冲洗,使用Masson三色法染色试剂盒按照说明对标本进行染色后,切片脱水澄清,封片固定,拍照后使用分析软件Media Cybemetics、Image Pro Plus 6.0对图像进行分析,以蓝色胶原纤维占比代表梗死面积〔胶原纤维面积占比(%)=胶原像素面积/视野像素面积×100%〕。
1.2.8 免疫组化分析 石蜡切片防脱片处理后,用二甲苯与梯度乙醇处理后,进行抗原修复,消除内源性过氧化物酶活性后封闭,之后与兔抗CD31多克隆抗体孵育,清洗后再与山羊抗兔IgG抗体孵育,显色复染后,阳性显示棕黄色。最后使用显微镜于400×倍镜下每张片随机选取5~7个目的区域成像,使用分析软件Media Cybemetics、Image-Pro Plus 6.0对图像进行分析,计算视野面积(S)并计数其微血管数量(MVD),血管新生以MVD/S表示(个/m2)。
1.2.9 TNF-α水平检测 于第4周、第8周末次训练结束后,取大鼠全血标本于室温放置2 h内离心(4 ℃,3 000 r/min,15 min,离心半径8.5 cm),取上清液按照TNF-α试剂盒步骤进行检测,根据标准品浓度和OD值做标准曲线再计算样本浓度。
1.3 统计学处理 数据采用SPSS 25.0、GraphPAD Prism9 统计软件进行统计分析,符合正态分布的计量资料以(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 四组大鼠训练4周和8周BW、HW与标准化HMI比较 四组大鼠初始BW比较,差异无统计学意义(P>0.05)。
训练4周后四组大鼠最终BW、HW比较,差异无统计学意义(P>0.05);四组大鼠标准化HMI比较,差异有统计学意义(P<0.05);MI-HIIT组标准化HMI高于Sham组、MI-SED组和MI-MICT组,MI-SED组标准化HMI高于Sham组,差异有统计学意义(P<0.05),见表1。
表1 四组大鼠训练4周后BW、HW与标准化HMI比较(±s)Table 1 Comparison of body weight,heart weight and standardized cardiac mass index of four groups of rats at the end of 4 weeks of intervention
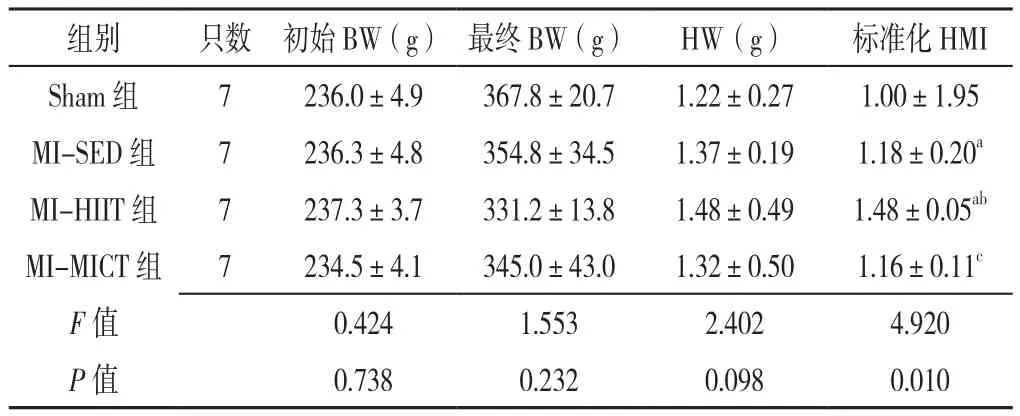
表1 四组大鼠训练4周后BW、HW与标准化HMI比较(±s)Table 1 Comparison of body weight,heart weight and standardized cardiac mass index of four groups of rats at the end of 4 weeks of intervention
注:BW=体质量,HW=心脏质量,HMI=心脏质量指数,Sham组=假手术组,MI-SED组=心梗静息组,MI-HIIT组=心梗高强度间歇训练组,MI-MICT组=心梗中等强度持续训练组;a表示与Sham组比较P<0.05,b表示与MI-SED组比较P<0.05,c表示与MI-HIIT组比较 P<0.05
组别 只数 初始BW(g) 最终BW(g) HW(g) 标准化HMI Sham 组 7 236.0±4.9 367.8±20.7 1.22±0.27 1.00±1.95 MI-SED组 7 236.3±4.8 354.8±34.5 1.37±0.19 1.18±0.20a MI-HIIT 组 7 237.3±3.7 331.2±13.8 1.48±0.49 1.48±0.05ab MI-MICT 组 7 234.5±4.1 345.0±43.0 1.32±0.50 1.16±0.11c F值 0.424 1.553 2.402 4.920 P值 0.738 0.232 0.098 0.010
训练8周后,四组最终BW、HW、标准化HMI比较,差异有统计学意义(P<0.05)。MI-HIIT组、MIMICT组BW低于Sham组和MI-SED组,差异有统计学意义(P<0.05);MI-HIIT组HW高于Sham组、MISED组和MI-MICT组,MI-MICT组HW高于MI-SED组,差异有统计学意义(P<0.05);MI-SED组、MIHIIT组和MI-MICT组标准化HMI高于Sham组,MIHIIT组标准化HMI高于MI-MICT组,差异有统计学意义(P<0.05),见表2。
表2 四组大鼠训练8周后BW、HW与标准化HMI比较(±s)Table 2 Comparison of body weight,heart weight and standardized cardiac mass index of four groups of rats at the end of 8 weeks of intervention
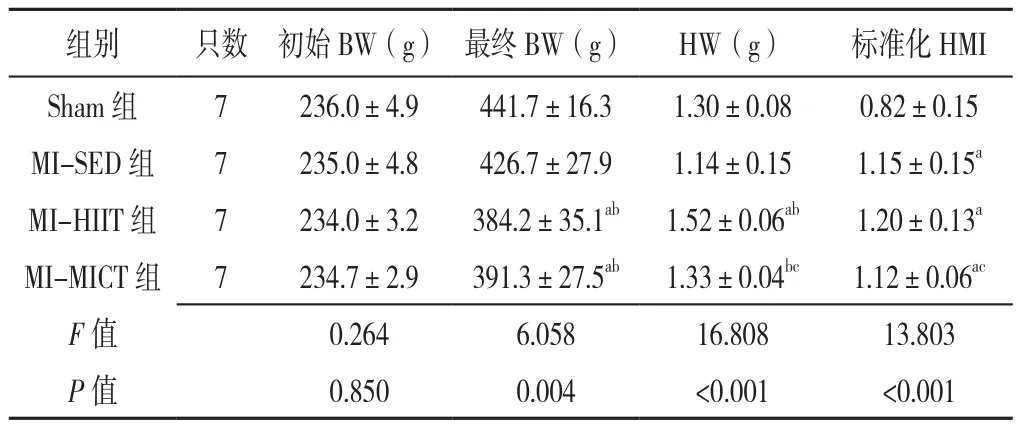
表2 四组大鼠训练8周后BW、HW与标准化HMI比较(±s)Table 2 Comparison of body weight,heart weight and standardized cardiac mass index of four groups of rats at the end of 8 weeks of intervention
注:a表示与Sham组比较P<0.05,b表示与MI-SED组比较P<0.05,c表示与MI-HIIT组比较P<0.05
组别 只数 初始BW(g) 最终BW(g) HW(g) 标准化HMI Sham 组 7 236.0±4.9 441.7±16.3 1.30±0.08 0.82±0.15 MI-SED组 7 235.0±4.8 426.7±27.9 1.14±0.15 1.15±0.15a MI-HIIT 组 7 234.0±3.2 384.2±35.1ab 1.52±0.06ab 1.20±0.13a MI-MICT 组 7 234.7±2.9 391.3±27.5ab 1.33±0.04bc 1.12±0.06ac F值 0.264 6.058 16.808 13.803 P 值 0.850 0.004 <0.001 <0.001
2.2 四组大鼠训练4周和8周心脏超声结果比较 四组大鼠训练4周后,EF、FS、LVDs、LVDd和LVAWs比较,差有统计学意义(P<0.05);四组LVPWs比较,差异无统计学意义(P>0.05)。MI-SED组、MI-HIIT组及MI-MICT组EF、FS、LVAWs低于Sham组,MI-HIIT组、MI-MICT组 EF、FS、LVAWs高 于 MI-SED组,差异有统计学意义(P<0.05);MI-SED组、MIHIIT组及MI-MICT组LVDs高于Sham组,MI-HIIT组、MI-MICT组LVDs低于MI-SED组,差异有统计学意义(P<0.05);MI-SED组、MI-HIIT组LVDd高于Sham组,MI-MICT组LVDd低于MI-SED组,差异有统计学意义(P<0.05),见表 3。
表3 四组大鼠第4周心脏超声结果比较(±s)Table 3 Comparison of cardiac ultrasound results in four groups of rats at the end of 4 weeks of intervention
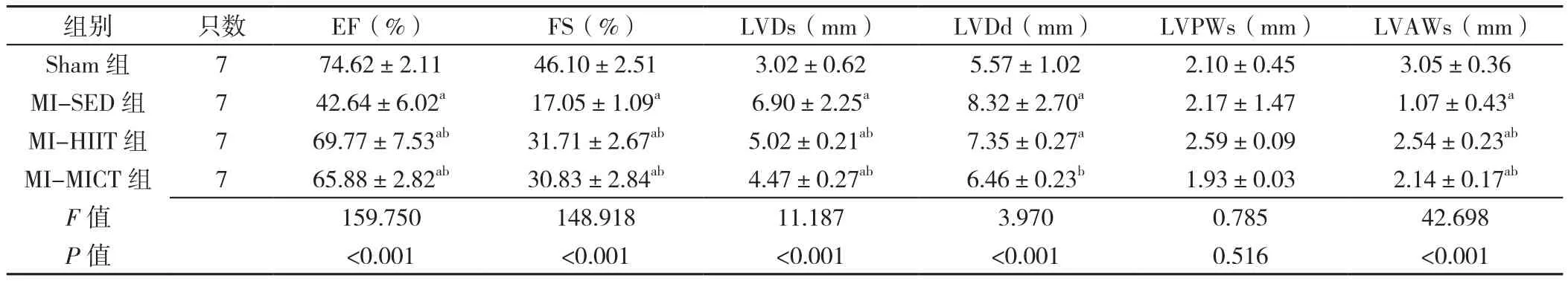
表3 四组大鼠第4周心脏超声结果比较(±s)Table 3 Comparison of cardiac ultrasound results in four groups of rats at the end of 4 weeks of intervention
注:EF=射血分数,FS=缩短分数,LVDs=左心室收缩末期内径,LVDd=左心室舒张末期内径,LVPWs=左心室收缩末期后壁厚度,LVAWs=左心室收缩末期前壁厚度;a表示与Sham组比较P<0.05,b表示与MI-SED组比较P<0.05;c表示与MI-HIIT组比较P<0.05
组别 只数 EF(%) FS(%) LVDs(mm) LVDd(mm) LVPWs(mm) LVAWs(mm)Sham 组 7 74.62±2.11 46.10±2.51 3.02±0.62 5.57±1.02 2.10±0.45 3.05±0.36 MI-SED 组 7 42.64±6.02a 17.05±1.09a 6.90±2.25a 8.32±2.70a 2.17±1.47 1.07±0.43a MI-HIIT 组 7 69.77±7.53ab 31.71±2.67ab 5.02±0.21ab 7.35±0.27a 2.59±0.09 2.54±0.23ab MI-MICT 组 7 65.88±2.82ab 30.83±2.84ab 4.47±0.27ab 6.46±0.23b 1.93±0.03 2.14±0.17ab F值 159.750 148.918 11.187 3.970 0.785 42.698 P值 <0.001 <0.001 <0.001 <0.001 0.516 <0.001
训练8周后,四组EF、FS、LVDs、LVDd、LVPWs和LVAWs比较,差异均有统计学意义(P<0.05)。MI-SED组、MI-MICT组EF低 于Sham组,MI-HIIT组EF高于Sham组和MI-SED组,差异有统计学意义(P<0.05);MI-SED组、MI-HIIT组及MI-MICT组FS低于Sham组,MI-HIIT组、MI-MICT组FS高于MISED组,差异有统计学意义(P<0.05);MI-HIIT组、MI-MICT组LVDs高于Sham组和MI-SED组,差异有统计学意义(P<0.05);MI-SED组LVDd低于Sham组,MI-HIIT组LVDd高于Sham组,MI-HIIT组、MI-MICT组LVDd高于MI-SED组,差异有统计学意义(P<0.05);MI-SED组 LVPWs低 于 Sham组,MI-HIIT组、MIMICT组LVPWs高于MI-SED组,MI-MICT组LVPWs低于MI-HIIT组,差异有统计学意义(P<0.05);MIHIIT组LVAWs高于Sham组、MI-SED组及MI-MICT组,差异有统计学意义(P<0.05),见表4。
表4 四组大鼠第8周心脏超声结果比较(±s)Table 4 Comparison of cardiac ultrasound results in four groups of rats at the end of 8 weeks of intervention
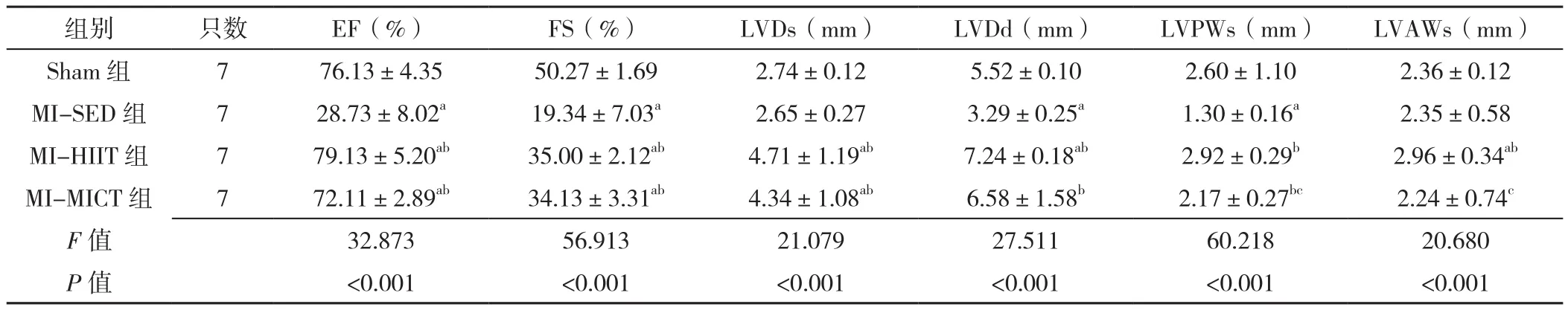
表4 四组大鼠第8周心脏超声结果比较(±s)Table 4 Comparison of cardiac ultrasound results in four groups of rats at the end of 8 weeks of intervention
注:a表示与Sham组比较P<0.05,b表示与MI-SED组比较P<0.05,c表示与MI-HIIT组比较P<0.05
组别 只数 EF(%) FS(%) LVDs(mm) LVDd(mm) LVPWs(mm) LVAWs(mm)Sham 组 7 76.13±4.35 50.27±1.69 2.74±0.12 5.52±0.10 2.60±1.10 2.36±0.12 MI-SED 组 7 28.73±8.02a 19.34±7.03a 2.65±0.27 3.29±0.25a 1.30±0.16a 2.35±0.58 MI-HIIT 组 7 79.13±5.20ab 35.00±2.12ab 4.71±1.19ab 7.24±0.18ab 2.92±0.29b 2.96±0.34ab MI-MICT 组 7 72.11±2.89ab 34.13±3.31ab 4.34±1.08ab 6.58±1.58b 2.17±0.27bc 2.24±0.74c F值 32.873 56.913 21.079 27.511 60.218 20.680 P 值 <0.001 <0.001 <0.001 <0.001 <0.001 <0.001
2.3 HE染色结果 训练第4周结束后,大鼠心脏组织HE染色显示Sham组心肌组织染色清晰,心肌细胞排列整齐,肌纤维走行方向一致,未见明显炎性反应、纤维化坏死等病理样改变;MI-SED组、MI-HIIT组、MI-MICT组大鼠出现不同程度心肌纤维灶性坏死溶解,成纤维细胞增生,毛细血管扩张,炎性细胞点状浸润,其中MI-SED组的心肌组织排列最为紊乱。训练8周后,大鼠心脏组织HE染色显示与4周时相比,炎性病变减轻,心肌细胞排列更紧密,见图1、2(彩图请扫描正文首页二维码)。

图1 训练4周后大鼠心脏组织HE染色结果Figure 1 H&E staining results of heart tissues in four groups of rats after 4 weeks of training
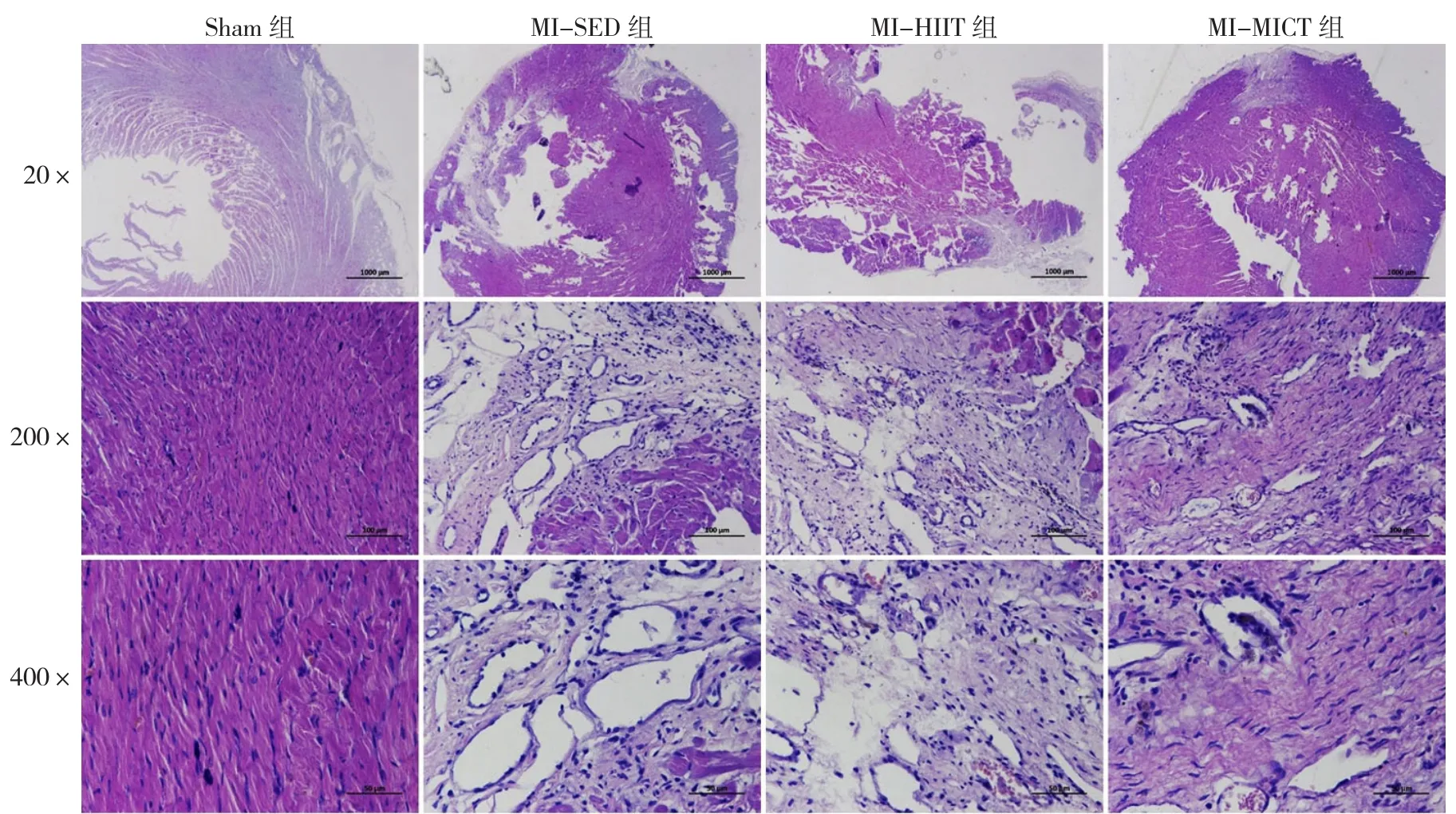
图2 训练8周后大鼠心脏组织HE染色结果Figure 2 H&E staining results of heart tissues in four groups of rats after 8 weeks of training
2.4 Masson染色结果 Sham组心肌细胞排列整齐,心肌组织胶原纤维染色清晰,分布正常;MI-SED组心肌细胞排列严重紊乱,心肌组织出现典型替代性纤维化且纤维化占比较高;MI-HIIT组、MI-MICT组心肌细胞排列与Sham组相比稍紊乱,但相较于MI-SED组整齐,且心肌组织纤维化占比也较低,见图3、4(彩图请扫描正文首页二维码)。
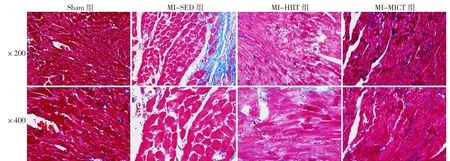
图4 训练8周后大鼠心脏组织Masson染色Figure 4 Masson's Trichrome staining results of heart tissues in four groups of rats after 8 weeks of training
训练4周后,四组心肌胶原纤维占比比较,差异有统计学意义(P<0.05),MI-SED组、MI-HIIT组、MI-MICT组心肌组织胶原纤维占比均高于Sham组,差异有统计学意义(P<0.05)。训练8周后,四组心肌胶原纤维占比比较,差异有统计学意义(P<0.05);MIHIIT组和MI-MICT组心肌胶原纤维占比低于MI-SED组,差异有统计学意义(P<0.05),见表5、6。
2.5 免疫组化结果 阳性反应呈现棕黄色颗粒沉淀以代表心肌组织血管新生数,训练4周后,四组血管新生数比较,差异有统计学意义(P<0.05);MI-SED组、MI-HIIT组、MI-MICT组心肌组织血管新生数均高于Sham组,差异有统计学意义(P<0.05);MI-HIIT组、MI-MICT组心肌组织血管新生数高于MI-SED组,差异有统计学意义(P<0.05)。训练8周后,四组血管新生数比较,差异有统计学意义(P<0.05);MI-SED组、MI-HIIT组、MI-MICT组心肌组织血管新生数均高于Sham组,差异有统计学意义(P<0.05);MI-HIIT组、MI-MICT组心肌组织血管新生数高于MI-SED组,差异有统计学意义(P<0.05);MI-HIIT组心肌组织血管新生数高于MI-MICT组,差异有统计学意义(P<0.05),见图5、6(彩图请扫描正文首页二维码),表5、6。
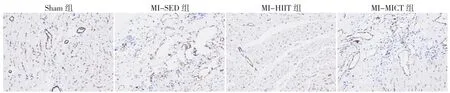
图5 训练4周后大鼠心脏组织免疫组化结果(×200)Figure 5 Immunohistochemical results of heart tissues in four groups of rats after 4 weeks of training
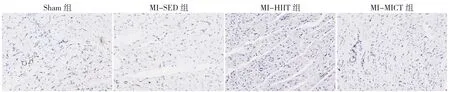
图6 训练8周后大鼠心脏组织免疫组化结果(×200)Figure 6 Immunohistochemical results of heart tissues in four groups of rats after 8 weeks of training
2.6 四组血清TNF-α水平比较 训练4周后,四组血清TNF-α水平比较,差异有统计学意义(P<0.05)。MI-SED组、MI-HIIT组及MI-MICT组血清TNF-α水平高于Sham组,MI-HIIT组血清TNF-α水平高于MISED组,差异有统计学意义(P<0.05)。训练8周后四组血清TNF-α水平比较,差异有统计学意义(P<0.05);MI-SED组、MI-HIIT组血清TNF-α水平高于Sham组,MI-HIIT组血清TNF-α水平高于MI-MICT组,差异有统计学意义(P<0.05),见表5、6。
表5 训练4周后各组心肌胶原纤维占比(Masson染色)、血管新生数(免疫组化CD31)及TNF-α比较(±s)Table 5 Comparison of the proportion of myocardial fibrillar collagen(Masson's Trichrome staining),angiogenesis( CD31immunohistochemistry staining)and serum TNF-α in four groups of rats at the end of 4 weeks of intervention

表5 训练4周后各组心肌胶原纤维占比(Masson染色)、血管新生数(免疫组化CD31)及TNF-α比较(±s)Table 5 Comparison of the proportion of myocardial fibrillar collagen(Masson's Trichrome staining),angiogenesis( CD31immunohistochemistry staining)and serum TNF-α in four groups of rats at the end of 4 weeks of intervention
注:a表示与Sham组比较P<0.05,b表示与MI-SED组比较P<0.05,c表示与MI-HIIT组比较P<0.05;TNF-α=肿瘤坏死因子α
TNF-α(pg/ml)Sham 组 7 0.7±0.3 229.2±52.1 8.2±2.0 MI-SED 组 7 3.5±1.1a 569.4±136.3a 20.4±5.6a MI-HIIT 组 7 2.3±0.9a 1 035.0±152.3ab 31.0±7.9ab MI-MICT 组 7 2.6±0.7a 883.0±398.8ab 25.7±8.1a F值 12.539 15.039 14.118 P值 <0.001 <0.001 <0.001组别 只数 胶原纤维占比(%)血管新生数(个 /mm2)
表6 训练8周后各组心肌胶原纤维占比(Masson染色)、血管新生数(免疫组化CD31)及TNF-α比较(±s)Table 6 Comparison of the proportion of myocardial fibrillar collagen(Masson's Trichrome staining),angiogenesis (CD31 immunohistochemistry staining)and serum TNF-α in four groups of rats at the end of 8 weeks of intervention
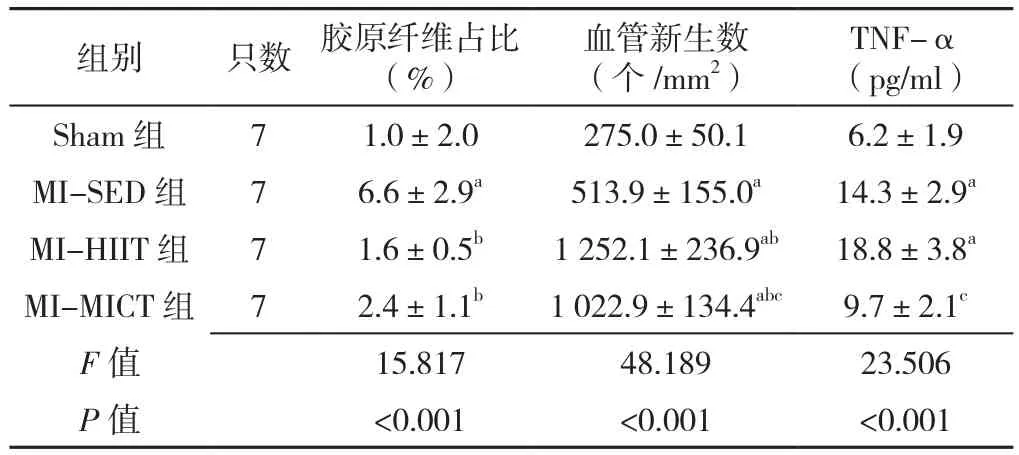
表6 训练8周后各组心肌胶原纤维占比(Masson染色)、血管新生数(免疫组化CD31)及TNF-α比较(±s)Table 6 Comparison of the proportion of myocardial fibrillar collagen(Masson's Trichrome staining),angiogenesis (CD31 immunohistochemistry staining)and serum TNF-α in four groups of rats at the end of 8 weeks of intervention
注:a表示与Sham组比较P<0.05,b表示与MI-SED组比较P<0.05,c表示与MI-HIIT组比较P<0.05
TNF-α(pg/ml)Sham 组 7 1.0±2.0 275.0±50.1 6.2±1.9 MI-SED 组 7 6.6±2.9a 513.9±155.0a 14.3±2.9a MI-HIIT 组 7 1.6±0.5b 1 252.1±236.9ab 18.8±3.8a MI-MICT 组 7 2.4±1.1b 1 022.9±134.4abc 9.7±2.1c F值 15.817 48.189 23.506 P值 <0.001 <0.001 <0.001组别 只数 胶原纤维占比(%)血管新生数(个 /mm2)
3 讨论
AMI发病率逐年增加,目前虽有药物、手术等多种临床治疗方式,但其致残率、致死率不容乐观。HIIT作为心脏康复的运动方案之一,对于改善心肌梗死患者的预后、提高患者的生活质量有重要作用[1-2,4]。
运动初期可显著降低BW,可能的原因是运动降低脂肪含量的同时也抑制了骨骼肌萎缩,并升高了腓肠肌等肌肉质量的缘故[10-14]。本实验示训练4周后两运动组大鼠BW均降低,而训练4~8周降低不明显,另外本实验与VUJIC 等[15]研究结果一致,均显示运动后HMI升高且MI-HIIT组更显著。
运动可改善心肌梗死后心功能,其原因可能是影响了心室内径和室壁厚度,从而保留了心室收缩功能,达到改善心功能的效果[16-17]。本实验超声结果与WANG等[16]研究结果大致吻合,均显示AMI大鼠在运动4、8周后EF、FS等心功能参数升高,随着运动周期的延长,心功能参数升高至与Sham组大致相当。另外与MISED组相比,本实验结果还显示两运动组的LVDd、LVAWs等得以维持,说明运动可能影响了心室结构从而保留了部分心功能。
炎性反应是AMI早期修复的关键步骤,在重构过程中发挥重要作用[5]。AMI发生后诱导炎性细胞产生 TNF-α等因子参与愈合过程[18],LEOR 等[19]研究也表明一定程度的炎性反应可加速该愈合过程。本实验结果显示训练4周后两运动组TNF-α水平均升高,且MI-HIIT组更高,而训练8周后该水平均降低。WANG等[16]研究则表明4或8周MI-HIIT组心肌组织保持更高水平的炎性细胞浸润。LEOR等[19]研究显示将活化的炎性细胞注射到AMI大鼠模型,其心功能明显改善,FS升高了约25%,并且梗死部位血管新生数有明显升高;SELVASANDRAN等[20]实验则表明用含TNF-α的干细胞处理AMI大鼠后,其FS升高了(16.79%±3.00%);SKYSCHALLY等[21]的研究表明了TNF-α的心脏保护作用,其结果显示TNF-α可使小型猪MI模型梗死面积减少约50%,且减少面积很大程度上取决于TNF-α的水平,在较低剂量下观察到其保护作用,进一步增加剂量或敲除TNF-α受体后会削弱这种保护作用[21-23]。SCHULZ等[18]表明AMI后梗死区TNF-α持续升高数周可能促进了心肌细胞凋亡,而梗死边界区升高1周后下降可能限制了梗死范围的扩大,SELVASANDRAN等[20]研究还显示TNF-α促进了梗死区域的血管新生与迁移效应,而WANG等[16]实验显示运动后梗死区TNF-α较低,非梗死区域则显示出较高水平。另外WANG等[16]、VUJIC等[15]实验也表明运动可诱导毛细血管新生,且该反应多发生在梗死边界,对此合理的解释是运动引起的TNF-α水平变化可能激活存活心肌细胞内的信号网络并触发心肌血管新生等系列反应[15,20,22],以缓解该区域因血管崩解、稀疏等导致的心肌梗死[2],从而达到改善心室重塑的效果。故猜想运动诱导的早期TNF-α升高可能有益于AMI修复愈合,结合以上结果说明TNF-α升高的时间和位置等均影响AMI的修复愈合过程[18-20,24],而运动尤其是HIIT可能影响TNF-α的水平、反应时间及位置等,在AMI后的修复愈合、改善心功能方面发挥特异性效应[19,22]。
运动可升高AMI发生后心肌组织的血管新生数,降低胶原纤维占比[9]。本实验显示训练4周后运动组心肌组织胶原纤维占比降低不显著,但已有新生血管形成,而训练8周后降低显著,且血管新生数目较前升高,HIIT组升高更显著,这与SONG等[9]的研究结果大致吻合,说明此时间段内运动促进心肌血管新生等反应没有终止。而SCHMITZ等[25]研究显示终止运动4周后发现血管新生相关因子有所降低,说明诱导血管新生可能需要持续的运动刺激。
综上所述,运动是减少AMI危险因素、提高患者运动能力和生活质量的有效干预方法,是在药物和手术治疗的基础上可靠有效的补充替代疗法。运动诱导AMI后早期炎性反应,可能参与心肌血管新生、心肌纤维化等多个病理生理过程,对逆转左心室重构、改善心功能有重要作用。目前多数临床心脏康复运动方案是在AMI患者数周、数月之后进行的,也有试验在发生AMI之后12 h进行,试验从低强度开始逐渐增加至中强度方案,且对血压、心率、心电图等进行监测,安全性有较高保证[26],而高强度方案对于早期AMI影响临床实验较少,理论上在保证安全的前提下是可以进行的,但具体实施方案需结合实际情况而定。
本研究局限性:本实验只检测了循环中TNF-α,未对心脏组织炎症指标进行检测,对于TNF-α水平、反应时间及位置等特异性效应还需验证,另外本研究只进行了心脏组织学检测,后续还应继续完善分子层面的检测。但在本研究中,AMI大鼠在跑步机上接受训练,与人类心脏康复计划高度相似,一方面可对于明确运动改善AMI预后提供一定依据,另一方面可为HIIT在临床开展早期试验提供一定理论支持。
作者贡献:贾思琦参与设计研究方案,进行分子实验以及后期数据收集整理、统计分析并撰写草稿;王迪参与设计研究方案,进行动物造模、运动训练干预、取材及切片染色、数据收集整理;鲁燕负责文章的质量控制与审校;贾永平提出研究思路,对文章整体负责、监督管理。
本文无利益冲突。
