基于电石渣—三乙烯四胺的多孔凝胶矿化固碳研究
2022-09-26吴明跃吕茂云李金亮梁运涛王昌祥
陆 伟,吴明跃,吕茂云,李金亮,梁运涛,张 茜,,王昌祥,路 瑶
(1.安徽理工大学 安全科学与工程学院,安徽 淮南 232001;2.山东科技大学 安全与环境工程学院,山东 青岛 266590;3.内蒙古黄陶勒盖煤炭有限责任公司巴彦高勒煤矿,内蒙古 鄂尔多斯 017300;4.中煤科工集团沈阳研究院有限公司 煤矿安全技术国家重点实验室,辽宁 抚顺 113122;5.煤炭科学研究总院,北京 100013)
造成煤炭自燃的主要原因之一是煤体具有良好的供氧条件,因此,阻断供氧或者降低氧浓度是防治煤自燃的关键[1-3]。目前,在井下灌注CO2进行防灭火具有较好的效果,但是CO2在井下采空区内易发生逸散,且逸出的CO2随风流进入大气中[4-6],增加向大气中排放CO2量,不符合国家提出的“碳达峰、碳中和”的要求。如果将CO2长时间封存于采空区内,则可以达到长期防治煤自燃的目的[7]。
将CO2矿化封存是实现CO2长时间封存于采空区内的有效方法之一,即利用碱性物质吸收CO2,并矿化生成多孔网状结构物质,从而达到固定CO2、防治煤炭自燃的目的[8]。目前,常用的碱性物质主要是含有Ca2+和Mg2+的物质,而在工业生产过程中(主要是燃煤发电和炼钢等重工业领域)会产生大量的粉煤灰、钢渣及电石渣等[9],这些固体废弃物(简称为“固废”)通常含有大量的Ca、Mg元素。如果将固废和CO2输送至采空区,并在采空区内利用固废中Ca2+、Mg2+对CO2进行封存、利用将是一种非常好的负碳排放技术,同时还可以防治采空区灾害的发生[10]。
然而,对于含有碱性物质的固废而言,在常温常压下与CO2的碳酸化反应速率缓慢且单位质量矿物的封存能力小[11]。因此,提高固废矿化反应速率和封存量成为发展煤矿采空区CO2矿化封存技术的关键。基于以上研究背景,提出利用醇胺溶液作为化学吸收剂吸收转化CO2,并采用钙化合物矿化固定CO2,然后将醇胺溶液和电石渣复配发泡,制备成一种新型的多孔凝胶。采用单因素试验研究了TETA-H2O和TETA-CaO-H2O体系在不同温度下对CO2的吸附能力,确定了TETA在混合溶液中的质量分数;然后,根据各组分最佳配比制备多孔凝胶,并研究其矿化固定CO2的能力;最后,通过分子模拟软件和扫描电镜研究了多孔凝胶吸附CO2机制。本研究不仅符合《2030年前碳达峰行动方案》中提高大宗固废高值化利用和碳减排的要求,而且对防治煤自燃材料和技术的发展提供了一定的理论研究基础,具有一定的社会、环境和经济效益。
1 试验材料和方法
1.1 试验材料
试验材料包括CaO(试剂级)、TETA溶液(质量分数大于等于98%)、胶凝剂(多糖类高分子材料)、醇胺溶液(在试验前均未经过提纯处理)、CO2(体积分数大于等于99%)。采用X射线荧光光谱分析仪对煅烧后的电石渣进行定量分析,电石渣成分见表1。
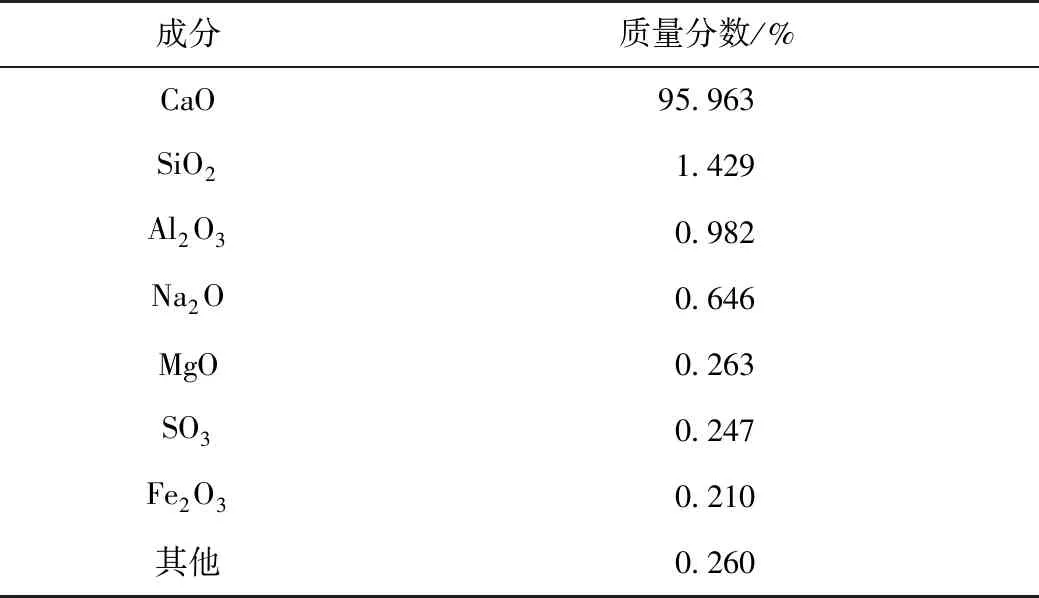
表1 电石渣成分及其质量分数
1.2 TETA溶液吸收—矿化CO2试验方法
矿化试验在实验室的高温高压反应釜中进行,测试装置包括CO2供应通道、反应器单元、加热单元、搅拌单元、监测和记录单元,如图1所示。
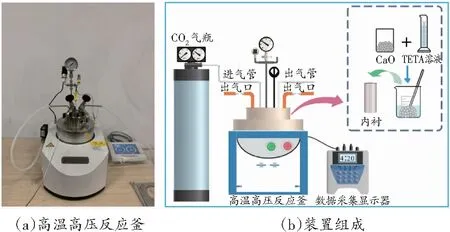
图1 碳酸化测试装置示意图
利用反应釜内压力随时间的变化研究4个反应参数(TETA溶液质量分数、CaO质量分数、反应时间和CO2压力)对CO2吸收—矿化的影响。根据理想气体定律,当气体的温度和体积不变时,气体的压力与气体分子数量成正比。因此,CO2压力的降低可以理解为封闭反应釜内CO2分子的减少。
通过单因素试验研究不同温度及不同TETA溶液质量分数对体系CO2压力变化的影响规律,具体方法如下:①将醇胺添加到蒸馏水中,获得一定质量分数的醇胺溶液,称取一定质量的CaO并将其添加到上述醇胺溶液中;②将混合物放入反应釜内并加热至一定温度,随后将一定压力的CO2充入反应釜中,并保证CO2的初始压力为0.7 MPa;③以(300±5) r/min的搅拌速度使CaO与TETA溶液混合均匀;④每组试验进行30 min,记录反应釜内CO2压力随时间的变化规律;⑤在测试结束时,使用真空过滤泵将醇胺溶液混合物中的固体成分滤出;⑥将回收的固体成分在真空烘箱中以90 °C干燥24 h,以除去固体样品中残留的水分。每次取TETA溶液5 mL,分别与5 mL质量分数为1%的CaO悬浊液混合,再将上述混合液稀释到100 mL后进行测试。同时,为了消除误差,避免试验的偶然性,还分析了TETA溶液对CO2吸收规律的影响。
1.3 多孔凝胶的制备
首先,在烧杯中依次加入胶凝剂、电石渣、TETA溶液、发泡剂和交联剂并混合均匀,在开启机械搅拌的同时通入一定流量和体积分数的CO2,待多孔凝胶发泡交联稳定后,停止通入气体和搅拌。多孔凝胶制备过程如图2所示。
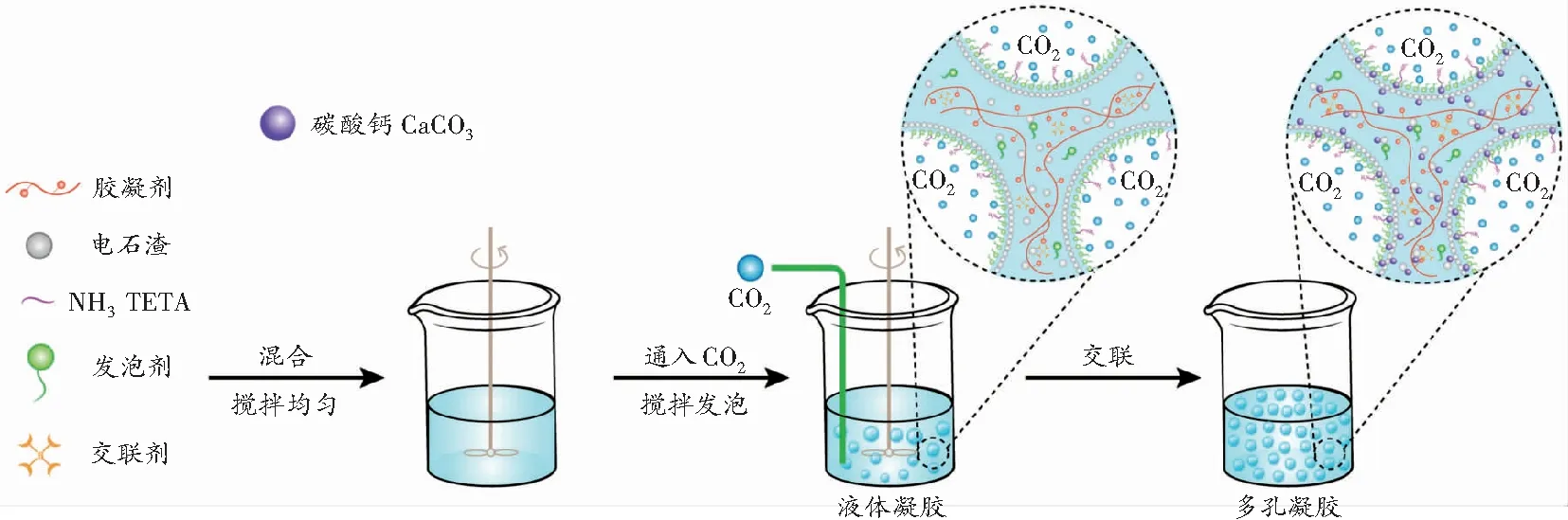
图2 多孔凝胶制备流程示意图
2 TETA-H2O和TETA-CaO-H2O体系对CO2吸附的影响规律
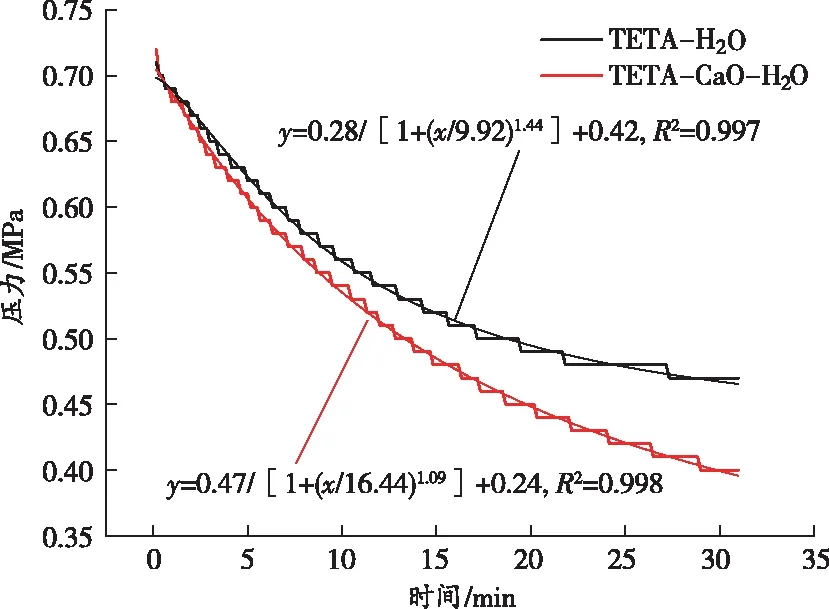
在不同温度下,反应釜内TETA吸收CO2后其压力与时间的关系如图3所示。其中横坐标为反应时间,纵坐标为反应釜中CO2的压力,曲线斜率表示CO2压力的降低速率。
(a)288 K
图3每个分图中的2条曲线分别表示2种不同的吸收剂,即TETA-H2O二元和TETA-CaO-H2O三元体系。为了更加清晰地表述曲线走势,对反应时间内的数据进行拟合,发现TETA-H2O二元体系和TETA-CaO-H2O三元体系对CO2的吸附过程符合具有时间常数参数的两相指数衰减函数模型(y=ae(-x/m)+be(-x/n)+c),并且拟合度均在99%以上,具体函数关系如表2所示。

表2 TETA-H2O二元体系和TETA-CaO-H2O三元体系对CO2的吸附过程函数关系式
随着温度的升高,体系的压降呈现出逐渐增大的趋势(最大压降为0.32 MPa),这说明升高温度对体系吸收CO2有一定的促进作用。在向溶液中添加CaO后,不同温度下体系的压降分别为0.30 MPa(288 K)、0.32 MPa(293 K)、0.33 MPa(298 K)、0.34 MPa(303 K)、0.34 MPa(308 K),这说明添加CaO能够使反应釜内的CO2压降进一步增大。
在低温下体系因需要克服生长动力学能垒,导致体系反应速率较慢。当温度升高时,分子动能增大,体系碳酸化过程能够消耗更多的CO2,并且Ca(OH)2与CO2反应后放热,释放的热量有可能被再利用,从而不需要额外的能量输入。因此,在TETA溶液中添加含有金属离子(Ca2+)的碱性溶液能够进一步增大反应釜内CO2的压力差。从图3中也可以看出,TETA质量分数对体系内CO2的压降产生了一定的影响,即随着TETA质量分数的增大,体系的压降呈现出先增高后降低的趋势。这主要是因为当体系中TETA的质量分数增大时,CO2与TETA反应的速率会增大,气液界面与液相主体间的传质推动力增强,此时更多的CO2被转移至体系中,CO2的压降迅速增大;而继续增大TETA的质量分数会使体系的黏度增大,这增大了气液传质阻力,从而降低了CO2的压降值。因此,在进行后续试验时选择TETA的质量分数为2.5%~7.5%。
当CaO和TETA质量分数不变时,CO2初始压力对体系吸收CO2的影响规律见图4。
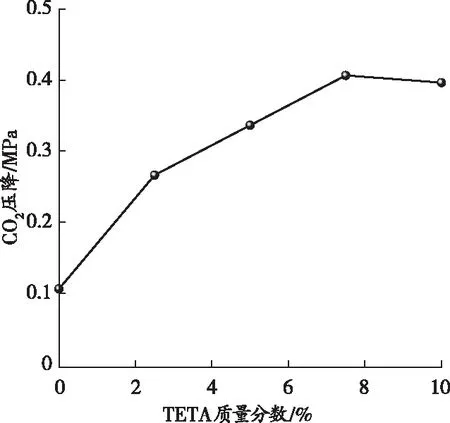
(a)不同TETA质量分数时CO2压降的变化
3 多孔凝胶对CO2矿化效率的影响
在CO2初始压力相同、温度不同的条件下,利用高温高压反应釜研究多孔凝胶对CO2矿化效率的影响规律,测试反应时间为1 h。同时,设置相同的对照试验,只在反应釜内加入100 mL的蒸馏水,并保持测试条件与多孔凝胶碳酸化条件一致。不同温度下反应釜内压力随时间的变化情况如图5所示。
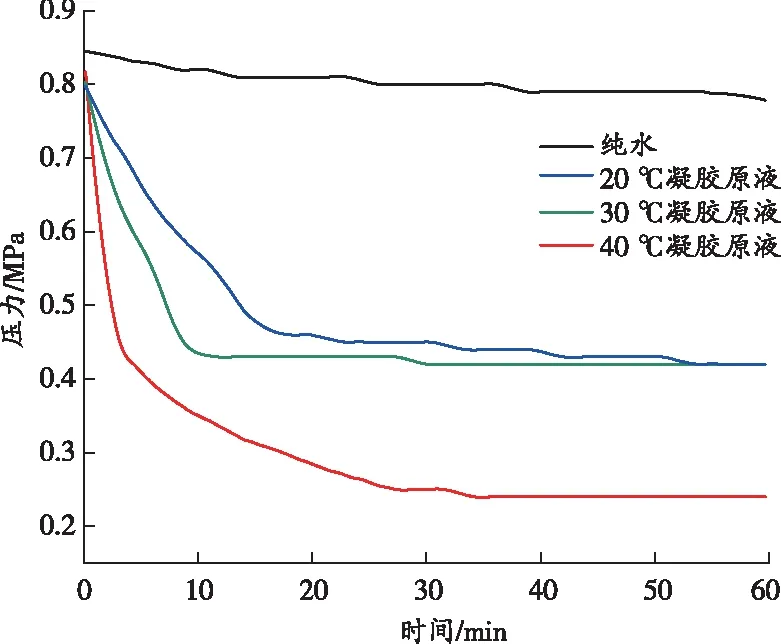
(a)压力随时间的变化曲线
图5(a)显示了在不同温度(20、30、40 ℃)和CO2初始压力下,反应釜内压力随时间的变化趋势。从图5(a)可以看出,在4次测试过程中,反应釜内的CO2压力均随着时间的推移而逐渐降低至平稳状态;反应温度越高,体系最终的CO2平衡压力就越低。凝胶原液中含有与CO2反应的胺源(来自于TETA分子、明胶)及钙源(来自于电石渣中的CaO)。因此,CO2的总压降是水、TETA分子、明胶及电石渣共同吸附的结果。随着反应温度的升高,体系最终的CO2平衡压力降低,这主要是因为在低温下体系需要克服生长动力学能垒,体系反应速率较慢。温度升高,分子动能增大,体系碳酸化过程能够消耗更多的CO2。
为研究温度对材料碳酸化效率的影响,在温度为20、30、40 ℃的条件下进行一系列碳酸化试验。利用式(1)计算得到每次测试的压降曲线,如图5(b)所示。
Δp碳酸化=Δp总-Δp水
(1)
式中:Δp碳酸化表示因胺源和钙源碳酸化引起的压降,MPa;Δp总表示整个体系引起的压降,MPa;Δp水表示纯水引起的压降,MPa。
图5(b)表示在不同温度下反应釜内CO2压降随着时间推移的变化规律,可以看出,随着碳酸化过程消耗CO2,反应釜内压降随时间增加不断增大。几十分钟后,当所有可用的胺源和钙源消耗完时便不再进行反应,此时压降值达到一个常数。在上述各曲线中,梯度表示碳酸化过程中的压降速率,即CO2分子向胺源和钙源方向转移的速率。LIU M等[12]研究了以CaO和硅酸钙CaSiO4为钙源、以乙醇胺为胺源体系的碳酸化过程,发现矿化率随着温度的升高呈现出先增高后降低的趋势,在50 ℃时表现出优异的矿化效果。本研究在低温下得出的规律与LIU M等[12]的研究结果相同,但随着温度的升高,体系的压降值逐渐增大,如图5(c)所示。根据亨利定律,当压力一定时,在低温下溶解到溶液中的气体分子数量与温度成正比。另外,当温度升高时,气体和反应物分子之间的碰撞次数增多,碳酸化反应速率增大,导致压降增大。
为了定量评价温度对体系碳酸化的影响,使用理想状态方程将压降值(Δp)转化为CO2的摩尔分数(n)。该方程能够评估不同温度下碱液(多孔凝胶原液具有碱性)在封闭系统中碳酸化的潜力。其计算公式如下:
(2)
式中:Δp为碳酸化的压降,MPa;V为CO2在反应釜内的体积,L;R为气体常数,8.314×10-4J/(mol·K);T为热力学温度,K。
图6显示了在3种试验温度(20、30、40 ℃)下多孔凝胶对CO2封存量(CO2分子数)的变化情况。
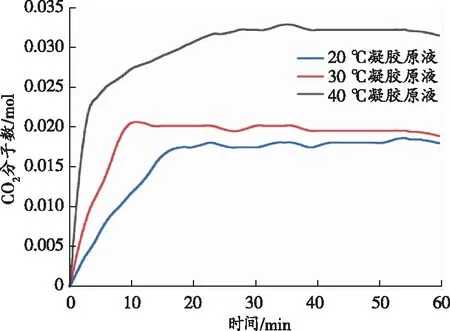
(a)CO2分子数随时间的变化情况
从图6(a)中可以看出:随着时间的延长,体系中CO2分子数先迅速增加至一定值后保持平稳不变;在反应时间相同时,温度越高体系中CO2分子数越多。从图6(b)中可以得出,在不同温度下体系达到初始平衡的时间分别为13.76 min(293 K)、7.07 min(303 K)、3.12 min(313 K)。由于CO2的相对分子质量为44.01,由此可以计算出体系中单位质量的多孔凝胶在不同温度下的固碳质量分别为0.070 g(20 ℃)、0.077 g(30 ℃)、0.110 g(40 ℃)。
CO2分子数会随着温度的升高而呈现增加的趋势,这主要是因为在温度相对较高时CO2的初始转移速度更快,促使体系的碳酸化反应更快完成。但是,实际的吸附容量可能与理论上不同,这是由于物理化学吸附(胺源与CO2之间的反应)、矿物溶解、矿物沉淀,以及CO2溶解的速率常数和热力学平衡常数均与温度有关,均能影响到碳酸化的反应速率。虽然升高温度有利于CaO中Ca2+的溶出(增大Ca2+的扩散速率),以及促进胺源与CO2之间的反应(降低反应所需活化能),但是气态CO2在水中的溶解速度随着温度的升高而降低,这个因素会在一定程度上阻碍升高温度时胺源和钙源对CO2的吸收[13-16]。
根据以上分析可以得出,温度对碳酸化效率的影响主要体现在以下3个方面:Ca2+的溶出;胺源与CO2的反应速率;CO2在水中的溶解。如果能平衡上述三者之间的关系,碳酸化反应速率将会得到进一步提高。
4 多孔凝胶矿化产物特征及吸附CO2机制
4.1 碳酸化后多孔凝胶矿化产物特征
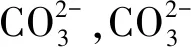

图7 多孔凝胶样品碳酸化后产物的SEM图
从图7(b)和(c)可以看出,碳酸化后的多孔凝胶中含有片状的Ca(OH)2和六面体形的方解石型CaCO3。图7(d)中的EDS分析表明,碳酸化后的沉淀物中的组成元素主要为Ca、C和O,原子质量比约为1∶1∶3,符合CaCO3的元素组成及比例。
4.2 多孔凝胶吸附CO2机制
利用密度泛函理论,研究了TETA与CO2反应后的自然键轨道原子电荷(NBO)的变化。经Dmol3几何优化后,TETA分子中的N原子带有负电荷,而CO2分子中的C原子带有部分正电荷,TETA与CO2分子之间靠静电相互作用吸引。在含有TETA的水溶液中通入一定量的CO2气体后,溶液的pH值降低,这说明TETA与CO2反应生成了两性离子产物(氨基甲酸)[20-23]。
计算了在TETA-CO2体系中反应前后的N、O、H自然键轨道原子电荷(NBO),如图8所示。
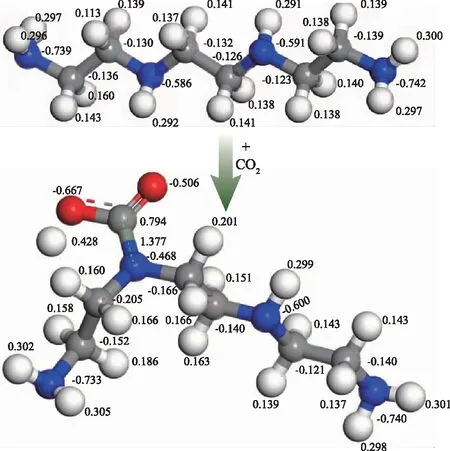
注:红色小球是氧原子、蓝色小球是氮原子、灰色小球是碳原子、白色小球是氢原子。
图8 TETA与CO2的相互作用示意图
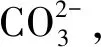
5 结论
1)单因素试验表明,添加CaO及升高温度均能提高反应釜内CO2的压降,延长反应时间能够使反应釜内的物质混合更均匀,最终确定了TETA的质量分数为2.5%~7.5%,CO2初始压力为0.4~0.8 MPa,反应时间为30~60 min。在低温下体系需要克服生长动力学能垒,导致体系反应速率较慢。当温度升高时,分子动能增大,体系碳酸化过程能够消耗更多的CO2,并且CaO浊液与CO2反应后放热,释放的热量有可能被再利用,从而不需要额外的能量输入。
2)单位质量的多孔凝胶在不同温度下固定CO2的潜力分别为0.070 g(20 ℃)、0.077 g(30 ℃)和0.110 g(40 ℃)。碳酸化后的多孔凝胶中含有片状的Ca(OH)2和六面体形的方解石型CaCO3。
3)与TETA分子电荷相比,TETA-CO2络合物中氮原子的NBO负电荷显著减少,更多来自氮原子的负电荷集中在羧酸根中的氧原子上,分子链中其余3个胺基上的N原子电荷数没有发生变化,即TETA-COOH可以继续吸引CO2分子。
