汉黄芩苷抗糖尿病大鼠肾损伤及纤维化的机制研究
2022-09-25柯亚琼郝建波芦玲陈淅泠付艳芹
柯亚琼,郝建波,芦玲,陈淅泠,付艳芹
(1.郑州大学第二附属医院老年医学科二病区,河南郑州 450000;2.郑州大学第二附属医院内分泌科,河南郑州 450000)
糖尿病肾病(diabetic kidney disease)作为糖尿病的一种微血管并发症,是终末期肾衰竭的主要原因,早期预防糖尿病肾脏损伤十分重要[1-3]。转化生长因子β1(TGF-β1)是一种已知的促纤维化细胞因子。研究表明,临床糖尿病肾病患者血清TGF-β1水平异常增高与蛋白尿程度密切相关[4]。TGF-β1/丝裂原活化蛋白激酶p38(p38MAPK)信号通路激活可诱导急性肾损伤和肾纤维化,抑制该通路被认为是减轻肾脏损伤的途径之一[5]。汉黄芩苷(wogonoside)为类黄酮单体,是中药黄芩(为唇形科黄芩Scutellaria baicalensis Georgi的根)的主要成分之一[6],具有抗炎[7]、抗肿瘤[8]、抗氧化[9]等药理活性。既往有研究表明,汉黄芩苷可减轻糖尿病肾病肾组织炎症[10],提示汉黄芩苷对糖尿病并发肾组织损伤有治疗作用。本研究拟建立糖尿病大鼠模型,进一步探讨汉黄芩苷是否可通过抑制TGF-β1/p38MAPK信号通路发挥抗糖尿病大鼠肾损伤及纤维化的作用。又因细胞周期素依赖性蛋白激酶5(CDK5)与胰岛β细胞损伤和胰岛素分泌不足有关,Roscovitine作为CDK5的抑制剂,已被证实可通过抑制TGF-β1/p38MAPK途径发挥抗糖尿病小鼠肾纤维化的作用[11],故以Roscovitine治疗为阳性对照。现将研究结果报道如下。
1 材料与方法
1.1 实验动物清洁级8周龄雄性SD大鼠50只,体质量为(180±20)g,由济南朋悦实验动物繁育有限公司提供,动物生产许可证号:SCXK(鲁)2019-0003。本研究方案已经郑州大学第二附属医院伦理委员会审核通过(批号:ZZDXDEFSYY2019009)。研究过程遵循实验动物人道主义及3R原则。饲养环境:24℃恒温普通饲养,12 h/12 h光暗交替。
1.2 药物、试剂与仪器汉黄芩苷(分子量:460.388;分子式:C22H20O11),纯度≥98%,上海吉至生化科技有限公司生产,批号:51059-44-0。链脲佐菌素(streptozotocin,STZ)、CDK5抑制剂Roscovitine(美国Sigma公司);尿白蛋白(albumin,Alb)酶联免疫吸附分析(ELISA)试剂盒(上海江莱生物技术有限公司);α平滑肌肌动蛋白(αsmooth muscle actin,α-SMA)、TGF-β1、Ⅳ型胶原蛋白(collagenⅣ,ColⅣ)、p38MAPK、GAPDH等抗体(美国Abcam公司);磷酸化p38丝裂原活化蛋白酶(p-p38MAPK)抗体(美国CST公司);辣根过氧化物酶标记山羊抗兔IgG二抗(武汉艾美捷生物科技有限公司);苏木素-伊红(HE)染色试剂盒、马松(Masson)三色染色试剂、ECL Plus超敏发光液试剂盒(北京索莱宝生物科技有限公司);全蛋白提取试剂盒(江苏凯基生物技术股份有限公司)。iBright成像系统[赛默飞世尔科技(中国)有限公司];全自动生化分析仪(瑞士巴塞尔罗氏诊断公司);多功能酶标仪(美国赛默飞世尔科技有限公司)。
1.3 造模、分组与给药将50只大鼠适应性喂养1周后,根据随机数字表取10只作为正常组常规饲养,剩余40只给予高脂饲料喂养6周后用于构建2型糖尿病模型。方法[12]:造模前禁食12 h,STZ溶于0.1 mol/L枸橼酸缓冲液(pH 4.0)中,每天腹腔单次注射30 mg/kg STZ(以枸橼酸缓冲液稀释),正常组腹腔注射等体积枸橼酸缓冲液。3 d后尾尖采血测定大鼠血糖,若随机血糖浓度≥16.7 mmol/L,则判断建模成功。继续2周自由饮食饲养后,再次测量血糖证实糖尿病大鼠模型成功与否,期间无大鼠死亡。最后将造模成功的大鼠随机分为4组,即模型组,汉黄芩苷低、高剂量组,Roscovitine对照组,每组10只。按照动物和人用药剂量换算关系确定大鼠的等效剂量相当于人的6.17倍[13],汉黄芩苷低、高剂量组分别给予汉黄芩苷[用二甲基亚砜(DMSO)溶解]10、40 mg·kg-1·d-1腹腔注射[10],Roscovitine对照组给予Roscovitine(用DMSO溶解)40 mg·kg-1·d-1腹腔注射[11],模型组和正常组腹腔注射等体积DMSO,连续给药时间为10周。
1.4 观察指标与方法
1.4.1 观察大鼠一般状态 包括精神状态、毛色、饮食、排便、活动、体质量等。
1.4.2 标本采集与处理 末次干预后,将大鼠放置于单独的代谢笼里,收集尿液,以检测24 h尿Alb含量。后禁食12 h,经大鼠尾静脉取血,检测血糖值。后用戊巴比妥钠30 mg/kg麻醉大鼠,腹主动脉取血,离心分离血清,用于空腹血糖与肾脏功能相关指标的测定。后处死大鼠,取出肾脏,统一将左肾置于4%的多聚甲醛中固定24 h用于组织学检查,右肾保存于液氮内用于组织蛋白质的提取。
1.4.3 血糖和肾功能指标检测 取血清,应用全自动生化分析仪测定大鼠空腹血糖(FBG)、血肌酐(SCr)和血尿素氮(BUN)。取尿液,严格按照ELISA试剂盒说明书测定大鼠尿Alb水平。
1.4.4 肾组织病理学观察 石蜡包埋的肾组织切片(4μm)经脱蜡、水化后,根据染色试剂盒说明书步骤进行常规HE染色和Masson染色,显微镜观察并照相,评估肾小球硬化和肾小管间质病变。
1.4.5 蛋白免疫印迹(Western Blot)实验 取液氮保存的肾脏组织,研钵碾碎后收集并加入预冷的放射免疫沉淀分析(RIPA)裂解液,混匀后离心,以12 000 g离心20 min,取上清。二喹啉甲酸(BCA)法测定蛋白质浓度,统一浓度后进行蛋白变性。加样,经十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳(PAGE),10%SDS凝胶上分离等量的蛋白(100μg)并转移到聚偏氟乙烯(PVDF)膜上,后将膜于5%脱脂乳中,37℃封闭2 h,于稀释后的 一 抗ColⅣ、α-SMA、TGF-β1、p-p38MAPK、p38MAPK、GAPDH(均1∶500稀释)中4℃孵育过夜。次日,TBST洗膜90 min(换液3~6次)后于25℃摇床孵育二抗(均1∶8 000稀释)2 h,TBST洗膜90 min(换液3~6次),PVDF膜于暗处浸润ECL显影试剂2~3 min,利用化学发光凝胶成像系统拍照记录。采用ImageJ软件分析条带灰度值,结果以目的蛋白与内参GAPDH的灰度值比值表示。
1.5 统计方法采用SPSS 22.0软件进行数据分析,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,两组间比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠一般状态比较给药治疗过程中,正常组大鼠精神状态良好,饮食、排便无异常,活动自如,反应力良好,皮毛色泽自然;模型组大鼠表现出烦渴、多食和多尿的症状,消瘦,行动迟缓,精神状态较差,皮毛色暗、毛糙无光泽;与模型组比较,汉黄芩苷低、高剂量组及Roscovitine对照组大鼠上述症状均明显好转。表明汉黄芩苷对糖尿病大鼠临床症状具有一定的改善作用。
2.2 各组大鼠血糖和肾功能指标比较表1结果显示:与正常组比较,模型组大鼠血清FBG、BUN、SCr及尿Alb水平均明显升高(P<0.05);与模型组比较,汉黄芩苷低、高剂量组和Roscovitine对照组血清FBG、BUN、SCr及尿Alb水平显著降低(P<0.05);汉黄芩苷低、高剂量组血清FBG、BUN、SCr及尿Alb水平均高于Roscovitine对照组,其中,汉黄芩苷高剂量组血清FBG和SCr水平的差异均无统计学意义(P>0.05)。表明糖尿病大鼠模型存在肾功能损害,而汉黄芩苷可改善糖尿病大鼠血糖水平及肾功能损害。
表1 各组大鼠血糖和肾功能指标比较Table 1 Comparison of blood glucose and renal function indexes among various groups of rats (±s)
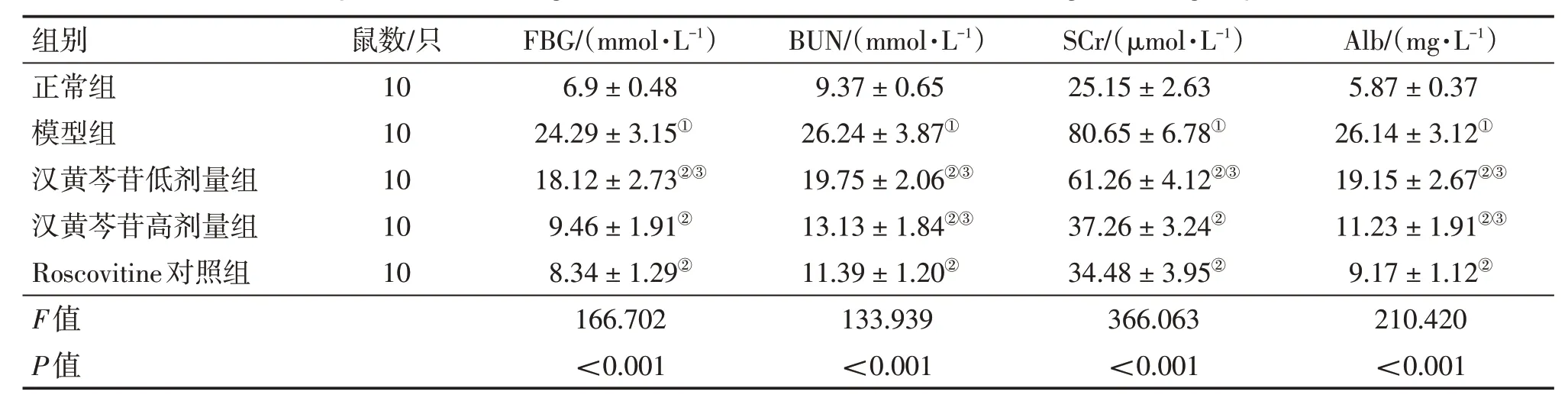
表1 各组大鼠血糖和肾功能指标比较Table 1 Comparison of blood glucose and renal function indexes among various groups of rats (±s)
①P<0.05,与正常组比较;②P<0.05,与模型组比较;③P<0.05,与Roscovitine对照组比较
组别正常组模型组汉黄芩苷低剂量组汉黄芩苷高剂量组Roscovitine对照组F值P值鼠数/只10 10 10 10 10 FBG/(mmol·L-1)6.9±0.48 24.29±3.15①18.12±2.73②③9.46±1.91②8.34±1.29②166.702<0.001 BUN/(mmol·L-1)9.37±0.65 26.24±3.87①19.75±2.06②③13.13±1.84②③11.39±1.20②133.939<0.001 SCr/(μmol·L-1)25.15±2.63 80.65±6.78①61.26±4.12②③37.26±3.24②34.48±3.95②366.063<0.001 Alb/(mg·L-1)5.87±0.37 26.14±3.12①19.15±2.67②③11.23±1.91②③9.17±1.12②210.420<0.001
2.3 各组大鼠肾脏组织HE染色结果比较图1结果显示:正常组大鼠肾小球形状规则、结构完整,肾小管上皮细胞排列整齐,肾脏无纤维组织增生及基底膜增厚,系膜细胞和基质无增殖;模型组出现了明显肾间质损伤,可见炎症细胞浸润,肾小管管腔扩张,系膜基质增多,基底膜增厚,基底细胞增生;与模型组比较,汉黄芩苷低剂量组肾组织病理损伤改善轻微,而汉黄芩苷高剂量组肾组织病理损伤得到了较大程度的改善,且与Roscovitine对照组结果相似。表明糖尿病大鼠模型存在肾组织病理损伤,而汉黄芩苷可减轻糖尿病大鼠肾组织病理损伤。
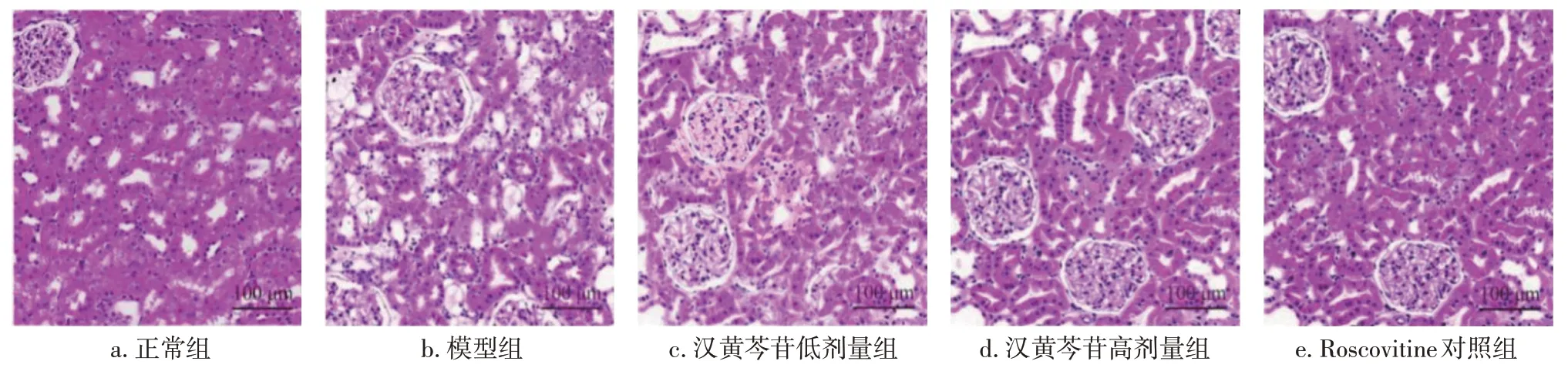
图1 各组大鼠肾脏组织HE染色结果比较(×200)Figure 1 Comparison of HE staining results of rat renal tissues among various groups(×200)
2.4 各组大鼠肾脏组织Masson染色结果比较图2结果显示:正常组大鼠肾组织基本正常,无胶原纤维蓝色染色;模型组大鼠肾间质和肾小球的胶原纤维蓝色染色较深,蛋白沉积显著增加,肾纤维化严重;汉黄芩苷低、高剂量组及Roscovitine对照组大鼠肾小球及肾间质胶原纤维蓝色染色较模型组变浅。表明糖尿病大鼠模型存在肾纤维化,而汉黄芩苷可减轻糖尿病大鼠肾纤维化。
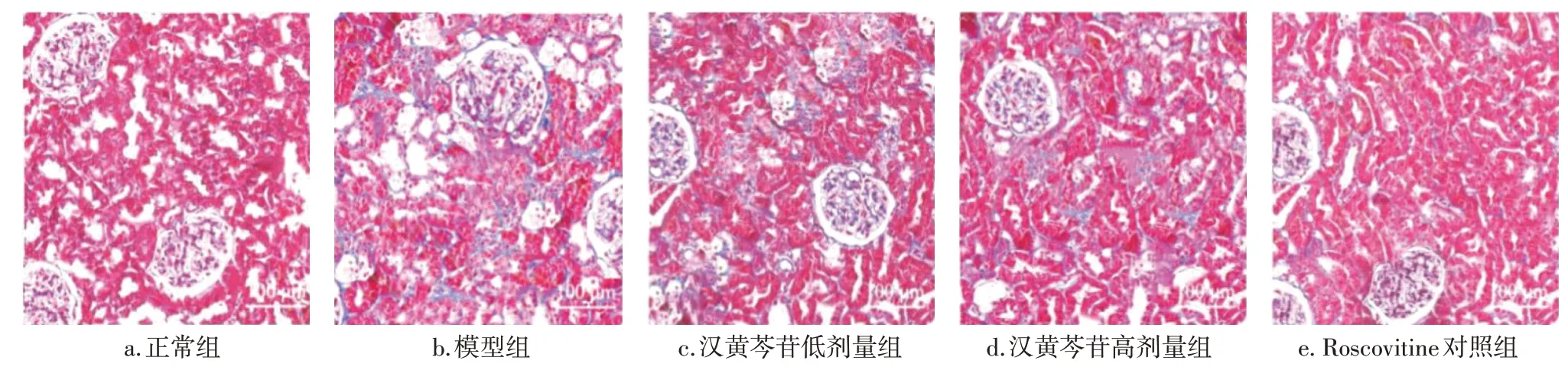
图2 各组大鼠肾组织Masson染色结果比较(×200)Figure 2 Comparison of Masson staining results of rat renal tissues among various groups(×200)
2.5 各组大鼠肾组织TGF-β1、p38MAPK、pp38MAPK、α-SMA及ColⅣ蛋白表达比较表2、图3结果显示:与正常组比较,模型组肾组织TGF-β1、p38MAPK、p-p38MAPK、α-SMA及ColⅣ蛋白表达水平均显著升高(P<0.05);与模型组比较,汉黄芩苷低、高剂量组及Roscovitine对照组肾组织TGF-β1、p38MAPK、p-p38MAPK、α-SMA及ColⅣ的蛋白表达水平显著降低(P<0.05);汉黄芩苷低、高剂量组肾组织TGF-β1、p38MAPK、p-p38MAPK、α-SMA及ColⅣ蛋白表达水平均高于Roscovitine对照组,其中,汉黄芩苷高剂量组的α-SMA及ColⅣ蛋白表达水平的差异无统计学意义(P>0.05)。表明汉黄芩苷可抑制糖尿病大鼠肾组织纤维化相关蛋白的表达及TGF-β1/p38MAPK通路的活化。
表2 各组大鼠肾组织转化生长因子β1(TGF-β1)、丝裂原活化蛋白激酶p38(p38MAPK)、磷酸化p38MAPK(p-p38MAPK)、α平滑肌肌动蛋白(α-SMA)及Ⅳ型胶原蛋白(ColⅣ)蛋白表达水平比较Table 2 Comparison of protein expression levels of TGF-β1,p38MAPK,p-p38MAPK,α-SMA and ColⅣin rat kidney tissues among various groups (±s)
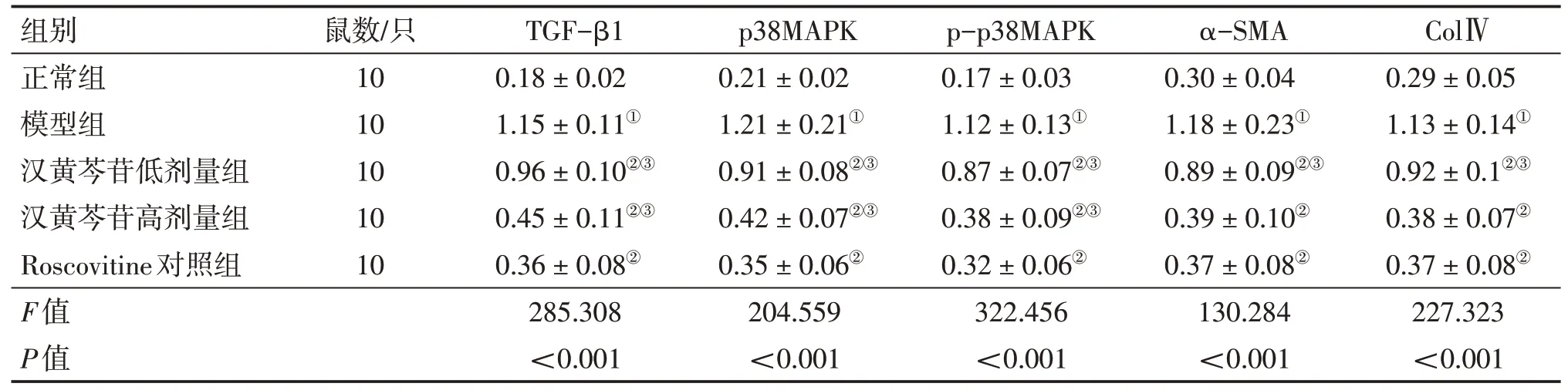
表2 各组大鼠肾组织转化生长因子β1(TGF-β1)、丝裂原活化蛋白激酶p38(p38MAPK)、磷酸化p38MAPK(p-p38MAPK)、α平滑肌肌动蛋白(α-SMA)及Ⅳ型胶原蛋白(ColⅣ)蛋白表达水平比较Table 2 Comparison of protein expression levels of TGF-β1,p38MAPK,p-p38MAPK,α-SMA and ColⅣin rat kidney tissues among various groups (±s)
①P<0.05,与正常组比较;②P<0.05,与模型组比较;③P<0.05,与Roscovitine对照组比较
组别正常组模型组汉黄芩苷低剂量组汉黄芩苷高剂量组Roscovitine对照组F值P值鼠数/只10 10 10 10 10 TGF-β1 0.18±0.02 1.15±0.11①0.96±0.10②③0.45±0.11②③0.36±0.08②285.308<0.001 p38MAPK 0.21±0.02 1.21±0.21①0.91±0.08②③0.42±0.07②③0.35±0.06②204.559<0.001 p-p38MAPK 0.17±0.03 1.12±0.13①0.87±0.07②③0.38±0.09②③0.32±0.06②322.456<0.001 α-SMA 0.30±0.04 1.18±0.23①0.89±0.09②③0.39±0.10②0.37±0.08②130.284<0.001 ColⅣ0.29±0.05 1.13±0.14①0.92±0.1②③0.38±0.07②0.37±0.08②227.323<0.001
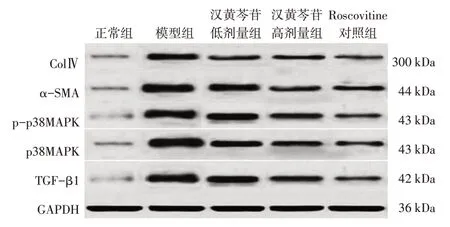
图3 各组大鼠肾组织转化生长因子β1(TGF-β1)、丝裂原活化蛋白激酶p38(p38MAPK)、磷酸化p38MAPK(p-p38MAPK)、α平滑肌肌动蛋白(α-SMA)及Ⅳ型胶原蛋白(ColⅣ)的Western Blot电泳条带图Figure 3 Western Blot electrophoresis bands of TGF-β1,p38MAPK,p-p38MAPK,α-SMA and ColⅣin rat kidney tissues among various groups
3 讨论
病理条件下,糖尿病的高血糖启动和激活一系列复杂过程,伴有大量细胞(包括间质成纤维细胞、内皮细胞、管状细胞和周围细胞)和肌母细胞活化产生的基质蛋白如纤维连接蛋白、层黏连蛋白和Ⅰ、Ⅲ、Ⅳ胶原蛋白等,可诱导糖尿病肾间质纤维化(tubulointerstitial fibrosis,TIF)[14]。TIF标志着不可逆性肾损伤,可作为肾脏生存期的最佳预测指标[11],是各种肾脏疾病发展成为终末期肾衰竭的共同途径。BUN、SCr和Alb水平是评估早期肾功能的重要指标,白蛋白尿则是糖尿病肾脏损伤中最典型的临床症状之一。本研究结果显示,糖尿病模型大鼠FBG及尿Alb含量显著升高,提示成功建立糖尿病大鼠模型并伴有肾脏损伤;而经不同剂量汉黄芩苷及Roscovitine治疗后,大鼠FBG及尿Alb含量均显著降低,表明汉黄芩苷可有效改善糖尿病大鼠肾功能。汉黄芩苷为40 mg/kg剂量时具有与Roscovitine相似的疗效。
糖尿病肾脏损伤的病理标志包括肾小球和肾小管基底膜的增厚、肾小球硬化及TIF[15],其中,TIF为关键性病理过程,被认为是导致肾小球和肾小管功能障碍及衰退的主要病理因素[16],表现为肾间质成纤维细胞的增多和细胞外基质(ECM)尤其是大量胶原纤维如ColⅣ的过度沉积[17]。α-SMA为肌成纤维细胞的标志性蛋白,其表达过量时,会促进肾纤维化病理过程[18]。TGF-β1是TGF-β超家族的成员,是通过调节ECM合成参与肾脏纤维化的重要因子[19],可诱导肾小管上皮细胞转分化为肌成纤维细胞。另外,TGF-β1作为通路上游因子可激活p38MAPK信号,p-p38MAPK为p38MAPK通路 中的关键信号分子,其表达增强是该信号通路激活的标志之一[20]。本研究结果显示,糖尿病模型大鼠肾脏组织发生明显病理损伤,可见肾小球增大、炎症细胞增多、基底膜弥漫性增厚、系膜处基质增多,肾纤维化程度严重,给予汉黄芩苷干预后,大鼠肾组织纤维化得到了明显改善,表明汉黄芩苷具有抗糖尿病肾损伤及纤维化的作用。本研究结果还显示,模型组肾组织TGF-β1及其下游信号因子p38MAPK的磷酸化水平和肾纤维化标志物α-SMA、ColⅣ均呈高表达,而汉黄芩苷低、高剂量组大鼠肾脏组织上述各分子指标表达水平均较模型组降低,且高剂量汉黄芩苷的治疗效果更显著,提示汉黄芩苷可能是通过抑制TGF-β1及其下游信号因子p38MAPK的活化,进而改善糖尿病大鼠肾纤维化。
综上所述,汉黄芩苷可有效改善糖尿病大鼠肾损伤及纤维化,其机制可能与抑制TGF-β1/p38MAPK信号通路的活化有关。
