一株鳙源鲁氏耶尔森氏菌的分离鉴定及其感染的肠道病理损伤
2022-09-24刘芸娜尚信池张培军卢玉婷刘佳汪惠庆闫子豪李月红
刘芸娜 尚信池 张培军 卢玉婷 刘佳 汪惠庆 闫子豪 李月红
(1 吉林农业大学动物科学技术学院 教育部动物产品与质量安全重点实验室,吉林长春 130118; 2 吉林省卫生监测检测中心,吉林长春 130000)
鲁氏耶尔森氏菌(Yersiniaruckeri)是一种革兰氏阴性细菌,隶属于肠杆菌科(Enterobacteriaceae)、耶尔森菌属(Yersinia),可以引起淡水鱼和海水鱼的耶尔森氏菌病。肠道红口病(enteric red mouth,ERM)也称为耶尔森氏菌败血症,患肠道红口病的鱼体表症状多数为腹部、下颌及嘴周出现大量出血点,肛门腺发炎、红肿,剖检呈大量腹水,肝脏坏死,肠道严重胀气,肠壁薄而脆等。该病最早于20世纪50年代在美国发现,是一种水产养殖鱼类尤其是鲑鳟鱼类易感、严重危害渔业经济发展的细菌性疾病[1-3]。鲁氏耶尔森氏菌主要引起冷水性鲑鳟鱼类发病,但近年来在我国相继发现该病原体也可感染鲢(Hypophthalmichthysmolitrix)、鳙(Aristichthysnobilis)等鲤科鱼类[3-5],而且最常见的是由血清型为01的病原体菌株引起的[6-7]。耶尔森氏菌病现在已经广布全球,这可能是因为在全球化发展过程中,被感染动物的运输导致了疾病的传播[8]。该病在我国北方很少发生,目前尚未见鲢、鳙大面积暴发该病的报道。但就全国来看,该病在地理分布上还是呈扩增趋势的。
为了进一步阐明病原体的分类状况,本试验从吉林省某养殖基地患病鳙鱼的血液、器官和伤口中分离出细菌分离株,通过VITEK®MS全自动分析系统和16S rRNA基因的测序分析,鉴定并确认了该菌,同时进行了系统发育分析和体外药物敏感性测试。此外,还提供了有关受影响鳙鱼的临床病变以及肠道组织病理学的观察结果。本研究旨在为水产养殖疾病预防提供合理的技术指导,促进淡水养殖业的健康发展。
1 材料和方法
1.1 试验材料
发病鳙鱼取自吉林省某养殖基地,体质量为2 kg。健康鳙鱼购自常盛鱼苗孵化场,体质量为20~30 g。
主要试剂:营养琼脂培养基(LB)、革兰氏染色试剂盒购自上海铭睿生物科技有限公司;细菌基因组DNA提取试剂盒、Taq酶等购自TaKaRa公司。
主要仪器:法国梅里埃公司的VITEK 2 Compact全自动微生物鉴定系统(进行鉴定),VITEK®MS全自动快速微生物质谱检测系统,透射电子显微镜,YXQ-LS-50A立式压力蒸汽灭菌锅,恒温培养箱,SW-CJ-2FD型超净工作台,TG-16WS台式高速离心机,Life Pro梯度PCR仪,凝胶成像系统。
1.2 菌株的分离
无菌条件下,分别取病鱼的腐烂肌肉和血液,加入无菌的生理盐水制成匀浆,将匀浆稀释至合适的稀释度,取其中3个最适稀释度的稀释液200 μL并涂布于LB培养基上,在28 ℃恒温培养箱中培养16 h。挑取形态一致的优势菌群进行纯化培养,挑取单菌落,用体积分数为80%的甘油对其进行菌种的保存备用。
1.3 菌株的鉴定
1.3.1 革兰氏染色观察
取无菌洁净载玻片,将分离的菌株转移到载玻片上,用酒精灯干燥,使其固定,经结晶紫染液初染,碘液媒染,酒精脱色,番红染液复染后即可通过镜检观察染色结果。
1.3.2 透射电子显微镜观察
将细菌培养液以3 000 r/min离心10 min后进行负染色电子显微镜检查。使用1 mL注射器(取下针头)提取0.1~0.2 mL细菌悬液,小心滴在铜网上,再用一块无菌滤纸吸收铜网边缘的残留液体,然后静置2 min(此时未完全干燥)。用1 mL注射器(取下针头)将0.1~0.2 mL的染色液滴到带有细胞的铜网上,静置1~2 min,然后使用一小块滤纸吸收铜网边缘的染料溶液,自然干燥,5 min后用电子显微镜观察。
1.3.3 生理生化鉴定
采用法国梅里埃公司的VITEK®MS全自动快速微生物质谱检测系统进行生理生化鉴定,鉴定板为革兰氏阴性菌鉴定板,试验结束后观察及分析结果。
1.3.4 分子生物学鉴定及系统发育树的构建
用LB液体培养基冲洗收集纯化的菌株,提交至库美生物工程股份有限公司进行PCR扩增和16S rRNA测定。16S rRNA基因的扩增引物为27F(5’AGAGTTTGATCCTGGCTCAG 3’)和1492R(5’TACGGYTACCTTGTTACGACTT 3’),将菌株的16S rDNA序列与NCBI数据库中细菌的16S rDNA进行比对,从中选取10株与该菌株基因序列最相似的菌株和5种水产常见病原菌,采用ClustalW软件进行多序列匹配分析,用MEGA 6.0软件包中的Neighbor-Joining法构建系统进化树,通过1 000次Bootstrap检验置信度[9],并将PCR产物通过1%琼脂糖凝胶电泳进行确认[10]。
1.4 回归感染试验
取上述已鉴定的菌液500 μL,使用10 mL LB培养液(28 ℃,120 r/min)过夜培养16 h。培养好的菌液离心后弃掉上清液,用生理盐水分别稀释至2.84×108、2.84×107、2.84×106、2.84×105cfu/mL,随后进行攻毒试验。将健康鳙鱼分为5组,每组10尾鱼,其中4个处理组(编号1~4)鱼体分别使用上述4个浓度腹腔注射0.2 mL的鲁氏耶尔森氏菌(JL9510)分离物,对照组则腹腔注射0.2 mL的生理盐水。在攻毒试验的7 d里,试验鱼均分别饲养在密闭的养殖箱中,水温保持在18~20 ℃。所有鱼按体质量的1%投饲,隔天换水一次,清除粪便、残饲等污物。试验期间,每天记录试验鱼的临床体征,及时取出死鱼,对死亡的标本进行微生物学分析,以确定由鲁氏耶尔森菌引起的死亡率。
1.5 病理损伤研究
取发病鳙鱼和健康鳙鱼的肠道分别固定于4%的中性福尔马林溶液中,采用苏木精-伊红染色法进行组织病理学研究。
1.6 药敏试验
采用药敏纸片的方法进行药敏试验。使用LB培养液(28 ℃,过夜,120 r/min)培养细菌,在超净工作台上吸取200 μL菌液涂布于LB板,取药敏纸片贴于该板上。将平板倒置于恒温培养箱中,28 ℃下培养24 h。用游标卡尺测量抑菌圈直径,判断该菌株对氟苯尼考和环丙沙星两种抗生素的敏感程度。
2 结果
2.1 临床症状
发病鳙鱼精神沉郁,游动迟缓,漂浮于水面,体表出现大量出血点及坏死灶(见图1)。胸鳍基部及尾鳍基部肌肉出血明显,口部出血明显,头部溃烂,肉眼可见骨条。肝脏肿大(见图2),背部腐烂严重(见图1-d)。肠道严重充气,肠壁组织炎症明显,呈半透明状(图2-b)。显微镜下检查血液、黏液及溃疡灶组织,未见寄生虫和真菌。


2.2 病原菌的分离
从自然发病鳙鱼的血液、肝、肾及体表溃烂处均分离到了1株优势菌株,编号为JL9510。在28 ℃下培养12 h后,可见菌株在LB平板上形成直径约为1 mm的半透明菌落(见图3)。镜检观察,菌体呈短杆状,革兰氏染色后镜检结果见图4,电镜下检查病鱼血液中的细菌见图5。经VITEK®MS全自动快速微生物质谱检测,结果为鲁氏耶尔森氏菌,置信度为99.9。
图3 LB培养基上的白色透明菌落

图4 革兰氏染色显微镜下观察分离纯化的细菌结果(油镜×20)

图5 负染色电子显微镜检查从患病鳙鱼血液中发现的杆状细菌(比例尺=2 μm)
2.3 回归感染试验
回归感染试验中,处理组4从试验第1天开始即有试验鱼发病死亡,处理组2、3从第2天,处理组1从第3天开始有试验鱼发病死亡,对照组则未出现死亡情况(见图6)。经寇氏法计算分析,LD50=8.99×106cfu/mL。病检结果显示,回归感染发病鱼的症状与自然发病鱼的一致(见图7)。在回归感染发病鳙鱼的肝脏和肠道处分离到与菌株JL9510表面形态一致的菌株,因此推断该菌对鳙鱼具有致病性。

图6 回归感染试验鳙鱼的成活率

2.4 系统发育分析
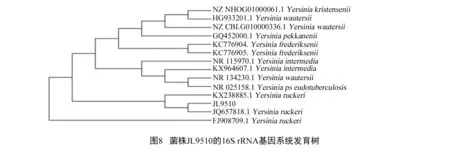
经16S rRNA基因扩增,得到1 406 bp的PCR产物,将库美生物工程股份有限公司测序的结果在GenBank中进行BLAST比对分析,用Mega 6.0进行系统发育树的构建。16S rRNA测序结果显示,菌株JL9510与已知菌株JQ657818.1Yersiniaruckeri序列相似性达到99.98%,同源关系最近。通过系统发育树可以看出,JL9510与菌株JQ657818.1Yersiniaruckeri聚为一支(见图8~9)。

2.5 药敏试验
药敏试验判定参照美国临床实验室标准化委员会的VET01-A4标准进行。通过试验测量抑菌直径,发现菌株JL9510对氟苯尼考敏感,对环丙沙星耐药(见表1)。

表1 鲁氏耶尔森氏菌JL9510的药物敏感性试验结果
2.6 肠道组织学观察
通过组织学观察发现,感染组鳙鱼肠组织损伤明显,肠腔中可见坏死脱落的肠道组织,黏膜层结构大面积缺失,仅局部可见残余的肠绒毛,黏膜下层水肿(见图10)。

图10 对照组和感染组鳙鱼的肠组织切片
3 讨论和分析
耶尔森氏菌是肠道红口病(enteric red mouth,ERM)的病原体,该病几乎波及所有的鲑鳟鱼类,给鲑鱼养殖业造成了重大的影响。20世纪50年代,研究人员最初在爱达荷州哈格曼河谷(美国)的患病鳟鱼中分离到了致病性耶尔森氏菌(Yersiniaruckeri)[11]。此次我国北方暴发的鲁氏耶尔森氏菌病也导致大量鳙鱼死亡,给养殖场带来了严重的经济损失。通过先进的技术手段,鲁氏耶尔森氏菌的致病机理已被阐明,温度是涉及毒力基因调节的主要因素之一,毒力基因在温度变化时被高度诱导。在其他因素保持不变的情况下,温度16 ℃比12 ℃试验条件下鲁氏耶尔森氏菌引起的鲑鱼死亡率更高[12]。在本研究中,菌株JL9510可以在28 ℃的恒温培养箱中生长。
本试验通过多种鉴定手段,确定了患病鳙鱼血液中的鲁氏耶尔森氏菌。资料显示,之前也有鲁氏耶尔森氏菌引起水产动物感染发病的报道。本试验中,患病鳙鱼有肠道充气、腹腔严重积水等临床症状;药敏试验发现,该菌对氟苯尼考敏感,这与方苹等[4]的研究结果相似。病鱼口腔充血、肠道充气、肠壁充血和腹腔积水等现象,与已报道的鲁氏耶尔森氏菌病相似[13]。目前尚无使用疫苗控制该疾病的可能性,但药敏试验进一步表明,与使用其他常规药物相比,使用氟苯尼考可能会降低重新感染的机会[14-16]。为避免滥用药物,在治疗鱼类细菌性疾病时,应根据药物敏感性试验结果选择敏感的抗生素。本试验结果可用于对感染耶尔森氏菌的鳙鱼进行有效处理,为养殖安全用药提供参考。
本试验中,被耶尔森氏菌感染的鳙鱼主要表现出器官坏死、变性、出血和败血症。对其肠道进行组织学观察,发现致病菌严重破坏小肠绒毛,使肠壁变薄,影响肠道健康,这与其他宿主因耶尔森氏菌引起的临床症状不同。耶尔森氏菌的地理分布和寄主范围已显著扩大,目前影响几乎所有养殖鲑鱼。除北美外,在欧洲国家也发现了该病,鲑鱼发病后死亡率一般为30%~40%[17]。在我国,鳙鱼受到人们的普遍青睐,尤其近年来市场多样化的需求使得鳙鱼养殖量逐年增加,而耶尔森氏菌也能感染鳙鱼,因此应给予足够的重视。在鳙鱼育种过程中,应加强对病原体的监测,从养殖管理、水质监测等方面加强预防[18-19],及时采取有效的防控措施并适当使用药物,避免鱼体感染的进一步扩大。
