非洲猪瘟的流行病学及疫苗研究新进展
2022-09-23李国新童光志
黄 剑,李国新,童光志
(1.福建农林大学动物科学学院,福州 350002;2.中国农业科学院上海兽医研究所,上海 200241)
非洲猪瘟(ASF)自1921年在非洲肯尼亚发现后,随后陆续传至非洲其他地区、欧洲、美洲和俄罗斯等区域,2018年8月,在中国辽宁发现首例ASF疫情,并迅速扩散至全国各地,由此直接导致我国生猪存栏量急剧下降。由于目前还未有有效的疫苗[1-3],因此,疫苗的研制迫在眉睫。本文主要从近些年ASF流行病学及疫苗的研究进展加以综述。
1 流行病学
非洲猪瘟是由非洲猪瘟病毒引起的以高热、呼吸障碍和神经症状为主要特征的一种急性、烈性传染病[4]。ASFV可感染不同年龄段的家猪和野猪,临床上最急性型和急性型ASF的死亡率高达100%,亚急性型的死亡率可降低30~70%。
ASFV的传播途径主要有直接接触感染动物或软蜱叮咬传播、也可通过污染过的泔水、饲料等食物传播、另外也能通过接触感染过的猪尸体或其产品进行传播[5-7]。1998年马达加斯加[8]暴发的ASF疫情就是通过野猪与家猪直接接触导致;1985年由于非法饲喂泔水导致荷兰[9]暴发ASF;2018年中国[10]也暴发了ASF,具体的传播来源见表1。可以发现,ASFV主要通过国际贸易以及走私等方式导致了跨国、跨洲的传播,地方性流行主要通过易感猪与带毒猪的接触以及ASFV污染过的料、餐余垃圾、泔水等传播。

表1 ASF疫情传播来源Table 1 Sources of African swine fever transmission
2 病原学
ASFV是非洲猪瘟病毒科非洲猪瘟病毒属的唯一成员[11-13]。是具有囊膜包被的二十面体DNA病毒[14]。ASFV基因组长度为170~190 kb,有150多个开放阅读框(opening reading frame, ORF)[15-19],编码50多种结构蛋白和100多种非结构蛋白(见图1-1)。ASFV病毒粒子由里到外主要由5部分组成:含病毒基因组(genome)DNA的拟核、内核芯壳(core shell)、内膜(inner envelope)、衣壳(capsid)和囊膜(external envelope)[20]。其结构主要包含中间约130 kb比较稳定的基因区(stable region),两边为20~40 kb的由串联重复序列和多基因家族(multigene families, MGF)构成的可变区(variable region)[21],末端是有37 nt部分碱基互补配对的发卡环结构(hairpin loop)[22]。标准的免疫学实验不能区分病毒株,但通过对编码p72的基因B646L末端约500 bp核苷酸的序列分析法,目前已经鉴定出24种ASFV基因型[23]。

图1 ASFV结构示意图[24]Fig.1 The structure of ASFV
ASFV的生命周期主要有病毒吸附、入侵、复制、包装和出芽5个过程。ASFV进入机体,单核巨噬细胞首先受到感染,ASFV通过CD163受体介导的内吞作用进入细胞,然后利用相关因子进行早期mRNA的转录,这时主要编码早期所需的酶类,如DNA聚合酶等[25]。最初的研究认为,胞质的病毒工厂是基因组复制的起点[26];后来发现,感染早期基因组在细胞核也出现了复制,核内复制产生的基因组比正常基因组要小,目前尚不清楚其中的作用[27]。但是可以由此推测,早期在细胞核内复制的基因组被转运到病毒工厂后用于正常基因组的复制[28]。ASFV在细胞质的病毒工厂进行复制加工,比如核蛋白的包装,形成二十面体对称的衣壳。包装好的病毒粒子通过微观作用移至细胞膜,通过出芽的方式获得外层囊膜[25]离开宿主细胞。
3 疫苗研究进展
过去几十年大量的研究表明,灭活疫苗虽能诱导抗体反应,但对强毒攻击不能提供有效保护;基于单个或多个保护性抗原的亚单位疫苗,包括重组蛋白、DNA疫苗和病毒活载体疫苗等,能对免疫动物提供部分保护;而弱毒活疫苗,包括天然弱毒株、传代培养致弱毒株和基因缺失弱毒株等,能诱导体液免疫应答和细胞免疫应答,为接种动物提供高水平的保护,被认为是最有希望研制成功的疫苗(表2)。
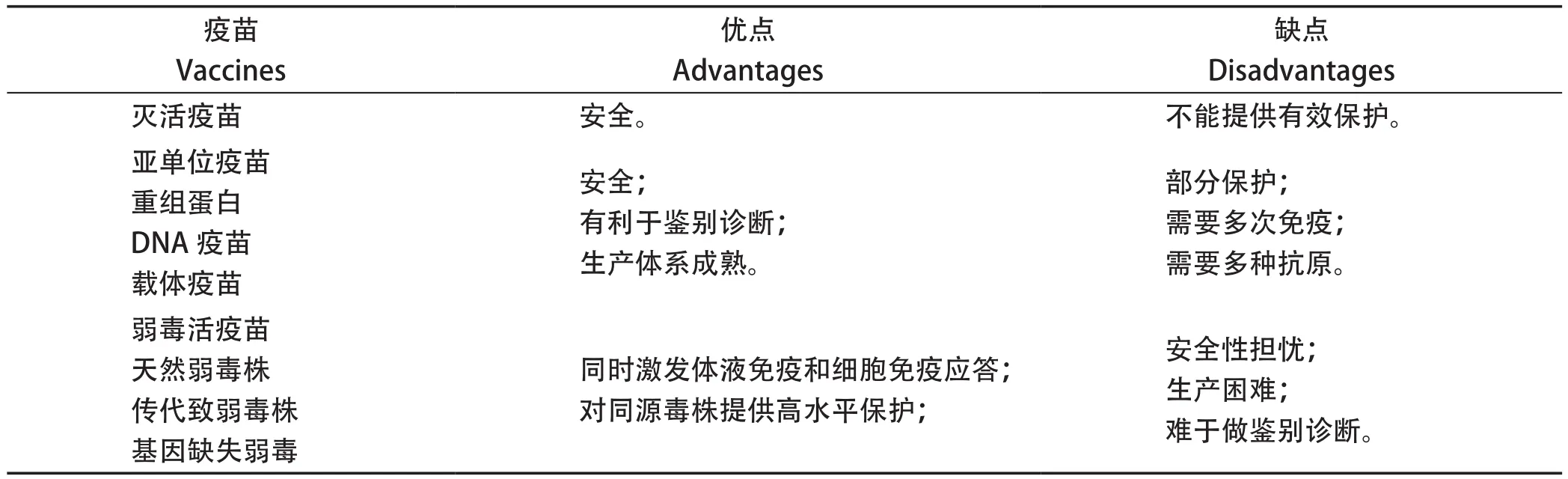
表2 不同类型的非洲猪瘟疫苗的特性Table 2 Characteristics of different types of African swine fever vaccines
3.1 灭活疫苗 ASF疫情暴发后,最先开始研究的是灭活疫苗,但是不能提供有效的保护作用[29]。后来Blome等[30]将佐剂PolygenTM与Emulsigen®-D与ASFV的灭活制剂混合后免疫猪,结果发现能够检测到特异性抗体,但是并没有观察到保护作用。此外,灭活疫苗免疫后也已经观察到抗体介导的感染增强现象[31-32]。
灭活疫苗引起的细胞免疫应答弱且很难诱导产生有效的中和抗体,这也是灭活疫苗不能提供有效保护的主要原因。
3.2 减毒活疫苗
3.2.1 传代致弱毒株 ASFV经细胞传代培养,会导致病毒基因组部分区域缺失,从而使病毒毒力减弱,这曾经使研究者看到了研制ASF疫苗的希望。ASFV-G株在Vero细胞上传代培养,使该毒株在Vero细胞上复制越来越强,在猪原代巨噬细胞上的复制能力下降,病毒毒力逐渐减弱,直至在第110代毒力完全丧失。但经多次传代培养的毒株抗原性也发生了改变,给家猪接种后,没能诱导有效的免疫应答。用猪骨髓细胞传代培养获得的弱毒株免疫猪可以抵抗强毒株的攻击。但该弱毒株在葡萄牙和西班牙的田间试验,造成了灾难性的后果。接种猪出现肺炎、皮肤溃疡、流产甚至死亡等严重的副作用。在葡萄牙,55万头接种猪有超过12万头猪出现副反应,并出现大量的病毒携带猪。此次试验失败后,再无弱毒株进行过田间试验[33]。
“昆南”阴平声字“他”的唱调(《南西厢·佳期》【十二红】“爱他两意和谐”,687),其中的即为两节型过腔。虽然这个过腔的音乐材料都相同,都来自于本唱调音阶的级音,但由此组成的乐汇或句型可以分作两节,为第一节级音性过腔,为第二节级音性过腔。这个过腔即是由同一种音乐材料组成的两节型过腔。
3.2.2 天然致弱毒株 目前,研究较多的天然致弱毒株有OURT88/3和NH/P68,这两种毒株接种猪能抵抗同型强毒的攻击,保护率最高可达100%。但天然致弱毒株作为疫苗需要解决安全性问题,已经证实,大部分接种猪会产生肺炎、运动障碍、流产甚至死亡等安全问题。
最近,欧洲报道了一株分离自野猪的基因Ⅱ型天然致弱毒株Lv17/WB/Rie1[34],与OURT88/3和NH/P68类似,该毒株无红细胞吸附活性。以10 TCID50剂量肌肉注射该毒株,接种猪仅产生轻微的临床症状,表现3~5 d的低烧(40℃~40.7℃),伴随着不同程度的耳朵发绀和关节肿胀。接种猪能排毒并且接触猪也能被感染,接种猪和接触猪都能产生高水平的抗体。在感染2个月后,所有接种猪和接触猪完全暴露于感染强毒的猪中,感染弱毒株的猪能完全抵抗强毒株的攻击。
Lv17/WB/Rie1毒株以口服方式接种野猪,6/9的接种猪和3/3接触猪在一个月的试验期内抗体转阳。有7/9的接种猪和1/3的接触感染猪有平均3~4 d的轻微发热(40.1℃~40.8℃)。强毒株攻击后,11/12接种猪和接触猪存活,没有表现出任何非洲猪瘟的临床症状。30 d免疫期内2头没有抗体反应也没有发热的猪,在强毒攻击后第3 d和第7 d抗体转阳。唯一死亡的1头猪在攻毒前后都没有检测到抗体,在攻毒后,和对照攻毒猪一样,表现出了典型的临床症状。
3.2.3 基因缺失弱毒株 重组ASFV见表3[35-42]。包括特定的基因缺失,例如胸苷激酶(thymidine kinase T,K)的缺失,可能会产生非致病性的毒株[35-36]。此外,删除涉及免疫逃避的基因,DP71L基因以及多基因家族360和505(MGF360和MGF505),或与病毒复制有关的基因以及B119L基因,可以使ASFV强毒株毒性减弱并且可以诱导保护性免疫应答来抵抗强毒的攻击,但残留毒力水平不同[37-40]。敲除单个或多个基因获得的基因缺失毒株,毒力减弱而且可诱导不同程度的针对同源毒株或异源毒株的保护[41]。

表3 ASFV基因缺失毒株及其特性Table 3 Genes deletion strain of ASFV and its characteristics
最近,我国报道了一株由中国农业科学院哈尔滨兽医研究所构建的基因缺失病毒株(HLJ/18-7GD),初步试验证明,该基因缺失(MGF505-1R、MGF505-2R、MGF505-3R、MGF360-12L、MGF360-13L,MGF360-14L和CD2v缺失)疫苗具有较好的安全性和有效性[42]。
3.3 亚单位疫苗 ASFV编码150多个蛋白,而且很多蛋白的功能不清,因此,选择可以作为亚单位疫苗的候选抗原将十分困难。目前,已有报道,ASFV结构蛋白p72、p54、p30、p12、CD2v等都可以引起机体产生免疫应答见表4[41-51]。
使用杆状病毒同时表达的p54和p30蛋白共同免疫猪,可有效抵抗E75毒株的致死性攻击[43],而使用杆状病毒表达p72、p54和p30蛋白组合免疫猪,虽然能够检测到中和抗体,但是对致病性Malawi分离株并不提供保护能力。这些不同的结果可能是使用不同的病毒株造成的,同时细胞免疫应答对于保护作用也尤为关键。Argilaguet等[44]的研究结果表明,编码p54和p30蛋白的DNA疫苗不会诱发产生中和抗体,面对E75毒株的致死性感染时不提供保护能力。这提示,使用相同的抗原,但不同形式的疫苗可能产生不同的结果。

表4 不同类型亚单位疫苗的特性Table 4 Characteristics of different types of subunit vaccines
腺病毒、痘病毒或伪狂犬病病毒作为载体表达ASFV抗原能够诱导比较强的体液免疫的应答和细胞免疫应答[47-49],但是其免疫保护效力需要进一步评价。近期有以腺病毒为载体表达的多种抗原采取“鸡尾酒式”免疫野猪后,并不提供保护作用[50-51]。
4 结语与展望
目前,ASF疫情几乎席卷我国所有地区,就连越南、蒙古、柬埔寨等周边国家也相继报道[52],我国及时地采取封锁隔离、扑杀等方式,有效地控制了疫情的进一步蔓延,但是随着贸易全球化,国内跨区域的人流、物流、车流、猪流以及肉制品的流动给疫情的控制增添了不少烦恼。此外,我国目前流行的ASFV能引发野猪感染致死[53]。在有效疫苗问世之前,可以从生物安全角度进行防控,形成运输车-实验室-隔离点三级隔离监测系统,提升猪场生物安全水平,即生猪在调运时需隔离消毒几天且每天采样送至实验室检测是否含有病毒源,无病毒才可允许进出;同时也要妥善处理带毒猪和污染物[54]。
由于ASFV生物学特性的复杂性,迄今为止还未能研制出安全有效的疫苗[55]。对于ASFV与宿主互作的各种机制,如免疫逃避机制、免疫保护机制等,我们知之甚少;还有很多病毒蛋白的功能尚不清楚,这严重阻碍了ASF疫苗的研发进程。灭活疫苗十分安全,但是诱导的免疫应答较弱,不能提供有效的保护能力。
弱毒活疫苗被认为是ASF疫苗研发最有希望的疫苗。对于基因缺失弱毒活疫苗的研制,安全性是要考虑的最重要因素。比如重复接种和超剂量接种的安全性、病毒在体内外的稳定性、与流行的野毒株重组的可能性等。理想的情况是,找到几种与毒力相关和免疫抑制相关的基因,并寻求在它们之间找到一个合适的组合,进行敲除,在疫苗的安全性和有效性上获得精准的平衡。我国近期研发的MGF 360/505、CD2v基因缺失毒株HLJ/18-7GD在实验室条件下具备安全性和有效性,但是其对异源毒株的保护能力尚未可知,该疫苗可以说是目前最可能实现产业化应用的疫苗。
尽管迄今为止在减毒活疫苗方面的研究中发现了针对ASFV的最佳保护效果[56-57],但是其安全性堪忧,从安全角度出发,基于亚单位疫苗的持续研究仍然有趣。亚单位疫苗相对安全,但是缺少保护能力[58-59],且需要多种抗原以及多次免疫,这说明距离研制有效的亚单位疫苗还有巨大的改进空间。由于目前的有效抗原较少,且很多病毒蛋白功能还未可知,今后如果能够解析出更多蛋白的功能,鉴定出更多有效的抗原,或许能够研制出有效的疫苗。
用一种类型的疫苗免疫后,再用表达同样抗原的另一种疫苗加强免疫,能够诱导强的免疫应答。Murgia等[60]用甲病毒表达的p30(RP-30)免疫后,再用天然弱毒株OURT88/3加强免疫拓宽了抗原表位的识别。因此,既然目前ASF疫苗研发有困难,那么可以采用不同疫苗相互组合免疫的方式,可能会给ASF疫苗的研究带来希望。例如,在弱毒活疫苗的研究中,如果在安全性和有效性上无法找到合适的平衡,为了确保安全,可以考虑牺牲一些有效性。然后,通过多次免疫策略与亚单位疫苗联合应用来提高免疫应答水平,弥补疫苗的有效性。
从目前的疫苗研究进展来看,有效的疫苗短期内较难实现产业化[61-62],但是ASFV的基础研究也为将来疫苗的问世奠定了基础。此外,也可以同时研制针对参与ASFV的复制、转录有关的蛋白的抗病毒药物。
