旋毛虫感染对高脂饮食肥胖小鼠的干预作用
2022-09-23仝明薇李承瑶
仝明薇,李承瑶,康 杰,杨 勇
(1.山西医科大学基础医学院,太原 030000;2.吉林大学动物医学院 人兽共患病研究所,长春 130062;3.山西医科大学汾阳学院科技中心,汾阳 032200)
现代生活饮食习惯,尤其是长期的高脂饮食(high fat diet,HFD),常导致肥胖等代谢疾病的出现[1]。当今,肥胖发病率在全球仍持续上涨,且仍然是成人和儿童健康的重要危害之一[2]。2021年8月,卫健委新闻发布会上,有专家表示,在我国成人肥胖率可超50%,而在17岁以下青少年,此数值可达30%。调整饮食结构、运动[3]、药物治疗[4]及手术减肥[5]是目前干预治疗肥胖的主要方法,但主观因素较大,难以持之以恒或存在某些不确定性和风险。因此,探寻能够有效防治肥胖的安全、长效且副作用小的生物制剂将为肥胖防治提供一种新的策略,具有重要意义。
众多流行病学分析和实验研究表明,蠕虫感染率和代谢综合征发病率负性相关[6],表明蠕虫可能具有防治代谢性疾病的潜能。2012 年,发表于Nature Medicine的研究表明,血吸虫糖蛋白及随后被相继报道的钩虫、丝虫和多形螺旋线虫等寄生虫及其虫体抗原,都可以抑制高脂诱导的胰岛素抵抗和肥胖等代谢紊乱[7-10]。以上研究也证明了,蠕虫具有防治代谢疾病的潜能。
旋毛虫(Trichinella.spp.)是一种寄生性蠕虫,其感染所致的旋毛虫病,人兽共患,危害严重[11-12]。那么旋毛虫是否可以像上述蠕虫一样具有防治代谢性疾病的潜能,目前还未可知。因此,我们拟用HFD构建肥胖小鼠模型,探查旋毛虫感染对模型小鼠的干预作用,并初步分析其作用机制,为防治代谢性疾病提供新策略,并可望为后续开发寄生虫免疫调节分子作为新型生物制剂奠定理论基础,具有重要的基础和应用价值。
1 材料与方法
1.1 饲料及主要试剂 基础及高脂饲料购于南通特洛菲饲料科技有限公司;油红O染液购于北京solarbio科技有限公司;TransScript®One-Step gDNA Removal and cDNA Synthesis SuperMixgu购于北京TransGen Biotech股份有限公司。
1.2 动物饮食及分组 30只,4周龄雄性C57BL/6J小鼠购于长春生物制品所。环境适应7 d后,分为两组:ND组,10 只,饲喂基础饲料;HFD组,20 只,饲喂高脂饲料。
1.3 旋毛虫感染 旋毛虫保种及肌幼虫分离参考文献[13]。小鼠饲喂4周后,HFD组小鼠口服感染250条肌肉虫期旋毛虫(HFD+inf 组,n=10),同时设立未感染对照,继续饲喂8 周。实验设计如图1A所示。
1.4 体重、肝重及脂肪重量 小鼠每周称重,饲喂末期,禁食12 h,眼球取血,同时分离肝脏及附睾脂肪组织。参考文献[14],称量肝脏及附睾脂肪湿重并计算相应器官组织指数。
1.5 血清中脂类生化指标检测 将收集的血液于4℃、3500×g离心15 min,获取血清,利用全自动生化仪检测血清总胆固醇(Total Cholesterol,TC)和甘油三酯Triglyceride(TG)的含量。
1.6 HE染色 新鲜获取的肝脏及附睾脂肪组织,经4%多聚甲醛固定,随后常规脱水及二甲苯透明,常规石蜡包埋、切片及HE染色镜下观察各组织的病理学表现。
1.7 油红O染色 厚度约为15 μm的肝脏冰冻切片,经60%异丙醇固定后,用油红O染液染色10~15 min,再经60%异丙醇分色,苏木素复染2 min后,分色、封片,镜下观察肝细胞内的脂滴沉积程度。
1.8 脂肪组织中脂代谢相关基因检测 参考说明书操作,采用Trizol法提取附睾脂肪组织总RNA。随即参考TransScript®One-Step gDNA Removal and cDNA Synthesis SuperMix说明书操作步骤,对总RNA进行反转录。
利用表1中引物,参考相应退火温度,将上述所得的cDNA利用qRT-PCR方法,检测相应附睾脂肪组织中脂代谢基因的表达情况。

表 1 qRT-PCR检测所需引物序列Table 1 Primer sequences of qRT-PCR detection
1.9 数据处理 利用GraphPad prism5.0软件进行结果分析,*P<0.05,**P<0.01,***P< 0.001。体重数据分析中,ND与HFD组相比,#P<0.05,##P<0.01,###P< 0.001;HFD与HFD+inf组相比,*P<0.05,**P<0.01,***P< 0.001。
2 结果
2.1 旋毛虫干预对小鼠体重和表观肥胖的作用 感染旋毛虫后,小鼠无运动障碍、呼吸困难、食欲减退、拉稀等临床症状,与未感染组无明显差别,与先前的报道一致[15]。解剖后发现,感染组小鼠肠道无明显炎症反应。对小鼠膈肌压片镜检查发现肌幼虫卷曲成团,包囊完全形成,肌肉结构与正常组相似,表明旋毛虫在小鼠体内发育完全,成功建立感染。在此基础上,我们进一步分析旋毛虫感染对高脂诱导的肥胖的干预效果。
在实验周期内相比于对照组,HFD和HFD+inf组小鼠体重增长速率较快(图1B)。在高脂饲喂的第3周,ND与HFD两组小鼠体重存在极显著差异(P<0.001),且差异性持续至实验末期。旋毛虫感染后2 周(即高脂饲喂第6周),与HFD组相比,HFD+inf组小鼠体重增长开始减缓,于感染后第5周(高脂饲喂9周),两组小鼠体重增加存在极显著差异(P<0.01)(图1C),直至感染后第7周(高脂饲喂11周),HFD+inf组比HFD组小鼠体重下降4.65%(P<0.05)(图1B),在实验末期也可观察到各组小鼠外观肥胖度上的明显差异(图1D)。说明,旋毛虫干预能够缓解高脂饮食肥胖小鼠的体重增加。
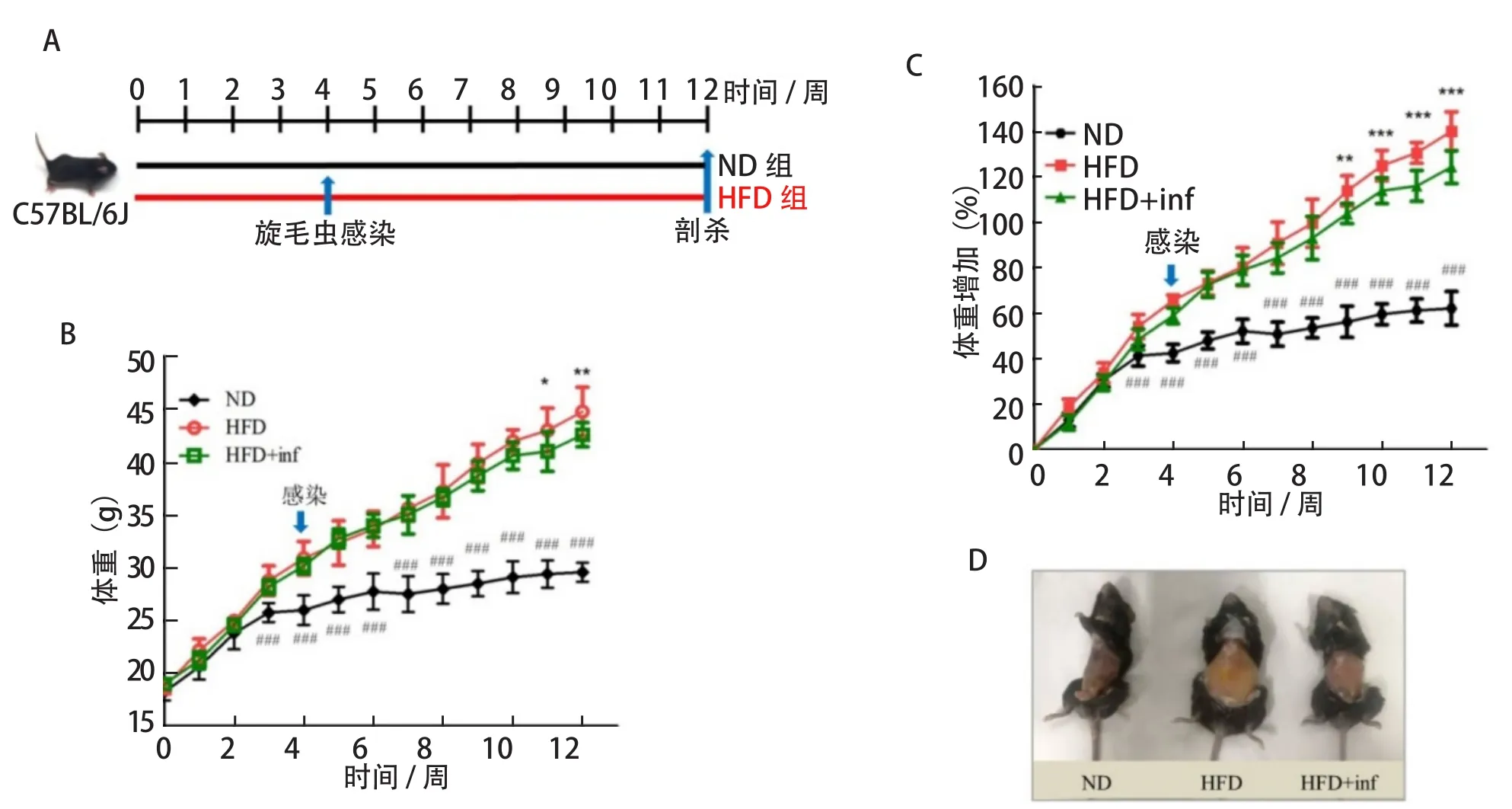
图 1 旋毛虫干预对小鼠体重的作用Fig.1 The effect of Trichinella spiralis on body weight in mice
2.2 旋毛虫干预对小鼠肝指数和附睾脂肪指数的作用HFD组小鼠肝重较ND组升高了1.19倍(P<0.05),但肝指数却显著降低(P<0.01),(图2A、2B),或许是由于高脂饮食所致体重增加显著高于肝重增加引起的。而与高脂组比,HFD+inf组肝重及肝指数虽无显著性变化,但均呈下降趋势,表明旋毛虫感染可以降低高脂饮食小鼠的肝脏脂肪堆积,具有减轻肥胖小鼠肝脏损伤的潜能。与ND组比,HFD组小鼠附睾脂肪的重量和脂肪指数都明显增加(P<0.001)(图2C、2D),可能是因为高脂饮食造成的体内白色脂肪堆积,而旋毛虫感染可以明显降低高脂诱导的小鼠附睾脂肪的重量和相应指数。机体脂肪过度累积被认为是导致肥胖的关键元素之一[16]。因此,旋毛虫感染可以通过降低机体白色脂肪蓄积,减轻肝脏损伤,进而缓解肥胖发生发展。

图2 旋毛虫干预对小鼠肝脏指数和附睾脂肪指数的作用Fig.2 The effect of Trichinella spiralis on liver index and epididymal fat index in mice
2.3 旋毛虫干预对小鼠血脂水平的作用 HFD组血清TC和TG含量显著升高(P<0.01或P<0.05),而旋毛虫干预后TC水平显著降低(P<0.05),TG水平也有减少趋势,表明旋毛虫感染对高脂肥胖小鼠的血脂代谢紊乱具有某种程度的拮抗作用,见图3。

图3 旋毛虫干预对血清脂质水平的作用Fig.3 The effect of Trichinella spiralis on the level of serum lipids in mice
2.4 附睾脂肪组织HE染色分析 慢性营养过量常引起脂肪细胞不健康的扩张。在我们的研究中也可见,HFD导致附睾脂肪细胞体积变大,而旋毛虫感染后HFD+inf组小鼠的附睾脂肪细胞体积有所下降(图4),表明旋毛虫感染能够拮抗HFD引起的脂肪组织中脂质堆积,进而调控肥胖。

图4 附睾脂肪组织HE染色(200 x)Fig.4 Hematoxylin-eosin staining of epididymal fat (200 x)
2.5 肝脏组织油红O染色分析 相比于ND组,HFD组肝组织中有大量红色脂滴聚集,表明长期高脂饮食会诱导肝脏损伤,出现脂肪变性病变特征。而HFD+inf组相比于HFD组,其肝脏组织中脂滴数量减少,大小有所下降,表明旋毛虫感染能够缓解高脂诱导的肝脏脂质聚集,降低肝脏脂质变性的风险(图5)。

图5 肝脏油红O染色(200 x)Fig.5 Oil-red staining of liver (200 x)
2.6 旋毛虫干预对附睾脂肪代谢相关基因表达的作用 机体脂肪过度累积导致肥胖,为了探查旋毛虫感染对肥胖小鼠脂肪代谢的干预作用,我们对旋毛虫干预末期,附睾脂肪中脂代谢基因表达变化情况进行了调查。由图6可见,相比于ND组,HFD组中参与脂质合成的相关基因,脂肪酸合成酶(Fatty Acid Synthase, FAS)和过氧化物酶激活物受体γ(Peroxisome Proliferators-Activated Receptors-γ,PPAR-γ)mRNA的表达显著升高(P<0.01或P<0.001),而在旋毛虫感染后又显著降低(P<0.01或P<0.001)。
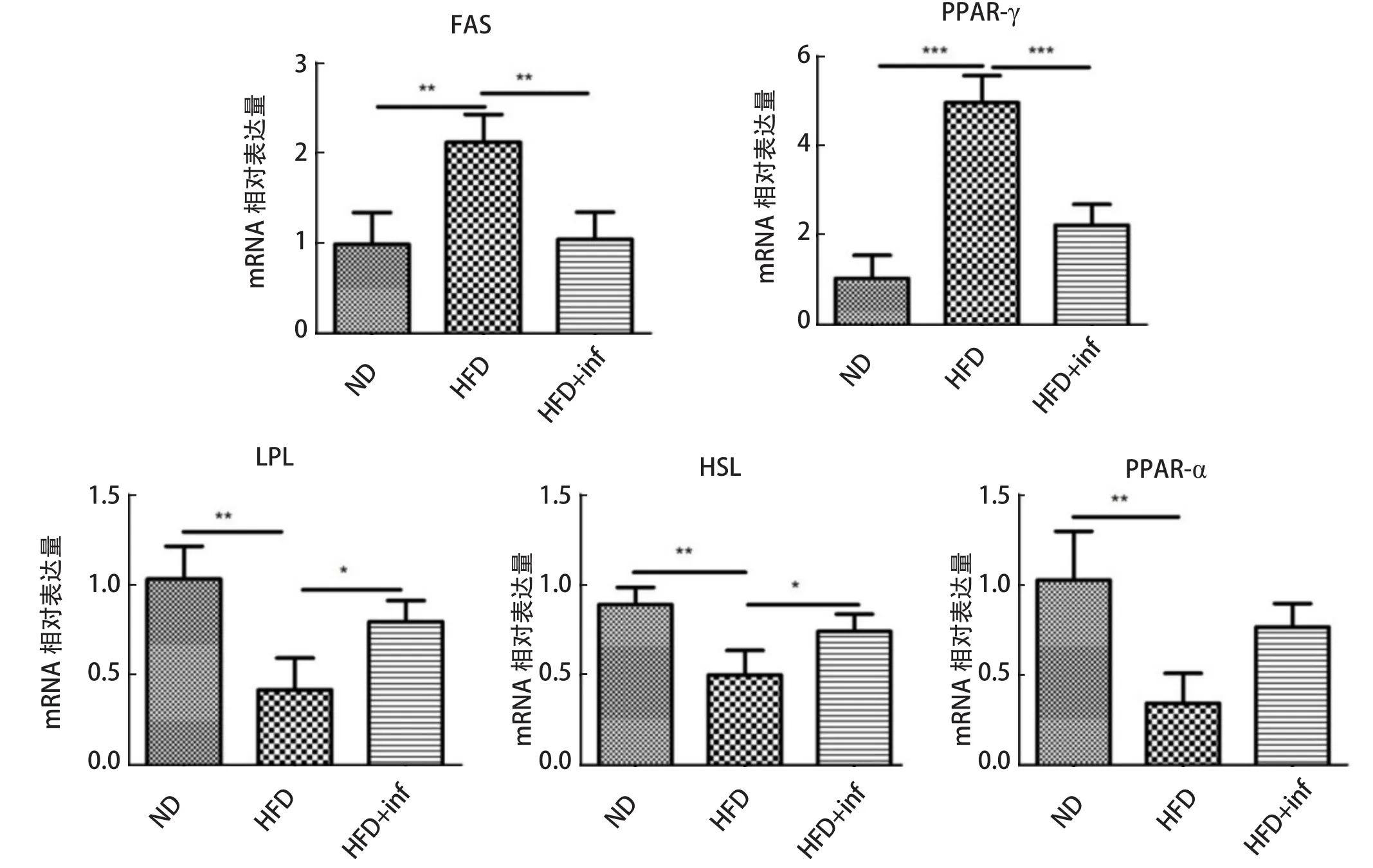
图6 旋毛虫干预对附睾脂肪组织脂代谢相关基因表达水平的作用Fig.6 The effect of Trichinella spiralis infection on the expression levels of genes associated with lipid metabolism in mice
相反,相比于ND组,HFD组附睾脂肪组织中参与脂质分解的相关基因,脂蛋白脂肪酶(Lipoprotein Lipase, LPL)、激素敏感性脂肪酶(Hormonesensitive Lipase, HSL)和过氧化物酶激活物受体α(Peroxisome Proliferators-Activated Receptors-α,PPAR-α)的表达显著下降(P<0.01),而在旋毛虫感染后LPL和HSL的表达明显下降(P<0.05),PPAR-α的表达也有增多趋势,表明旋毛虫干预能够促进高脂肥胖小鼠的脂质分解。
3 讨论
肥胖及其并发症是全球性社会公共健康的重要威胁,然而防治肥胖的方法非常有限。我们以HFD小鼠为模型,探查了旋毛虫感染对肥胖小鼠的干预作用。实验结果表明,旋毛虫感染可以降低肥胖小鼠的体重增加,抑制小鼠血清中脂质的升高和附睾脂肪的脂质累积,并改善肝脏脂质变性的症状。此外,旋毛虫感染可有效降低肥胖小鼠的肝脏质量增加,改善肝脏脂质变性的症状。
Kang等[17]发表了相似研究成果,但研究设计有所不同,他们在小鼠感染旋毛虫数周后再进行高脂饲喂,进而探究旋毛虫感染对肥胖小鼠的预防作用,并发现了与本研究一致的研究结果,进一步说明了旋毛虫感染对高脂饲喂诱导的小鼠体重增加具有一定的改善作用,对防治肥胖具有积极作用。
FAS和PPAR-γ是介导脂质合成的重要酶或转录调控基因。与先前的研究一致[17],我们也发现,在高脂诱导的小鼠中,FAS和PPAR-γ mRNA的转录水平明显下降,说明旋毛虫感染可以降低高脂肥胖小鼠的脂肪酸合成速率,抑制脂肪合成。PPAR-γ除了调节脂质代谢外,在免疫应答调控中也占据重要地位。研究已表明,其可以通过抑制脂肪组织中的T淋巴细胞浸润或诱导巨噬细胞可替代极化从而改善高脂诱导小鼠的葡萄糖代谢平衡[18]。旋毛虫感染可以调节肥胖小鼠的葡糖代谢紊乱[17],那么是否其可以以PPAR-γ为靶标,调节机体免疫应答来执行这一功能需要更深入的调查。LPL、HSL和PPAR-α是调控脂肪酸分解代谢的关键酶或转录调控因子[19-20],在调节TG水解及脂肪酸氧化中占据着关键地位。我们研究发现,旋毛虫感染可以下调这些基因的表达,表明旋毛虫感染可以促进白色脂肪组织的脂解。以上结果表明,旋毛虫可以通调节脂质代谢有效干预肥胖,但具体的机制尚未阐明。
肠道蠕虫及其免疫调节分子可诱导Th2免疫反应和调节性T细胞的表达,反向调节Th1/Th17免疫,这一典型特点可以有效的干预各种自身免疫性疾病,如IBD、关节炎、糖尿病等[21]。肥胖是一个促炎细胞因子表达明显升高的慢性低度性炎症,肥胖性炎症反应与代谢稳态的破坏密切相关,因此被认为是有效干预肥胖的重要靶点。研究表明IL-4能增加小鼠的能量消耗和脂肪分解,而阻断TNF受体介导的信号传导可预防大鼠肥胖[22]。最近的研究发现,重组IL-27干预可明显缓解肥胖小鼠体重增加[23],表明其具有治疗肥胖的潜力。在研究线虫感染对肥胖的干预作用时也发现,IL-13/stat6信号通路在巴西钩虫抑制高脂诱导的体重增加中发挥着重要的作用[24]。那么,旋毛虫是否可以通过调节免疫反应影响宿主代谢平衡,从而改善高脂诱导的肥胖需要进一步的研究。综合以上结果表明,旋毛虫感染可以有效改善高脂饮食诱导的肥胖,其可能是通过抑制机体脂质累积和加速脂质分解发挥作用,因此旋毛虫及其免疫调节分子可为防治肥胖及其它代谢紊乱相关疾病提供一种潜在途径。需要指出的是,寄生虫治疗方式也存在一些弊端,如患者对该对治疗方案的心理负担及出现胃肠不良反应等。近年来蠕虫的免疫调节分子对免疫相关疾病的干预显示出了良好的效果,其安全性与可控性方面均显现优势。因此,蠕虫免疫调节分子的筛选与开发利用是今后发展蠕虫有效干预代谢性疾病的核心方向。
