鸡传染性法氏囊病病毒VP2蛋白的可溶性表达及其免疫原性研究
2022-09-23黄秀英左榕琳李成山
肖 倩,黄秀英,丁 莉,左榕琳,李成山,邢 刚
(1.成都史纪生物制药有限公司,成都 610100;2.北京市华都峪口禽业有限责任公司,北京 101206)
鸡传染性法氏囊病(infectious bursal disease,IBD)是由鸡传染性法氏囊病病毒(Infectious bursal disease virus, IBDV)引起的一种急性、高度接触性传染病,主要侵害鸡的法氏囊,以传播迅速、发病率高、病死率高、病程短为特征,易感鸡群为3~12周龄雏鸡和青年鸡[1]。IBDV可在法氏囊的B淋巴细胞中进行繁殖并损伤B淋巴细胞,从而引起感染鸡的免疫抑制,导致继发感染或疫苗免疫失败[2]。从发现至今,IBDV已给世界各国养禽业造成了巨大的经济损失[3]。
IBDV属于双RNA病毒科禽双RNA病毒属,是一种无囊膜病毒,由A、B两个片段组成,共编码5种蛋白,分别是VP1蛋白、VP2蛋白、VP3蛋白、VP4蛋白和VP5蛋白[4]。其中VP2蛋白是构成IBDV的主要结构蛋白,也是主要的保护性抗原,可刺激机体产生中和抗体。目前IBD亚单位疫苗研发大部分都以VP2蛋白作为主要抗原[5-6]。原核表达因其具有产量高、生产周期短、易于操作、成本低等特点,而成为重组蛋白表达的首选[7],但原核表达的蛋白在大肠杆菌中往往以包涵体形式存在,需复性才能成为具有生物活性的可溶性蛋白[8-9]。本研究利用2019年分离的IBDV超强毒株的VP2基因为模板,构建了重组表达载体pET-30a-VP2,并将其转化至表达菌株BL21中进行原核表达,旨在制备可溶性VP2蛋白并分析其免疫原性,为IBDV亚单位疫苗的研制奠定基础。
1 材料与方法
1.1 质粒及菌毒株 原核表达载体pET-30a购自索莱宝科技有限公司;E.coliDH5α及E.coliBL21购自天根生化科技(北京)有限公司;IBDV超强毒株SD株由中国农业大学禽病研究与防控综合实验室提供;IBDV BC6/85株、IBD标准抗原及标准阳性血清购自中国兽医药品监察所。
1.2 主要试剂 病毒RNA提取试剂盒、超薄琼脂糖凝胶DNA回收试剂盒、HRP标记的兔抗鸡IgY、增强型HRP-DAB底物显色试剂盒及质粒小提试剂盒购自天根生化科技(北京)有限公司;HiScript®Ⅱ Q RT SuperMix for qPCR及ClonExpress®Ⅱ One Step Cloning Kit购自Vazyme公司;DNA marker及LATaq购自TaKaRa公司;限制性内切酶HindⅢ及NcoI购自NEB公司;考马斯亮蓝R-250、4×SDS PAGE上样缓冲液及卡那霉素及IPTG购自索莱宝科技有限公司;蛋白质marker购自Thermo公司。
1.3 引物设计及合成 利用Primer Premier 5.0软件,设计扩增IBDV VP2基因的引物,见表1,扩增目的片段大小为1356 bp。由生工生物工程(上海)有限公司合成。
1.4 IBDV VP2基因片段扩增 根据病毒RNA提取试剂盒说明书,提取IBDV SD株的RNA,并反转录为cDNA。以cDNA为模板,扩增VP2基因,反应体系如下:LATaq25 μL,上、下游引物各2 μL,cDNA模板1 μL,补加ddH2O至50 μL,反应条件为:95℃预变性5 min;95℃变性15 s,54℃退火30 s,72℃延伸2 min,共35个循环;72℃再延伸10 min。反应结束后,进行琼脂糖凝胶电泳,并回收目的片段。
1.5 pET-30a-VP2菌株的构建 用HindⅢ和NcoI双酶切pET-30a质粒,酶切产物与回收的IBDV-VP2片段进行连接,并转化到E.coliDH5α中,筛选阳性克隆,进行PCR鉴定,鉴定正确的送生工生物工程(上海)有限公司进行测序分析。
1.6 重组VP2蛋白的表达与验证 将重组质粒pET-30a-VP2转化至E.coliBL21中,并用终浓度为1 mmol/L的IPTG在28℃进行诱导,诱导后超声破碎,利用SDS-PAGE凝胶电泳验证VP2蛋白的表达。将表达的VP2蛋白转移至硝酸纤维素膜上,用5%脱脂奶粉封闭,以1∶1000倍稀释的IBD阳性鸡血清为一抗,以HRP标记的兔抗鸡IgY作为二抗,进行Western blot鉴定。
1.7 重组VP2蛋白诱导条件优化 分别利用0.1、0.2、0.5 mmol/L和1 mmol/L浓度的IPTG对pET-30a-VP2菌株进行诱导,以确定IPTG的最佳诱导浓度。在IPTG浓度为0.2 mmol/L时,在16℃、28℃、30℃和37℃分别对pET-30a-VP2菌株进行诱导表达,以确定最佳诱导温度。超声破碎上述不同诱导条件的菌液,取上清液,用IBD标准阳性血清测定蛋白的AGP效价,AGP效价最高者确定为最佳表达条件。
1.8 重组VP2蛋白的纯化和鉴定 重组菌按优化好的条件进行诱导表达后,离心收集菌体,超声波裂解菌体,收集上清液过Ni-NTA柱进行纯化,应用SDS-PAGE和Western blot鉴定纯化后的VP2蛋白。
1.9 重组VP2蛋白的免疫原性分析
1.9.1 配苗及免疫 将AGP效价为1∶4、1∶8、1∶16的VP2蛋白分别与吐温-80配制成水相,再与2倍体积的油相乳化制苗。取60只30日龄SPF鸡,随机分为3组,20只/组,分别颈部皮下注射上述不同AGP效价的VP2蛋白疫苗,0.3 mL/只,另取15只同日龄SPF鸡不免疫做对照,分别于隔离器中饲养。
1.9.2 抗体测定及攻毒 于免疫后21 d,在免疫组及对照组种分别随机抽取10只鸡,采血分离血清,使用IBD标准抗原测定血清中的AGP抗体效价。于免疫后21 d,将各免疫组随机分为2个亚组,10只/组,分别用IBDV BC6/85株及SD株进行点眼攻毒,每只0.1 mL(含100 BID),同时,将对照组随机分为3个亚组,5只/组,其中2组作为IBDV BC6/85株及SD株的攻毒对照组,另1组不攻毒作为空白对照。每天观察发病及死亡情况,攻毒后72 h,剖检各组鸡,以法氏囊出现发黄、明显肿大、出血、内有胶冻样分泌物等任一项则判为病变,计算VP2蛋白苗的攻毒保护率。
2 结果
2.1 IBDV VP2基因片段扩增 IBDV进行PCR扩增, 产物经琼脂糖凝胶电泳,出现1条约1356 bp的条带,与预期目的片段大小相符(图1)。
2.2 pET-30a-VP2原核表达载体的构建 菌落进行PCR鉴定,可扩增出1356 bp大小的特异性片段(图2)。将鉴定正确的重组质粒测序,测序结果表明,成功构建了pET-30a-VP2重组质粒。

图2 菌落PCR鉴定Fig.2 Bacterial colony PCR identification
2.3 重组VP2蛋白的表达与验证 表达产物进行SDSPAGE,由图3可知,上清液和沉淀中在37 kDa处都出现与预期大小一致的蛋白条带,且空载体无条带,说明表达的蛋白大部分为可溶性蛋白表达,少部分以包涵体形式存在。Western blot显示在37 kDa出现特异性条带(图4),表明成功构建了表达可溶性VP2蛋白的BL21-VP2菌株。
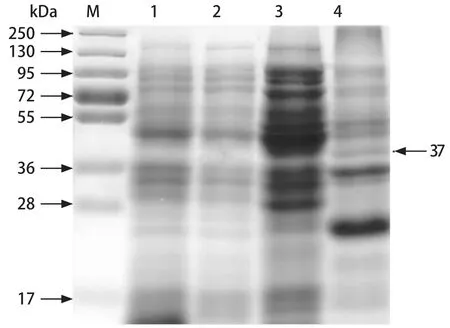
图3 VP2蛋白的SDS-PAGE分析Fig.3 SDS-PAGE analysis of VP2 protein

图4 VP2蛋白的Western blot分析Fig.4 Western blot analysis of VP2 protein
2.4 重组VP2蛋白诱导条件优化 不同浓度的IPTG对pET-30a-VP2进行诱导,IPTG浓度为0.1 mmol/L时,VP2蛋白AGP效价为1∶2;IPTG浓度为0.2、0.5、1.0 mmol/L时,VP2蛋白AGP效价均为1∶4,不随IPTG浓度升高而升高。所以选择IPTG的诱导浓度为0.2 mmol/L。以不同温度对重组菌进行诱导表达,16℃、28℃、37℃诱导时,AGP效价分别为1∶1、1∶4、1∶4,30℃诱导时,AGP效价最高,为1∶16,确定最佳诱导温度为30℃。
2.5 重组VP2蛋白的纯化和鉴定 纯化后的VP2蛋白进行SDS-PAGE,在37 kDa处得到单一的条带,与预期大小相符。进行Western blot鉴定,蛋白能被鸡传染性法氏囊病阳性血清特异性识别,表明纯化的VP2蛋白具有良好的反应原性(图5)。
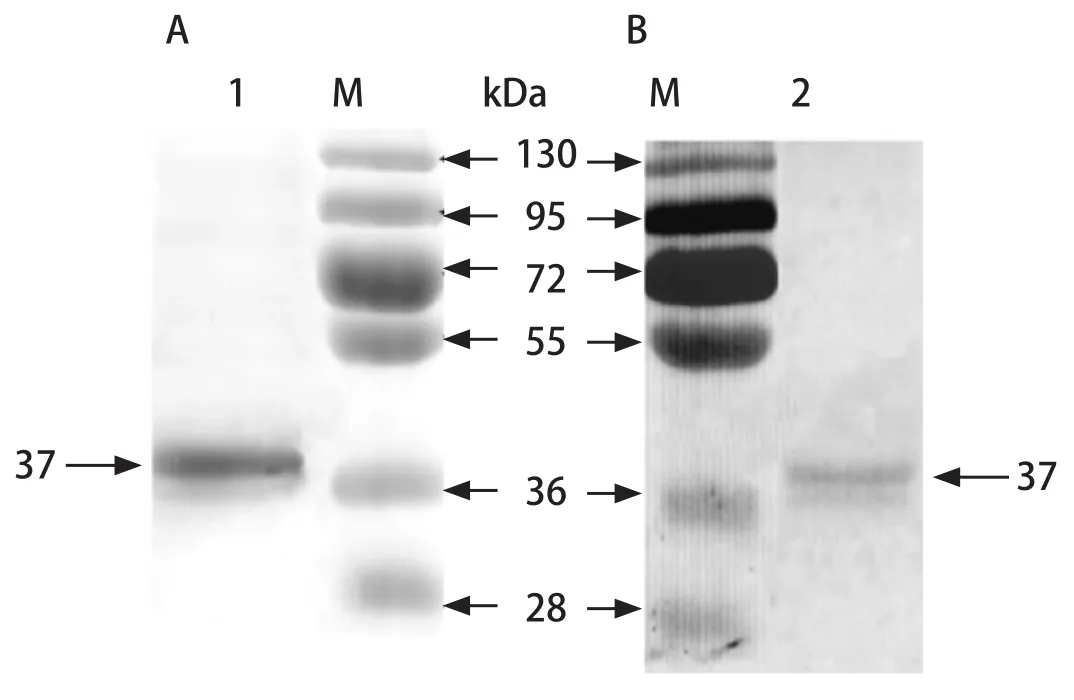
图5 纯化VP2蛋白的SDS-PAGE(A)和Western blot分析(B)Fig.5 SDS-PAGE (A) and Western blot analysis (B) of purified VP2 protein
2.6 重组VP2蛋白免疫原性分析
2.6.1 抗体效价测定 VP2蛋白含量不同的疫苗免疫SPF鸡21 d,免疫组AGP抗体效价随着VP2蛋白含量增加而增加(表2),说明VP2可溶性蛋白具有良好的免疫原性,可有效刺激机体产生较高水平的抗体。

表2 不同VP2蛋白含量的疫苗免疫SPF鸡21 d血清AGP效价检测结果Table 2 Serum AGP titer of vaccine-immunized SPF chickens at 21-day with different VP2 protein content
2.6.2 攻毒试验 各组鸡攻毒72 h后进行剖检,空白对照组法氏囊无病变,2株强毒攻毒对照组均5/5病变,VP2蛋白AGP效价1∶8和1∶16的免疫组对2株强毒的攻毒保护率均为10/10,无法氏囊病变。VP2蛋白AGP效价1∶4的免疫组剖检结果如图5,攻毒BC6/85株的剖检后有3个法氏囊明显的肿大,BC6/85株的保护率为7/10,攻毒SD株的剖检后有2个法氏囊明显的肿大,SD株的保护率为8/10,结果详见表3。以上结果表明,AGP效价不低于1∶8的VP2蛋白疫苗能有效抵抗IBDV超强毒株及经典强毒的攻击。

表3 不同VP2蛋白含量的疫苗免疫SPF鸡21日的攻毒保护结果Table 3 The results of 21-day challenge protection of SPF chickens immunized with vaccine with different VP2 protein content
3 讨论
VP2蛋白是IBDV最主要的结构蛋白,占病毒蛋白总量的51%,与病毒的毒力、致病性、抗原的漂移等密切相关,且能产生中和抗体,所以VP2蛋白成为近年来疫苗研究的热点[10]。Francois等[11]构建了表达感染性IBDV宿主保护抗原VP2的CELO病毒。结果表明,基于CELO的载体能安全诱导鸡对vvIBDV产生较强的保护性免疫。Kim等[12]构建了表达VP2蛋白的pcDNA-VP2疫苗和表达VP2、VP4和VP3蛋白的pcDNA-VP243疫苗,两种质粒DNA疫苗都能对vvIBDV有较高的保护性免疫。李赛赛等[13]在大肠杆菌中表达了VP2-LS3重组蛋白笼纳米颗粒,而且表达的VP2-LS3蛋白具有较好的免疫原性。
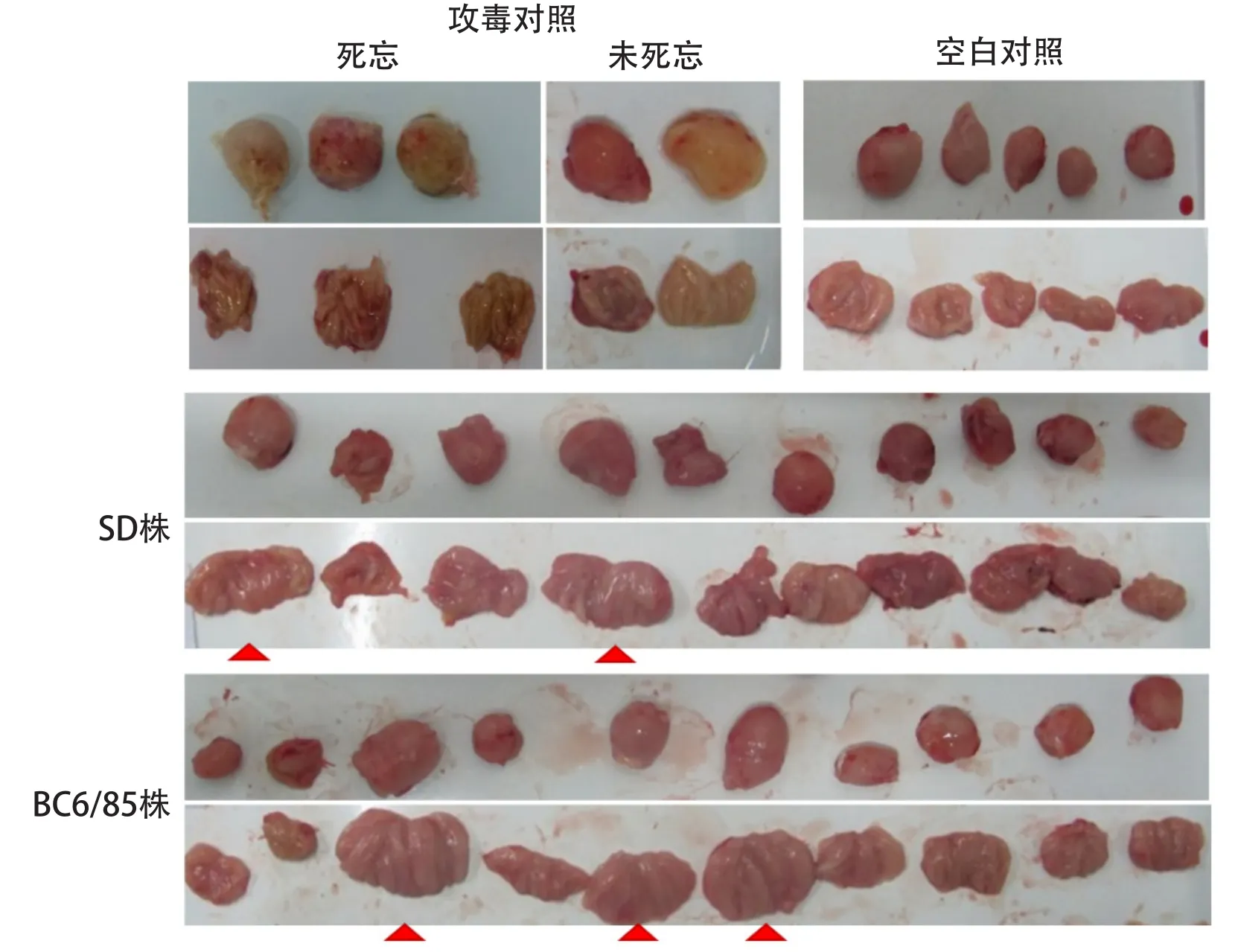
图6 VP2蛋白AGP效价1∶4的免疫组的剖检结果Fig.6 Results of autopsy of VP2 protein with AGP titer of 1∶4
IBDV毒株主要包括了经典株、变异株和超强株[14]。IBDV易变异,对环境有较强的抵抗力,新毒株不断被发现,导致IBD的发生和流行,目前传统的疫苗免疫保护效果不再理想,IBD的防控面临着挑战[15-16]。本研究利用IBDV超强毒株SD株作为模板,扩增与克隆VP2基因,构建了原核表达的重组质粒pET-30a-VP2,在大肠杆菌中成功表达,且表达的VP2蛋白大部分都是以可溶性蛋白的形式存在。SD毒株为2019年分离的IBDV流行毒株,如能制备成为疫苗能够对目前IBDV防控做出巨大的贡献,且本研究的VP2蛋白为大肠杆菌表达的可溶性蛋白,易于生产,蛋白不需要经过变性复性等步骤,为蛋白后期的纯化节约了大量的时间,减少了工作量和成本。AGP试验是检测IBDV的经典方法,该重组VP2蛋白未纯化上清液AGP效价能达到1∶16。将不同AGP效价的VP2蛋白制备成油乳剂疫苗,免疫接种30日龄SPF鸡,免后28 d,免疫鸡血清中AGP抗体效价随蛋白含量增加而增加,说明该蛋白具有良好的免疫原性。对免疫鸡进行超强毒株与经典强毒株攻毒,AGP效价不低于1∶8的VP2蛋白疫苗能有效的抵抗2株强毒的攻击,攻毒保护率为10/10,为IBD VP2蛋白亚单位疫苗的研制奠定了基础。
